Ghidul Gina 2019 pentru tratamentul astmului la adulți
US Pharm. 2020;45(7/8):18-24.
rezumat: stabilirea controlului simptomelor astmului prin intervenții farmacologice și nefarmacologice îmbunătățește calitatea vieții și previne exacerbările la pacienții cu astm. Inițiativa globală pentru astm 2019 oferă recomandări pentru tratamentul astmului organizat în cinci etape care se corelează cu severitatea bolii. Opțiunile de medicație includ corticosteroizi inhalatori (IC), agoniști beta2 cu acțiune lungă, agoniști beta2 cu acțiune scurtă (SABAs), antagoniști ai receptorilor de leucotrienă și corticosteroizi orali. Datele recente arată rezultate nefavorabile pentru SABAs utilizat singur pentru tratamentul necesar al simptomelor astmului ușor. Modificările orientative includ utilizarea unui ICS cu doze mici cu formoterol pentru tratamentul necesar la adulții cu astm bronșic ușor sau pentru utilizare ori de câte ori ar fi utilizat un SABA. Regimurile adecvate și eficiente de medicație, combinate cu consiliere privind tehnica adecvată a inhalatorului, vor ajuta pacienții să atingă obiectivele de gestionare a astmului.
astmul, o boală inflamatorie cronică a căilor respiratorii caracterizată prin hiperreactivitate a căilor respiratorii, poate prezenta simptome precum respirație șuierătoare, dificultăți de respirație, senzație de apăsare în piept și tuse.1 Aceste simptome pot varia în timp și în intensitate, ceea ce face importantă gestionarea eficientă a astmului. Simptomele declanșatoare pot include exerciții fizice, infecții respiratorii virale și factori de mediu, cum ar fi fumatul. Simptomele care sunt lăsate netratate pot duce la exacerbări. O exacerbare este un episod acut în care simptomele se agravează drastic și funcția pulmonară scade progresiv. Orice apariție a unei exacerbări justifică o discuție cu privire la regimul actual de tratament pentru astm al pacientului din cauza riscurilor de spitalizare, vizite de îngrijire de urgență și deces legat de astm.ghidul inițiativei globale pentru Astm din 2019 (Gina) nu recomandă utilizarea unui inhalator beta2 agonist cu acțiune scurtă (SABA) singur pentru tratamentul astmului ușor; în schimb, ei recomandă utilizarea corticosteroizilor inhalatori cu doze mici (ICS)-formoterol, după cum este necesar și pentru terapia de întreținere.2 la pacienții care prezintă astm bronșic sever sau dificil de tratat, alte opțiuni pot fi considerate suplimente la terapia prin inhalator, cum ar fi antagoniștii receptorilor de leucotrienă (LTRAs), tiotropium, biologici, azitromicină și corticosteroizi orali (OCS).
controlul astmului indică măsura în care caracteristicile astmului pot fi observate la pacient sau au fost reduse sau eliminate prin tratament.2 controlul astmului trebuie revizuit în ultimele 4 săptămâni. Pacientului trebuie să i se pună următoarele întrebări: „în ultimele 4 săptămâni, ați avut: 1) simptome de astm în timpul zilei mai mult de două ori pe săptămână? 2)orice treziri nocturne din cauza astmului? 3) pentru a utiliza un ameliorator de astm pentru simptome mai mult de două ori pe săptămână? 4)orice limitări de activitate din cauza astmului?”Dacă pacientul răspunde” nu ” la toate cele patru întrebări, astmul său este bine controlat. Dacă pacientul răspunde „da” la una sau două dintre întrebări, astmul este parțial controlat, dar dacă răspunsul este „da” la trei până la patru dintre întrebări, astmul nu este bine controlat.2 factorii de risc care pot provoca o exacerbare includ astmul necontrolat, fumatul, expunerea la alergeni, poluarea aerului, comorbidități precum obezitatea și utilizarea ridicată a SABA.
evaluarea aderenței la medicamentul inhalat al pacientului este un alt pas important. Există o multitudine de motive pentru care un pacient poate să nu fie aderent la medicamentele pentru astm, inclusiv dificultăți în utilizarea dispozitivelor inhalatoare, costul medicamentelor, uitarea, eșecul de a înțelege instrucțiunile prescrise și percepția că medicamentul nu este necesar.2
managementul și tratamentul
obiectivele terapiei pentru astm includ realizarea controlului simptomelor pentru a menține nivelurile normale de activitate, prevenirea limitării persistente a fluxului de aer și reducerea efectelor adverse ale medicamentelor discutate în tabelul 1. Intervențiile farmacologice și nefarmacologice reduc riscul de exacerbări viitoare care duc la spitalizare sau deces legat de astm.2
Managementul Nonfarmacologic
intervențiile nonfarmacologice pentru toți pacienții cu astm includ exerciții de respirație, activitate fizică crescută, încorporarea unei diete sănătoase și evitarea expunerii la fum și alte substanțe.2 practica yoga și a metodelor de respirație, cum ar fi tehnicile Buteyko și Papworth, modifică modelele de respirație pentru a reduce hiperventilația, promovând astfel reducerea voluntară a utilizării de eliberare și îmbunătățirea simptomelor astmului.3 la pacienții obezi, pierderea în greutate combinată cu exerciții aerobice și de forță de două ori pe săptămână este mai eficientă decât activitatea fizică singură pentru controlul simptomelor.2 consilierea privind tehnica corectă a inhalatorului va ajuta pacienții să atingă obiectivele de gestionare a astmului.
Managementul farmacologic
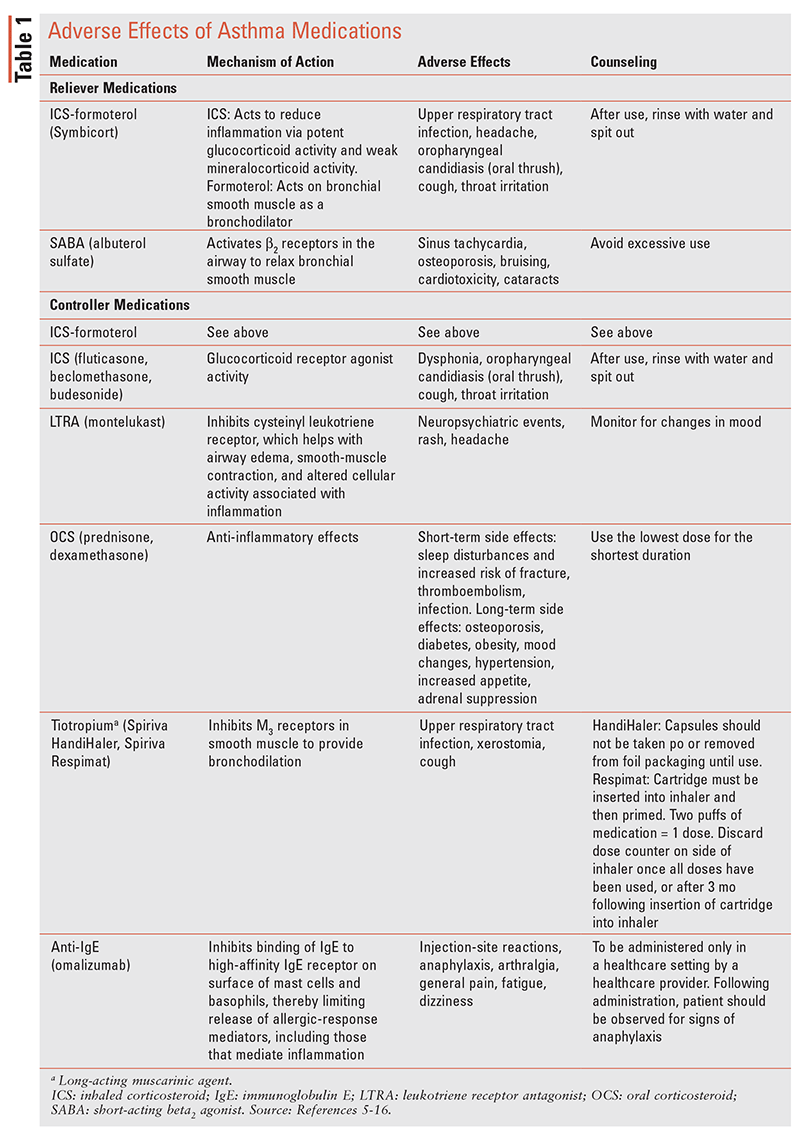
se fac ajustări ale regimurilor de medicamente pentru astm bronșic prin ciclul de control al astmului bronșic descris în Figura 1.2
odată ce a fost pus diagnosticul de astm, trebuie inițiat un tratament cu controlor care conține ICS din cauza îmbunătățirii mai mari a funcției pulmonare decât atunci când tratamentul cu controlor ICS nu este utilizat. Aceasta este o schimbare importantă în orientările GINA din 2019, deoarece anterior a fost recomandat să se acorde pacienților nou diagnosticați un SABA singur. Inhalatorul combinat ICS-formoterol este terapia de eliberare preferată după cum este necesar, indiferent de severitatea astmului. Terapia alternativă de eliberare este un SABA; cu toate acestea, trebuie asociat cu un al doilea inhalator care conține ICS. Inhalatoarele ICS-formoterol sunt sigure și eficiente, iar capacitatea lor de a fi utilizate atât după cum este necesar, cât și pentru terapia de întreținere le face ușor de utilizat pentru pacienți.2
GINA recomandă următoarele etape de tratament pentru astm2:
• Pasul 1: Această etapă este recomandată pacienților cu astm bronșic ușor care prezintă simptome mai puțin de două ori pe lună și nu prezintă risc de exacerbări. După cum sa menționat anterior, pe baza unor noi dovezi, orientările GINA din 2019 nu mai recomandă utilizarea SABA singură pentru tratarea astmului.
* Pasul 2: Regimul de control preferat este ICS cu doze mici-formoterol sau ICS cu doze mici zilnice plus SABA după cum este necesar. Regimul ICS-formoterol evită necesitatea ICS zilnice, oferind în același timp beneficii similare pentru bronhoconstricția indusă de exerciții fizice ca ICS zilnice cu SABA după cum este necesar.
* Pasul 3: tratamentele de control preferate includ un ICS cu doză mică-agonist beta2 cu acțiune lungă (LABA) plus Saba după cum este necesar sau ICS cu doză mică-formoterol atât pentru terapia de întreținere, cât și pentru terapia de eliberare.
* Pasul 4: Tratamentul de control preferat este ICS-formoterol cu doze mici ca terapie de întreținere și eliberare sau ICS-LABA cu doze medii ca întreținere plus SABA după cum este necesar. Rețineți că ICS-formoterol nu trebuie combinat cu un ICS-LABA care conține un LABA diferit.
* Pasul 5: exacerbări persistente sau agravarea simptomelor apare în ciuda aderenței și a tehnicii corecte a inhalatorului. Acești pacienți sunt considerați a avea astm sever sau dificil de tratat și ar trebui să fie direcționați către un pulmonolog.
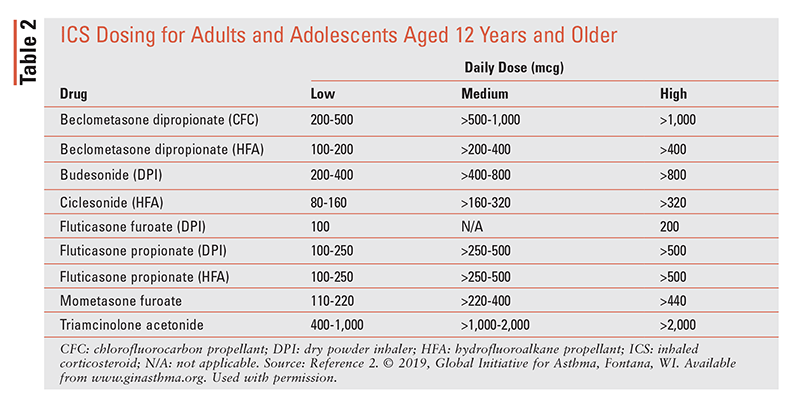
intensificarea etapelor descrise mai sus este adecvată atunci când pacienții au un control persistent slab al simptomelor sau exacerbări, în ciuda tratamentului cu ICS cu doze mici timp de 2 până la 3 luni. Retragerea este adecvată atunci când pacientul are un control bun al simptomelor și o funcție pulmonară stabilă timp de cel puțin 3 luni. Opțiunile de retragere depind de medicamentele pe care le ia pacientul și de pasul pe care îl urmează pacientul, dar pentru majoritatea pacienților, rezultatul este mai rău dacă ICS sau LABA este oprit complet.2 Administrarea ci este prezentată în tabelul 2.
simptomele pot fi evaluate cu instrumente precum chestionarul de Control al astmului, testul de Control al astmului și cele trei întrebări ale Colegiului Regal al medicilor.2 aceste chestionare permit asocierea unui scor cu simptomele și întreabă pacienții despre frecvența și tipurile de simptome, cum ar fi trezirile nocturne și limitările activităților zilnice.
exacerbări
termenul de exacerbare a astmului se referă la agravarea acută a funcției pulmonare și a simptomelor dincolo de ceea ce pacientul prezintă de obicei. Tratamentul de eliberare preferat în timpul unei exacerbări este ICS-formoterol cu doze mici, care poate fi crescut după cum este necesar atunci când simptomele se agravează. Utilizarea unui ICS-LABA (beclometazonă sau budesonidă și formoterol) ca medicament de eliberare și controler îmbunătățește controlul simptomelor și reduce spitalizările și utilizarea OCS în comparație cu aceeași doză sau mai mare a unui controler plus SABA după cum este necesar.4
un curs OCS scurt este o opțiune de tratament în timpul unei exacerbări atunci când pacientul nu răspunde la o doză crescută de eliberare și controlor după 2 până la 3 zile, are antecedente de exacerbări bruște severe sau are o deteriorare rapidă a funcției pulmonare (fluxul expirator maxim sau volumul expirator forțat în 1 secundă<60% din valoarea cea mai bună sau estimată personală).4
efectele Adverse ale medicamentelor pentru astm
vezi Tabelul 1 pentru un rezumat al efectelor adverse ale diferitelor medicamente pentru astm.5-16
astmul sever sau dificil de tratat
astmul sever sau dificil de tratat se referă la astmul necontrolat în etapele de tratament 4 și 5, în ciuda aderenței adecvate la tratament și a tratamentului factorilor contributivi. După evaluarea inițială, pacienții cu vârsta de 12 ani și peste cu astm bronșic controlat inadecvat, care iau un ICS cu doză medie plus un LABA și/sau un al treilea controler, cum ar fi LTRA sau teofilina cu eliberare susținută, sunt trecuți la un studiu cu ICS cu doză mare timp de 3 până la 6 luni. În plus față de creșterea ICS, poate fi luat în considerare un studiu al unui supliment nonbiologic, cum ar fi tiotropium, un modificator de leucotriene sau OCS. Pentru pacienții adulți care au simptome persistente de astm, în ciuda IC-urilor cu doze moderate sau cu doze mari și LABA, orientările GINA din 2019 recomandă azitromicina ca supliment.17
dacă modificatorii nonbiologici, cum ar fi LABA, tiotropium și leucotriene, nu reușesc să gestioneze simptomele astmului unui pacient, atunci biologii pot fi luați în considerare în funcție de preț și de resursele pacientului. Terapia Anti-imunoglobulină E, cum ar fi omalizumab, poate fi luată în considerare la cei cu astm alergic. În cazul în care substanțele biologice nu sunt o opțiune pentru un pacient, poate fi luat în considerare un OCS la o doză de 7,5 mg sau mai puțin pe zi echivalent prednison. Cu toate acestea, OCS sunt asociate cu efecte secundare substanțiale, cum ar fi osteoporoza, obezitatea, diabetul, cataracta, hipertensiunea arterială și supresia suprarenală și, prin urmare, ar trebui considerate ultima linie.17
studii
Un studiu dublu-orb efectuat de O ‘ Byrne și colegii săi au investigat beneficiul utilizării unui ICS plus un SABA în comparație cu tratamentul convențional.18 Un total de 3849 de pacienți cu vârsta de 12 ani sau mai mult cu astm bronșic ușor au fost repartizați aleatoriu la terbutalină (placebo de două ori pe zi plus terbutalină 0,5 mg prn), Budesonidă-formoterol (placebo de două ori pe zi plus Budesonidă-formoterol 200 mcg/6 mcg prn) sau budesonidă de întreținere (budesonidă de două ori pe zi 200 mcg plus terbutalină prn). Obiectivul principal a fost de a determina dacă Budesonidă-formoterol, după cum este necesar, a fost superioară terbutalinei după cum este necesar pentru controlul simptomelor. Acest rezultat a fost măsurat prin intermediul datelor obținute dintr-un jurnal electronic de simptome.
după cum este necesar, budesonida-formoterolul a fost superior în ceea ce privește controlul simptomelor astmului bronșic, comparativ cu terbutalina după cum este necesar la pacienții cu astm bronșic ușor. Pacienții cu Budesonidă-formoterol au prezentat astm bronșic bine controlat timp de 34,4% din săptămâni față de 31,1% din săptămâni în grupul cu terbutalină (P = .046). Terbutalina a fost asociată cu cea mai mare rată anuală de exacerbări severe (0.20) comparativ cu Budesonidă-formoterol (0,07) și budesonidă de întreținere (0,09). Un beneficiu al utilizării budesonidei-formoterolului a fost că expunerea la corticosteroizi a fost redusă din cauza dozei mai mici de budesonidă cu 17% în acest grup comparativ cu grupul de întreținere cu budesonidă (57 mcg față de 340 mcg, respectiv).18
Bateman și colegii săi au cercetat eficacitatea unei componente glucocorticoide inhalate cu un calmant cu acțiune rapidă pentru astm ușor.5 acest studiu multicentric, dublu-orb, de 52 de săptămâni, a inclus 4.215 pacienți cu astm bronșic ușor în vârstă de 12 ani și peste, care au fost eligibili pentru tratament cu glucocorticoizi inhalatori obișnuiți. Participanții au fost împărțiți în două grupuri pentru a evalua dacă terapia de întreținere cu Budesonidă-formoterol sau budesonidă de două ori pe zi a avut o eficacitate mai bună în ceea ce privește ratele anuale de exacerbări severe. Grupul Budesonidă-formoterol a fost neinferior grupului de întreținere a budesonidei pentru exacerbări severe. În plus, doza zilnică mediană măsurată de glucocorticoid inhalat a fost mai mică în grupul Budesonidă-formoterol (66 mcg) decât în grupul de întreținere a budesonidei (267 mcg). Timpul până la prima exacerbare a fost similar între grupuri; cu toate acestea, a existat o diferență de 0,11 U în favoarea grupului de întreținere a budesonidei, care a avut scoruri mai mici la Chestionarul de Control al astmului-5 (ACQ-5) comparativ cu grupul Budesonidă-formoterol. Diferența minimă importantă din punct de vedere clinic în scorurile ACQ-5 este de 0,5 U. În plus, nu a existat nicio diferență în ceea ce privește evenimentele adverse, întreruperile legate de astm sau rata mortalității între cele două grupuri. Acest studiu și studiul O ‘ Byrne susțin actuala recomandare Gina din 2019 împotriva utilizării unui SABA singur și pentru utilizarea ICS-formoterol în schimb.
Un studiu realizat de Gibson și colegii săi a investigat eficacitatea și siguranța azitromicinei orale ca terapie suplimentară la pacienții cu astm persistent necontrolat care iau, de asemenea, o doză medie sau o doză mare ICS plus o LABA.17 în acest studiu randomizat, dublu-orb, controlat cu placebo, cu grup paralel, 420 de pacienți au fost repartizați aleatoriu într-unul din cele două grupuri de tratament (azitromicină 500 mg sau placebo de trei ori pe săptămână timp de 48 de săptămâni). Criteriile finale principale de evaluare a eficacității au inclus rata exacerbărilor totale (severe și moderate) ale astmului bronșic și calitatea generală a vieții legate de astmul bronșic pe parcursul perioadei de studiu.
în studiul Gibson, s-a constatat că azitromicina reduce exacerbările astmului; 44% dintre pacienții cu azitromicină au prezentat cel puțin o exacerbare, comparativ cu 61% dintre pacienții cu placebo (P <.0001). În plus, utilizarea azitromicinei a beneficiat în mod semnificativ de calitatea vieții legate de astm, notată prin îmbunătățirea tuturor categoriilor scalei de rating (adică activitate, simptom, emoție și domenii de mediu) pentru calitatea vieții legate de astm. Singura altă diferență notabilă între grupurile de studiu a fost în apariția diareei, care a fost semnificativ mai mare la pacienții cu azitromicină (34% față de 19% dintre pacienții cu placebo). Pentru monitorizarea siguranței, ECG – urile au fost efectuate la screening, după 6 săptămâni de tratament și la sfârșitul tratamentului. O prelungire a QTc mai mare de 480 ms a dus la retragerea din studiu la doi pacienți (câte unul din fiecare grup).17
modificări în Orientările din 2019
orientările din 2019 includ cinci modificări notabile în ceea ce privește tratamentul astmului la adulți. Prima schimbare este trecerea de la tratamentul numai cu SABA la tratamentul care conține ICS pentru tratamentul necesar al simptomelor în astmul ușor.4 a doua modificare este utilizarea azitromicinei cu doză mică suplimentară de trei ori pe săptămână pentru tratamentul pe termen lung al pacienților cu astm simptomatic, în ciuda tratamentului ICS-LABA cu doză moderată sau cu doză mare; cu toate acestea, ar trebui luate în considerare evenimentele adverse potențiale.17
a treia modificare este recomandarea pentru dupilumab, un anticorp monoclonal alfa al receptorului anti–interleukină-4, ca opțiune suplimentară de tratament pentru pacienții cu vârsta de 12 ani și peste cu astm sever de tip 2 sau astm dependent de OCS.19 Un studiu realizat de Wenzel și colegii săi a demonstrat că dupilumab a crescut funcția pulmonară și a redus exacerbările severe la pacienții cu astm persistent necontrolat.20
a patra modificare constă în includerea tratamentului ICS-LABA cu doze mari numai în etapa 5, în timp ce anterior fusese inclus în etapa 4 cu ICS-LABA cu doze moderate; acest lucru se datorează recomandării ca ICS cu doze mari să fie prescris doar câteva luni pe baza luării în considerare a evenimentelor adverse asociate.17 a cincea modificare este trecerea OCS de întreținere de la o opțiune de tratament” preferată „la” altă opțiune de control ” în etapa 5, pe baza riscului ridicat de rezultate adverse.19
concluzie
pe baza datelor noi, orientările Gina actualizate din 2019 nu recomandă utilizarea unui inhalator SABA singur pentru tratamentul astmului ușor; în schimb, ICS-formoterol cu doze mici este recomandat pentru terapia necesară și de întreținere. Pentru pacienții care prezintă astm sever sau dificil de tratat, alte opțiuni pot fi considerate ca tratament suplimentar la terapia prin inhalator, inclusiv LTRA, tiotropium, biologics, azitromicină și OCS. Pentru a asigura o mai bună aderență la medicamente, regimurile de terapie pentru astm ar trebui să fie specifice pacientului, cu o abordare treptată pentru a găsi un regim care controlează simptomele astmului pacientului, menținând în același timp pacientul cu cea mai mică doză posibilă și ar trebui să fie, de asemenea, rentabil.
1. Fundația pentru astm și alergie din America. Astm. www.aafa.org/asthma-symptoms. accesat la 8 aprilie 2020.
2. Inițiativa globală pentru astm. Strategia globală pentru managementul și prevenirea astmului, 2019. www.ginasthma.org. accesat la 8 aprilie 2020.
3. Santino TA, Chaves GS, Freitas DA, și colab. Exerciții de respirație pentru adulți cu astm. Cochrane baza de date Syst Rev.2020;3(3):CD001277.
4. O ‘ Byrne PM, FitzGerald JM, Bateman ED și colab. Inhalat combinat Budesonidă-formoterol după cum este necesar în astm bronșic ușoară. N Engl J Med. 2018;378(20):1865-1876.
5. Bateman ED, Reddel HK, O ‘ Byrne PM, și colab. După cum este necesar Budesonidă-formoterol versus budesonidă de întreținere în astmul ușor. N Engl J Med. 2018;378(20):1877-1887.
6. Symbicort (Budesonidă-formoterol) prospect. Wilmington, de: AstraZeneca Pharmaceuticals LP; ianuarie 2017.
7. Reed CE. Astmul la vârstnici: diagnostic și management. J Alergie Clin Immunol. 2010;126(4):681-687.
8. ProAir HFA (albuterol) prospect. Frazer, PA: teva respirator, LLC; februarie 2019.
9. Flovent HFA (fluticasone) prospect. Parcul triunghiului de cercetare, NC: GlaxoSmithKline; ianuarie 2019.
10. Singulair (montelukast) prospectul. Stația Whitehouse, NJ: Merck & Co, Inc; aprilie 2020.
11. Waljee AK, Rogers MA, Lin P și colab. Utilizarea pe termen scurt a corticosteroizilor orali și a daunelor asociate în rândul adulților din Statele Unite: studiu de cohortă bazat pe populație. BMJ. 2017; 357:j1415.
12. Foster JM, McDonald VM, M Guo, Reddel HK. „Am pierdut în fiecare aspect al vieții mele”: povara ascunsă a astmului sever. EUR Respir J. 2017; 50 (3):1700765.
13. Rayos (prednison) prospect. Deerfield, IL: Horizon Pharma, Inc; 2012.
14. Spiriva HandiHaler (tiotropium) prospectul. Ridgefield, CT: Boehringer Ingelheim Pharmaceuticals, Inc; februarie 2018.
15. Spiriva Respimat (tiotropium) prospect. Ridgefield, CT: Boehringer Ingelheim Pharmaceuticals, Inc; martie 2019.
16. Prospectul Xolair (omalizumab). South San Francisco, CA: Genentech, Inc; Mai 2019.
17. Gibson PG, Yang IA, Upham JW și colab. Efectul azitromicinei asupra exacerbărilor astmului bronșic și a calității vieții la adulții cu astm bronșic persistent necontrolat (AMAZES): un studiu randomizat, dublu-orb, controlat cu placebo. Lancet. 2017;390(10095):659-668.
18. O ‘ Byrne PM, Barnes PJ, Rodriguez-Roisin R, și colab. Doze mici de budesonidă inhalată și formoterol în astmul persistent ușor: studiul randomizat OPTIMA. Am J Respir Crit Care Med. 2001;164(8):1392-1397.
19. Castro M, Corren J, Pavord ID și colab. Eficacitatea și siguranța Dupilumab în astmul bronșic necontrolat moderat până la sever. N Engl J Med. 2018;378(26):2486-2496.
20. Wenzel S, Castro M, Corren J și colab. Eficacitatea și siguranța Dupilumab la adulții cu astm bronșic persistent necontrolat, în ciuda utilizării de corticosteroizi inhalatori cu doze medii până la mari plus un agonist beta2 cu acțiune de lungă durată: un studiu pivot, de fază 2b, controlat cu placebo, randomizat, dublu-orb. Lancet. 2016;388(10039):31-44.
conținutul din acest articol are doar scop informativ. Conținutul nu este destinat să înlocuiască sfaturile profesionale. Încrederea pe orice informații furnizate în acest articol este exclusiv pe propriul risc.
Leave a Reply