Latență virală: în jos, dar nu în afară
când vă imaginați că virușii se ascund de sistemul imunitar, vă puteți gândi la virusul herpes simplex, responsabil pentru răni și herpes genital, sau virusul varicelo-zosterian, care provoacă zona zoster. Acești viruși pot persista zeci de ani într-o stare asemănătoare hibernării cunoscută sub numele de latență și pot evita detectarea de către sistemul nostru imunitar (Kennedy și colab., 2015). Virușii latenți se pot trezi uneori și pot începe să se reproducă încă o dată, provocând simptome și răspândind infecția (Lieberman, 2016).
virusul imunodeficienței umane (HIV) este în mod similar un maestru artist de evadare. Formează un rezervor latent la începutul infecției, permițând virusului să se sustragă sistemului imunitar și să supraviețuiască pe termen lung. Persoanele care trăiesc cu HIV iau zilnic medicamente cunoscute sub numele de terapie antiretrovirală combinată (sau ART) pentru a preveni replicarea virusului. Cu toate acestea, arta nu este un remediu, deoarece nu vizează viruși care sunt deja latenți. Prin urmare, aceste medicamente sunt administrate pe durata de viață a unui individ: oprirea tratamentului, chiar și pentru câteva săptămâni, va permite virusurilor latente să reactiveze și să reaprindă infecția activă. Persoanele cu HIV se pot aștepta să aibă o viață lungă și sănătoasă din cauza ART, dar virusurile latente vor fi întotdeauna prezente în corpul lor.
găsirea unui remediu pentru HIV necesită posibilitatea de a elimina sau controla rezervorul viral latent. Cu toate acestea, unele întrebări cheie trebuie încă abordate pentru a atinge acest obiectiv. Cum, când și unde stabilește HIV latența? Care este dimensiunea rezervorului latent și cel mai bun mod de a-l măsura? Ce declanșează reactivarea virușilor latenți? Acum, în eLife, Miles Davenport, Brandon Keele și colegii de la Universitatea din New South Wales și Laboratorul Național Frederick pentru cercetarea cancerului – inclusiv Mykola Pinkevych ca prim autor – raportează când rezervorul latent este stabilit într-un model de primat non-uman al HIV și cât de mult din rezervor poate fi reactivat (Pinkevych și colab., 2019).
în acest studiu, echipa a infectat macacii rhesus cu virusul imunodeficienței simian (SIV), un virus precursor care este endemic la maimuțele africane și similar genetic cu HIV (Williams și Burdo, 2009). La un moment dat în secolul 20, SIV a sărit de la primate non-umane la oameni; acest eveniment de transmitere a speciilor încrucișate, împreună cu evoluția rapidă, a permis virusului să se răspândească eficient în oameni și să creeze pandemia HIV în curs de desfășurare (Keele și colab., 2006).
Pinkevych și colab. a început prin infectarea macacilor rhesus cu un SIV proiectat care conține peste 10.000 de secvențe randomizate unice de ADN; odată secvențiate, aceste coduri de bare permit identificarea virușilor individuali (Fennessey și colab., 2017). Maimuțele au fost apoi tratate cu terapie antiretrovirală la 4, 10 sau 27 de zile după infecție. Aceste intervale simulează intervenția acută (4 zile), precoce (10 zile) sau tardivă (27 de zile) cu ART la om. Medicamentele au fost administrate timp de aproximativ un an, iar virusul a fost complet suprimat la toate animalele. Tratamentul a fost apoi oprit și virusul latent a fost lăsat să se reactiveze. Folosind secvențierea genetică și modelarea matematică, echipa a determinat dimensiunea rezervorului latent al SIV și modul în care acesta se va reactiva.
la maimuțe, începerea tratamentului la patru zile după infecție nu a blocat formarea rezervorului latent, dar a redus dimensiunea acestuia de aproximativ 100 de ori comparativ cu inițierea ulterioară a ART. În mod similar, persoanele care încep ART în câteva zile de la dobândirea HIV au un rezervor extrem de mic în comparație cu cei care încep tratamentul mai târziu (Luzuriaga și colab., 2015; Henrich și colab., 2017). În ciuda acestor diferențe mari în dimensiunea totală a rezervorului, odată ce ART a fost oprit, virusurile latente au fost reactivate la rate similare la animalele tratate acut, timpuriu și tardiv (Figura 1). Pinkevych și colab. prin urmare, concluzionăm că majoritatea virusurilor care au potențialul de reactivare stabilesc latența la începutul infecției.
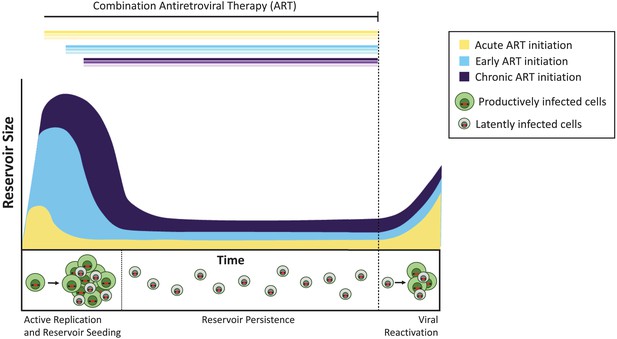
momentul terapiei antiretrovirale influențează dimensiunea rezervorului latent.
fără tratament, celulele infectate cu virusul Replicant activ (celule infectate productiv; prezentat în verde) creează viruși infecțioși. O minoritate de celule infectate conțin viruși care pot persista la nesfârșit ca rezervor latent (celule infectate latent; prezentate în gri), iar acești viruși pot fi reactivați la o dată ulterioară. Tratamentul administrat în timpul fazei acute a infecției (adică în câteva zile sau săptămâni de la infecția primară; curba galbenă) are ca rezultat un rezervor latent mai mic decât atunci când tratamentul este inițiat devreme (în termen de șase luni de la infecție, Albastru deschis) sau în timpul infecției cronice (mai mult de 6 luni de la infecție, violet). Dacă tratamentul este oprit (linie punctată), virusul se reactivează din aceste rezervoare la niveluri similare pentru a reaprinde infecția activă și a re-însămânța rezervorul latent.
pentru a explora de ce momentul tratamentului nu părea să influențeze rata de reactivare, echipa a măsurat nivelul mutațiilor genetice în virusurile latente. Dacă virușii acumulează mutații mai dăunătoare cu cât se reproduc mai mult în organism, acest lucru ar sugera că animalele care primesc artă întârziată ar putea transporta o proporție mai mare de virusuri latente care sunt defecte și nu se pot trezi. Cu toate acestea, echipa a constatat că majoritatea virusurilor (mai mult de 80%) erau intacte genetic la toate animalele, indiferent de momentul în care a început tratamentul. Acest lucru este destul de diferit de ceea ce se întâmplă cu infecția cu HIV la om, unde majoritatea virusurilor latente conțin mutații genetice majore și ștergeri, lăsând doar o mică parte (între 2% și 11%) care sunt capabile de reactivare (Ho și colab., 2013; Bruner și colab., 2019).
Un studiu recent, care a evaluat dinamica rezervorului HIV la persoanele cu ART stabilă, a identificat o altă discrepanță între acest model SIV și latența HIV la om. În ciuda ART în curs de desfășurare, HIV latent poate reactiva uneori spontan și virusurile devin detectabile în sânge pentru o perioadă scurtă de timp. La om, aceste blipuri virale sunt legate filogenetic de un rezervor viral stabilit nu doar la infecția inițială, ci de-a lungul anilor de infecție netratată (Jones și colab., 2018). Motivele care stau la baza acestor diferențe nu sunt bine înțelese și reprezintă domenii importante pentru cercetarea în curs.
În ciuda diferențelor dintre modelele de primate non-umane și infecția umană cu HIV, lucrarea lui Pinkevych și colab. confirmă faptul că latența virală este stabilită extrem de devreme după infecție. Aceste rezultate indică faptul că tratamentul antiretroviral trebuie început cât mai curând posibil pentru a controla infecția cu HIV și a reduce dimensiunea rezervorului latent. Încă nu se cunosc multe despre modul în care latența HIV este stabilită și menținută, în special sub tratament; cu toate acestea, modelele SIV vor rămâne un instrument important pentru a înțelege cum să eradicați rezervorul latent.
Leave a Reply