Rozdíl Mezi Single Double a Triple Dluhopisy
Hlavní Rozdíl – Jeden vs Double vs Triple Dluhopisy
Chemické vazby drží atomy v molekule spolu vytvořením sil mezi elektrony a jádry dvou atomů. Chemické reakce se řídí vytvořením nebo přerušením chemických vazeb. Existují různé typy vazeb, jako jsou kovalentní, iontové, van der Waalovy atd. Vlastnosti vazeb se liší v závislosti na různých aspektech, jako je povaha molekuly, pevný typ (krystalický nebo amorfní) atd. Kovalentní vazby jsou tvořeny sdílením dvou nebo více elektronů. Počet sdíleného elektronu mezi atomy určuje počet vazeb; ať už je to jednoduché, dvojité nebo trojité. Jednoduché, dvojité a trojné vazby jsou proto kovalentní vazby. Hlavní rozdíl mezi jednoduchou dvojitou a trojnou vazbou je počet sdílených elektronů. Pokud je sdílené číslo jeden pár elektronů, vazba bude jediná vazba, zatímco pokud dva atomy Spojené dvěma páry (čtyři elektrony), vytvoří dvojnou vazbu. Trojné vazby jsou tvořeny sdílením tří párů (šesti atomů) elektronů. Tyto sdílené elektrony jsou běžně známé jako valenční elektrony. Tento článek se bude zabývat,
1. Co je to jediná vazba?
– definice, vlastnosti, příklady
2. Co je dvojná vazba?
– definice, vlastnosti, příklady
3. Co je trojná vazba?
– definice, vlastnosti, příklady
4. Jaký je rozdíl mezi jednoduchými dvojnými a Trojnými vazbami?
Co je to jednoduchá Vazba
jednoduchá vazba je tvořena sdílením jednoho páru z valenčních elektronů mezi dvěma sousedními atomy. Jedna vazba je nejjednodušší forma kovalentní vazby, kde každý atom poskytuje jeden valenční elektron. Tyto valenční elektrony jsou umístěny v nejvzdálenější skořápce atomů. Zde jsou negativně nabité sdílené elektrony přitahovány kladně nabitými jádry atomů. Tyto tažné síly drží atomy pohromadě. Toto uspořádání je známé jako jediná vazba. Molekuly s jednoduchými vazbami jsou méně reaktivní na rozdíl od molekul s více vazbami. Navíc jsou slabší než více vazeb a mají vyšší délky vazeb kvůli nízké tažné síle mezi atomy ve srovnání s více vazbami. Jedna vazba je označena pouze jednou pomlčkou; ex: C C. alkany, jako je metan, ethan, propan jsou některé příklady sloučenin s jednoduchými vazbami.
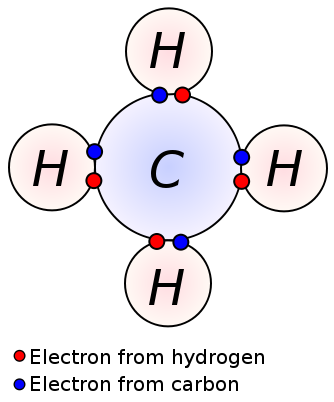
Methan
Co je dvojná Vazba
dvojná vazba je tvořena sdílením dvou párů valenční elektrony se nacházejí v nejvzdálenějších orbit atomů. Sloučeniny s dvojnými vazbami, které jsou vysoce reaktivní než jeden vázané sloučeniny, ale méně reaktivní než sloučeniny s triple dluhopisů. Dvojné vazby jsou označeny dvěma paralelními pomlčkami; ex: C=C. Některé příklady sloučenin s dvojnými vazbami patří alkenů, např. ethylen, propylen, karbonylové sloučeniny (C=O), azo sloučeniny (N=N), iminy (C=N), a sulfoxidy (S=O).
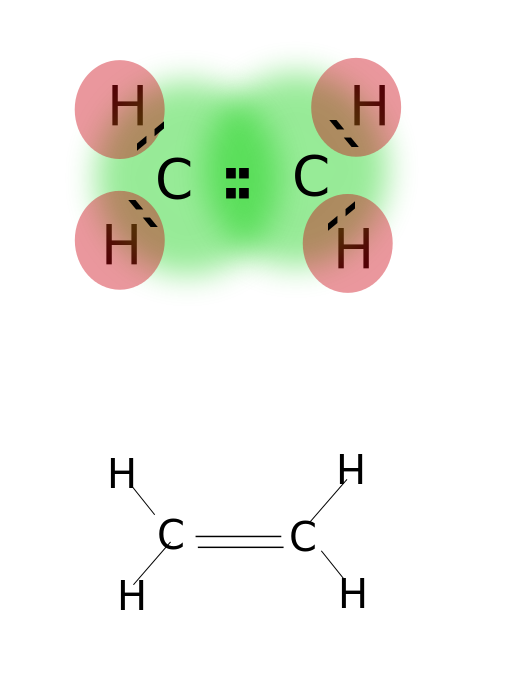
Ethylen
Co je to trojné vazby
Když se dva atomy sdílejí tři páry valenčních elektronů (šest valenčních elektronů), založena dluhopisy jsou tzv. triple dluhopisů. Trojné vazby jsou nejsilnější a nejreaktivnější kovalentní vazby. Ve srovnání s jednoduchými a dvojnými vazbami mají trojné vazby nejnižší délku vazby kvůli vyšší tažné síle mezi dvěma atomy. Triple bond je označován tři paralelní pomlčky mezi dvěma atomy; ex: C≡C. Některé příklady sloučenin s triple dluhopisy zahrnují dusíku (N≡N), kyanidový ion (C≡N), acetylen (CH≡CH) a oxid uhelnatý (C≡O).
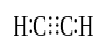
Acetylen
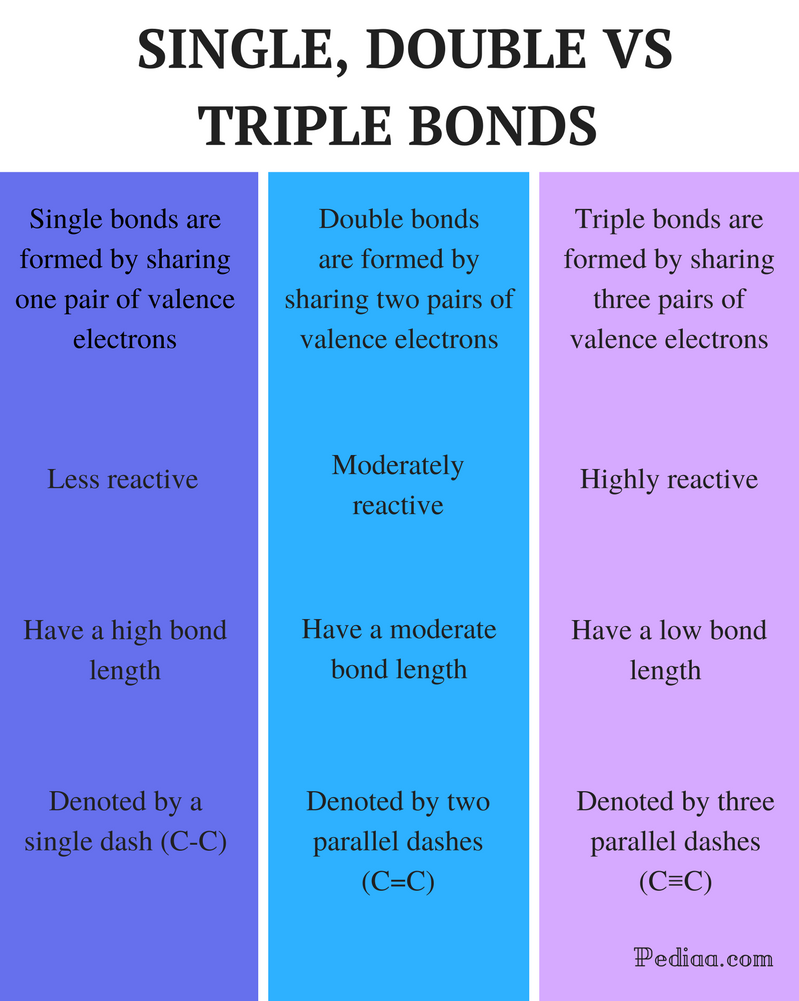
Rozdíl Mezi Single Double a Triple Dluhopisy
Rozlišení:
Single Bond: Jedna vazba je tvořena sdílením jednoho páru valenčních elektronů.
dvojná vazba: dvojná vazba vzniká sdílením dvou párů valenčních elektronů.
trojná vazba: trojná vazba je tvořena sdílením tří párů valenčních elektronů.
reaktivita:
jednoduchá vazba: jednoduché vazby jsou méně reaktivní.
dvojná vazba: dvojné vazby jsou mírně reaktivní.
trojná vazba: trojné vazby jsou vysoce reaktivní.
délka vazby:
jednoduchá vazba: jednoduché vazby mají vysokou délku vazby.
dvojná vazba: dvojné vazby mají střední délku vazby.
trojná vazba: Trojné vazby mají nízkou pevnost vazby.
označeno:
jednoduchá vazba: jednotlivé vazby jsou označeny jedinou pomlčkou (C-C).
dvojná vazba: dvojné vazby jsou označeny dvěma paralelními pomlčkami (C=C).
trojná vazba: trojné vazby jsou označeny třemi paralelními pomlčkami (C≡C).
příklady:
jednoduchá vazba: příklady zahrnují alkany, jako je metan, ethan, propan, butan atd.
dvojná Vazba: Příklady zahrnují ethylen, propen, karbonylové sloučeniny (C=O), azo sloučeniny (N=N), iminy (C=N), a sulfoxidy (S=O).
trojná vazba: Příklady zahrnují plynný dusík (N≡N), kyanidový iont (C≡N), acetylen (CH≡CH) a oxid uhelnatý (C O O).
![]()
Leave a Reply