skillnad mellan enkel dubbel – och trippelbindningar
huvudskillnad-singel vs Dubbel vs trippelbindningar
kemiska bindningar håller atomer i en molekyl tillsammans genom att upprätta krafter mellan elektronerna och kärnorna i två atomer. Kemiska reaktioner styrs genom att etablera eller bryta de kemiska bindningarna. Det finns olika typer av bindningar som kovalenta, Joniska, van der Waals etc. Bindningarnas egenskaper varierar beroende på olika aspekter såsom molekylens natur, fast typ (kristallin eller amorf) etc. Kovalenta bindningar bildas genom att dela två eller flera elektroner. Antalet delad elektron mellan atomer bestämmer antalet bindningar; oavsett om det är singel, dubbel eller trippel. Därför är enkel -, dubbel-och trippelbindningar kovalenta bindningar. Huvudskillnaden mellan enkel dubbel och trippelbindning är antalet delade elektroner. Om det delade numret är ett par elektroner kommer bindningen att vara en enda bindning, medan om två atomer binds av två par (fyra elektroner) kommer det att bilda en dubbelbindning. Trippelbindningar bildas genom att dela tre par (sex atomer) elektroner. Dessa delningselektroner är allmänt kända som valenselektroner. Denna artikel kommer att titta på,
1. Vad är en single Bond?
– Definition, egenskaper, Exempel
2. Vad är en Double Bond?
– Definition, egenskaper, Exempel
3. Vad är en Triple Bond?
– Definition, egenskaper, Exempel
4. Vad är skillnaden mellan enkla dubbel-och trippelbindningar?
Vad är en enda bindning
en enda bindning bildas genom delning av ett par valenselektroner mellan två intilliggande atomer. En enda bindning är den enklaste formen av en kovalent bindning, där varje atom ger en valenselektron. Dessa valenselektroner är belägna i atomernas yttersta skal. Här dras de negativt laddade delade elektronerna av de positivt laddade atomkärnorna. Dessa dragkrafter håller atomerna ihop. Detta arrangemang är känt som en enda bindning. Molekylerna med enkla bindningar är mindre reaktiva till skillnad från molekylerna med flera bindningar. Dessutom är de svagare än flera bindningar och har högre bindningslängder på grund av den låga dragkraften mellan atomer jämfört med flera bindningar. En enda bindning betecknas med bara en enda streck; ex: C C. alkaner såsom metan, etan, propan är några exempel på föreningar med enkelbindningar.
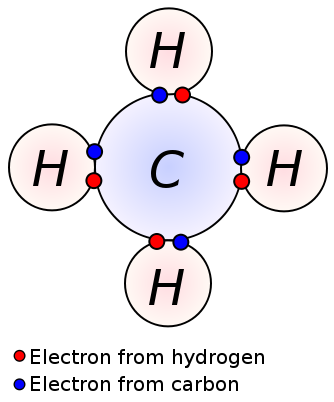
metan
Vad är en dubbelbindning
en dubbelbindning bildas genom att dela två par valenselektroner belägna i atomernas yttersta omlopp. Föreningar med dubbelbindningar är mycket reaktiva än enstaka bundna föreningar men mindre reaktiva än föreningar med trippelbindningar. Dubbelbindningar betecknas med två parallella streck; ex: C=C. Några exempel på föreningar med dubbelbindningar inkluderar alkener såsom eten, Propen, karbonylföreningar (C=o), azoföreningar (N=n), iminer (C=n) och sulfoxider (s=o).
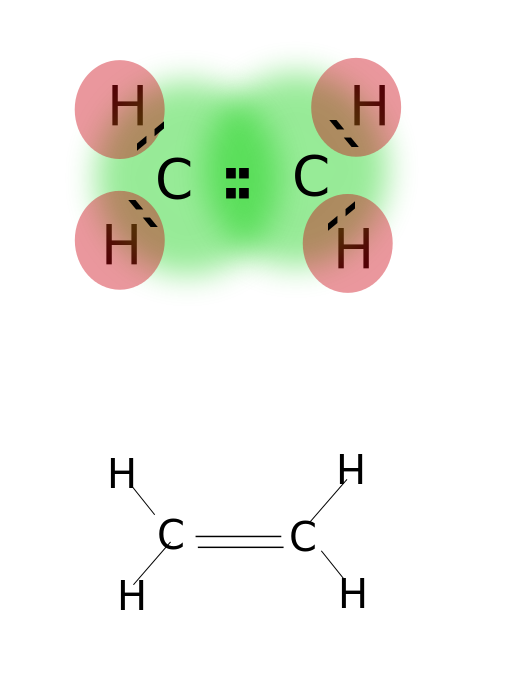
etylen
Vad är en trippelbindning
När två atomer delar tre par valenselektroner (sex valenselektroner) kallas de etablerade bindningarna trippelbindningar. Trippelbindningar är de starkaste och mest reaktiva kovalenta bindningarna. Jämfört med enkel-och dubbelbindningar har trippelbindningar den lägsta bindningslängden på grund av den högre dragkraften mellan två atomer. En trippelbindning betecknas med tre parallella bindestreck mellan två atomer; ex: CMIC C. några exempel på föreningar med trippelbindningar inkluderar kvävgas (Nmic n), cyanidjon (CMIC n), acetylen (CHMIC Ch) och kolmonoxid (CMIC O).
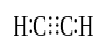
acetylen
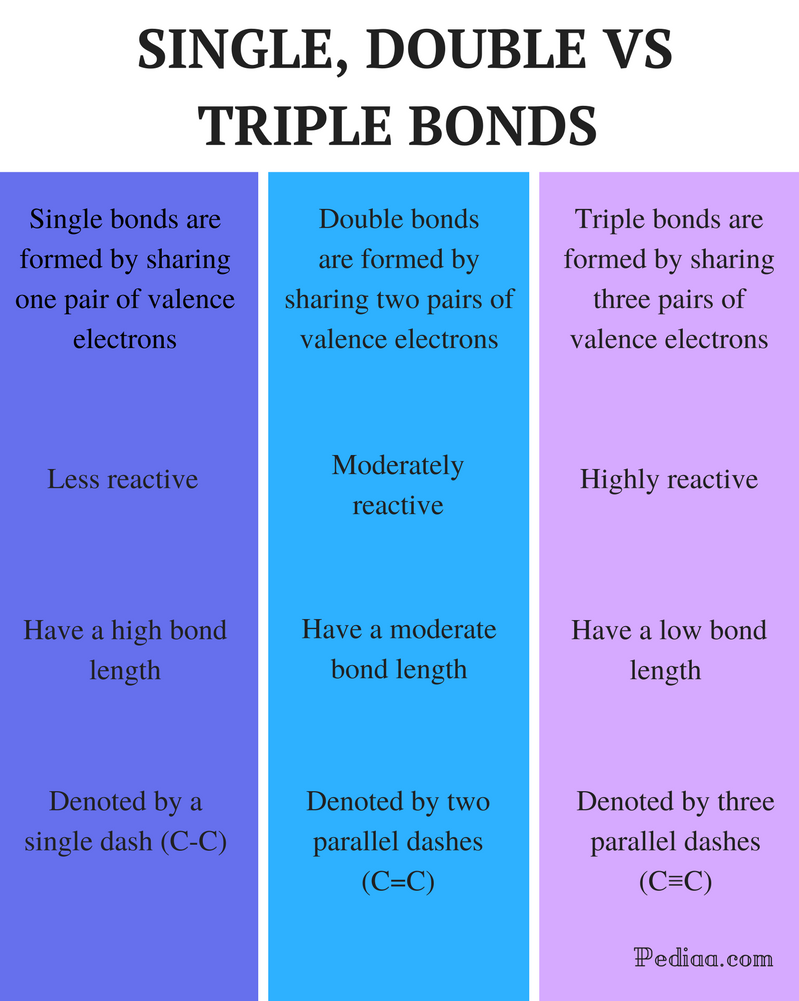
skillnad mellan enkla dubbel-och trippelbindningar
Definition:
enkelbindning: En enda bindning bildas genom att dela ett par valenselektroner.
dubbelbindning: en dubbelbindning bildas genom att dela två par valenselektroner.
trippelbindning: en trippelbindning bildas genom att dela tre par valenselektroner.
reaktivitet:
enkelbindning: enkelbindningar är mindre reaktiva.
dubbelbindning: dubbelbindningar är måttligt reaktiva.
trippelbindning: trippelbindningar är mycket reaktiva.
Bindningslängd:
enkelbindning: enkelbindningar har en hög bindningslängd.
dubbelbindning: dubbelbindningar har en måttlig bindningslängd.
Triple Bond: Trippelbindningar har låg bindningsstyrka.
betecknad med:
enkelbindning: enstaka bindningar betecknas med ett enda streck (C-C).
dubbelbindning: dubbelbindningar betecknas med två parallella streck (C=C).
trippelbindning: trippelbindningar betecknas med tre parallella bindestreck (C-C-C).
exempel:
enkelbindning: exempel inkluderar alkaner såsom metan, etan, propan, butan etc.
dubbelbindning: exempel inkluderar eten, Propen, karbonylföreningar (C=o), azoföreningar (N=n), iminer (C=N) och sulfoxider (s=o).
Triple Bond: Exempel på detta är kvävgas (n-c-n), cyanidjon (C-C-N), acetylen (CH-c-CH-CH) och kolmonoxid (C-C-O).
![]()
Leave a Reply