Unterschied zwischen einfachen Doppel- und Dreifachbindungen
Hauptunterschied – Einfach- gegen Doppel- gegen Dreifachbindungen
Chemische Bindungen halten Atome in einem Molekül zusammen, indem sie Kräfte zwischen den Elektronen und Kernen zweier Atome aufbauen. Chemische Reaktionen werden durch das Herstellen oder Brechen der chemischen Bindungen geregelt. Es gibt verschiedene Arten von Bindungen wie kovalente, ionische, van der Waals usw. Die Eigenschaften der Bindungen variieren in Abhängigkeit von verschiedenen Aspekten wie der Art des Moleküls, dem festen Typ (kristallin oder amorph) usw. Kovalente Bindungen werden gebildet, indem zwei oder mehr Elektronen geteilt werden. Die Anzahl der gemeinsamen Elektronen zwischen Atomen bestimmt die Anzahl der Bindungen; ob es einfach, doppelt oder dreifach ist. Daher sind Einfach-, Doppel- und Dreifachbindungen kovalente Bindungen. Der Hauptunterschied zwischen einfacher Doppel- und Dreifachbindung ist die Anzahl der gemeinsamen Elektronen. Wenn die gemeinsame Zahl ein Elektronenpaar ist, ist die Bindung eine Einfachbindung, während zwei Atome, die durch zwei Paare (vier Elektronen) verbunden sind, eine Doppelbindung bilden. Dreifachbindungen werden gebildet, indem drei Elektronenpaare (sechs Atome) geteilt werden. Diese sich teilenden Elektronen sind allgemein als Valenzelektronen bekannt. Dieser Artikel befasst sich mit
1. Was ist ein Single Bond?
– Definition, Eigenschaften, Beispiele
2. Was ist eine Doppelbindung?
– Definition, Eigenschaften, Beispiele
3. Was ist eine Dreifachbindung?
– Definition, Eigenschaften, Beispiele
4. Was ist der Unterschied zwischen einfachen Doppel- und Dreifachbindungen?
Was ist eine Einfachbindung?
Eine Einfachbindung wird gebildet, indem ein Paar Valenzelektronen zwischen zwei benachbarten Atomen geteilt wird. Eine Einfachbindung ist die einfachste Form einer kovalenten Bindung, wobei jedes Atom ein Valenzelektron liefert. Diese Valenzelektronen befinden sich in der äußersten Hülle von Atomen. Hier werden die negativ geladenen gemeinsamen Elektronen von den positiv geladenen Atomkernen angezogen. Diese Zugkräfte halten die Atome zusammen. Diese Anordnung wird als Einfachbindung bezeichnet. Die Moleküle mit Einfachbindungen sind im Gegensatz zu den Molekülen mit Mehrfachbindungen weniger reaktiv. Darüber hinaus sind sie schwächer als Mehrfachbindungen und haben aufgrund der geringen Zugkraft zwischen Atomen im Vergleich zu Mehrfachbindungen höhere Bindungslängen. Eine Einfachbindung wird nur durch einen einzigen Bindestrich bezeichnet; Ex: C C.. Alkane wie Methan, Ethan, Propan sind einige Beispiele für Verbindungen mit Einfachbindungen.
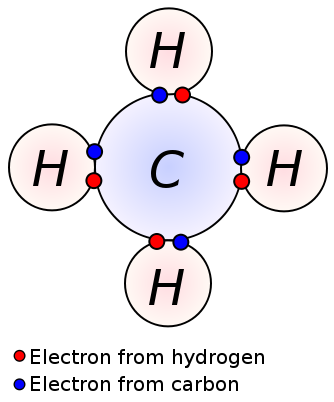
Methan
Was ist eine Doppelbindung?
Eine Doppelbindung wird gebildet, indem zwei Paare von Valenzelektronen geteilt werden, die sich in der äußersten Umlaufbahn von Atomen befinden. Verbindungen mit Doppelbindungen sind hochreaktiv als einfach gebundene Verbindungen, aber weniger reaktiv als Verbindungen mit Dreifachbindungen. Doppelbindungen werden durch zwei parallele Striche bezeichnet; Beispiel: C = C. Einige Beispiele für Verbindungen mit Doppelbindungen umfassen Alkene wie Ethylen, Propen, Carbonylverbindungen (C = O), Azoverbindungen (N = N), Imine (C = N) und Sulfoxide (S = O).
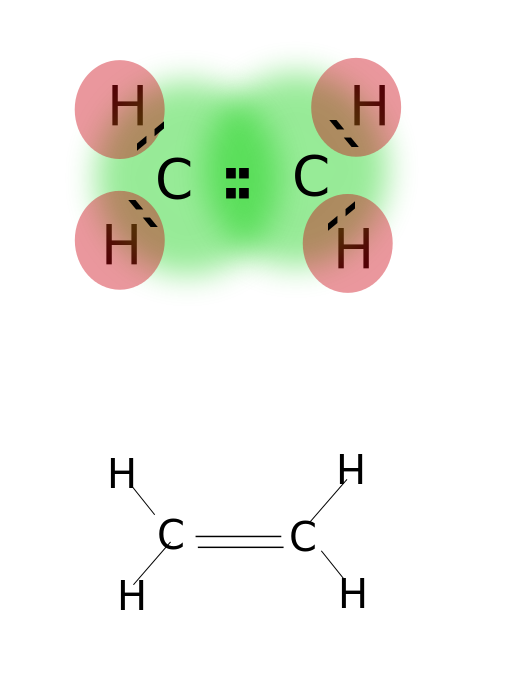
Ethylen
Was ist eine Dreifachbindung
Wenn zwei Atome drei Paare von Valenzelektronen (sechs Valenzelektronen) teilen, werden die etablierten Bindungen Dreifachbindungen genannt. Dreifachbindungen sind die stärksten und reaktivsten kovalenten Bindungen. Im Vergleich zu Einzel- und Doppelbindungen haben Dreifachbindungen aufgrund der höheren Zugkraft zwischen zwei Atomen die geringste Bindungslänge. Eine Dreifachbindung wird durch drei parallele Striche zwischen zwei Atomen bezeichnet; Ex: C≡ C. Einige Beispiele für Verbindungen mit Dreifachbindungen umfassen Stickstoffgas (N≡ N), Cyanidion (C≡ N), Acetylen (CH≡ CH) und Kohlenmonoxid (C≡ O).
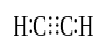
Acetylen
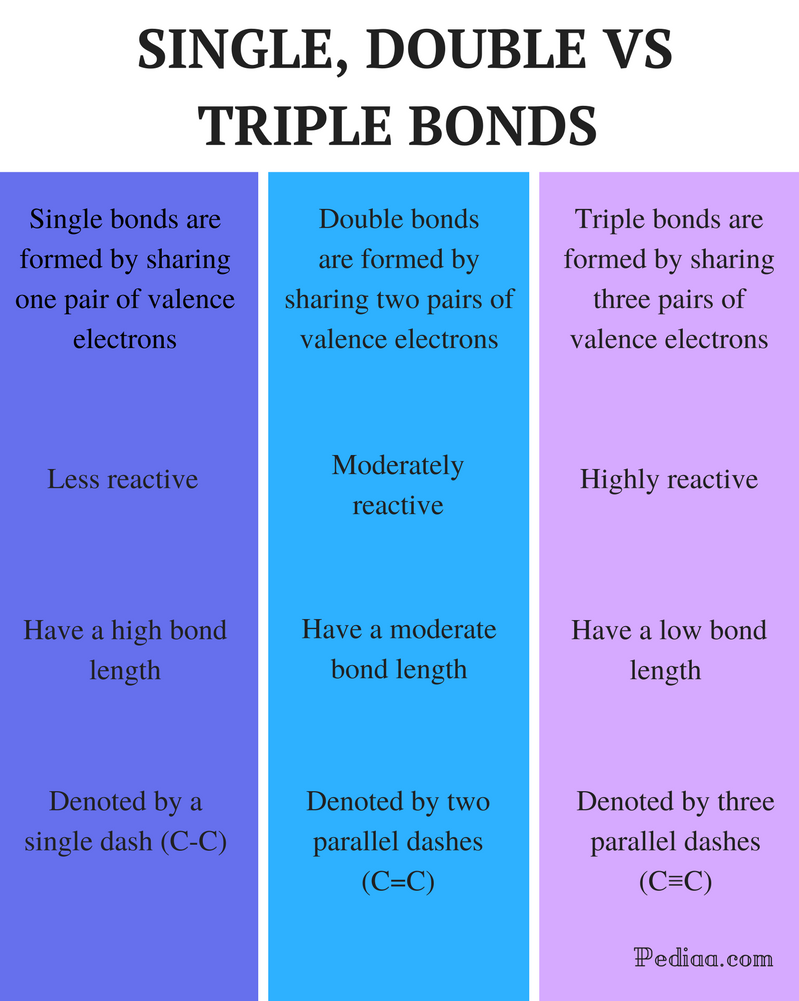
Unterschied zwischen einfachen Doppel- und Dreifachbindungen
Definition:
Einfachbindung: Eine Einfachbindung wird gebildet, indem ein Paar Valenzelektronen geteilt wird.
Doppelbindung: Eine Doppelbindung wird gebildet, indem zwei Paare von Valenzelektronen geteilt werden.
Dreifachbindung: Eine Dreifachbindung wird gebildet, indem drei Paare von Valenzelektronen geteilt werden.
Reaktivität:
Einfachbindung: Einzelbindungen sind weniger reaktiv.
Doppelbindung: Doppelbindungen sind mäßig reaktiv.
Dreifachbindung: Dreifachbindungen sind hochreaktiv.
Bindungslänge:
Einfachbindung: Einfachanleihen haben eine hohe Bindungslänge.
Doppelbindung: Doppelbindungen haben eine moderate Bindungslänge.
Dreifachbindung: Dreifachbindungen haben eine geringe Haftfestigkeit.
Bezeichnet mit:
Einfachbindung: Einzelbindungen werden mit einem einzigen Strich (C-C) bezeichnet.
Doppelbindung: Doppelbindungen werden durch zwei parallele Bindestriche (C=C) bezeichnet.
Dreifachbindung: Dreifachbindungen werden durch drei parallele Bindestriche (C≡C) bezeichnet.
Beispiele:
Einfachbindung: Beispiele umfassen Alkane wie Methan, Ethan, Propan, Butan usw.
Doppelbindung: Beispiele umfassen Ethylen, Propen, Carbonylverbindungen (C = O), Azoverbindungen (N= N), Imine (C = N) und Sulfoxide (S = O).
Dreifachbindung: Beispiele umfassen Stickstoffgas (N≡N), Cyanidion (C≡N), Acetylen (CH≡CH) und Kohlenmonoxid (C≡O).
![]()
Leave a Reply