Diferencia Entre Enlaces Simples Dobles y Triples
Diferencia Principal: Enlaces Simples vs Dobles vs Triples
Los enlaces químicos mantienen unidos a los átomos de una molécula estableciendo fuerzas entre los electrones y los núcleos de dos átomos. Las reacciones químicas se rigen por el establecimiento o la ruptura de los enlaces químicos. Hay varios tipos de enlaces como covalentes, iónicos, de van der Waal, etc. Las propiedades de los enlaces varían dependiendo de varios aspectos, como la naturaleza de la molécula, el tipo sólido (cristalino o amorfo), etc. Los enlaces covalentes se forman compartiendo dos o más electrones. El número de electrones compartidos entre átomos determina el número de enlaces; si es simple, doble o triple. Por lo tanto, los enlaces simples, dobles y triples son enlaces covalentes. La principal diferencia entre el enlace simple doble y triple es el número de electrones compartidos. Si el número compartido es un par de electrones, el enlace será un enlace simple, mientras que si dos átomos están unidos por dos pares (cuatro electrones), formará un enlace doble. Los enlaces triples se forman compartiendo tres pares (seis átomos) de electrones. Estos electrones compartidos se conocen comúnmente como electrones de valencia. Este artículo verá,
1. ¿Qué es un Enlace único?
– Definición, Propiedades, Ejemplos
2. ¿Qué es un Doble Enlace?
– Definición, Propiedades, Ejemplos
3. ¿Qué es un Triple Enlace?
– Definición, Propiedades, Ejemplos
4. ¿Cuál es la diferencia entre Enlaces Simples Dobles y Triples?
Qué es un Enlace simple
Un enlace simple se forma compartiendo un par de electrones de valencia entre dos átomos adyacentes. Un enlace simple es la forma más simple de un enlace covalente, donde cada átomo proporciona un electrón de valencia. Estos electrones de valencia se encuentran en la capa más externa de los átomos. Aquí, los electrones compartidos cargados negativamente son atraídos por los núcleos de átomos cargados positivamente. Estas fuerzas de tracción mantienen unidos a los átomos. Este arreglo se conoce como un solo enlace. Las moléculas con enlaces simples son menos reactivas a diferencia de las moléculas con enlaces múltiples. Además, son más débiles que los enlaces múltiples y tienen longitudes de enlace más altas debido a la baja fuerza de tracción entre los átomos en comparación con los enlaces múltiples. Un enlace simple se denota por un solo guion; por ejemplo: C C. Los alcanos como el metano, el etano y el propano son algunos ejemplos de compuestos con enlaces simples.
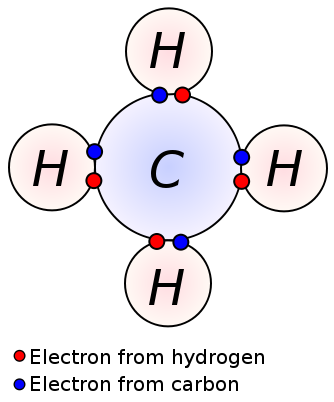
Metano
Qué es un Enlace Doble
Un enlace doble se forma compartiendo dos pares de electrones de valencia ubicados en la órbita más externa de los átomos. Los compuestos con enlaces dobles son altamente reactivos que los compuestos con enlaces simples, pero menos reactivos que los compuestos con enlaces triples. Los enlaces dobles se denotan por dos guiones paralelos; por ejemplo: C = C. Algunos ejemplos de compuestos con enlaces dobles incluyen alquenos como etileno, propeno, compuestos carbonílicos (C = O), compuestos azoicos (N=N), iminas (C=N) y sulfóxidos (S=O).
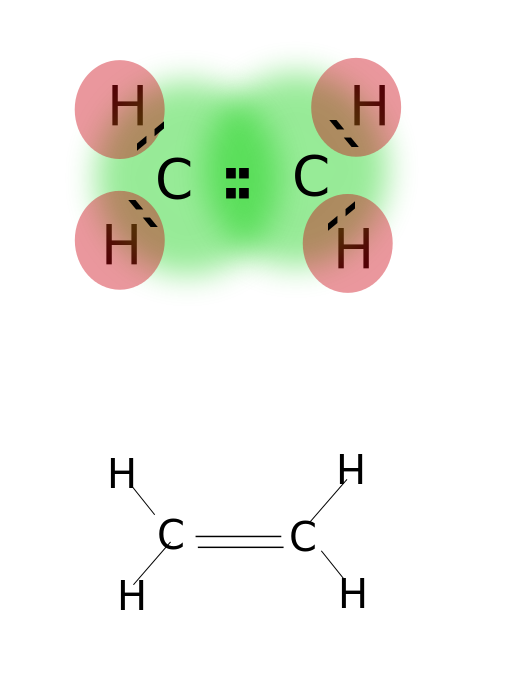
Etileno
Qué es un Enlace Triple
Cuando dos átomos comparten tres pares de electrones de valencia (seis electrones de valencia), los enlaces establecidos se denominan enlaces triples. Los enlaces triples son los enlaces covalentes más fuertes y más reactivos. En comparación con los enlaces simples y dobles, los enlaces triples tienen la longitud de enlace más baja debido a la mayor fuerza de tracción entre dos átomos. Un enlace triple se denota por tres rayas paralelas entre dos átomos; por ejemplo: C C C. Algunos ejemplos de compuestos con enlaces triples incluyen gas nitrógeno (N N N), ion cianuro (C N N), acetileno (CH CH CH) y monóxido de carbono (C.O).
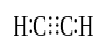
Acetileno
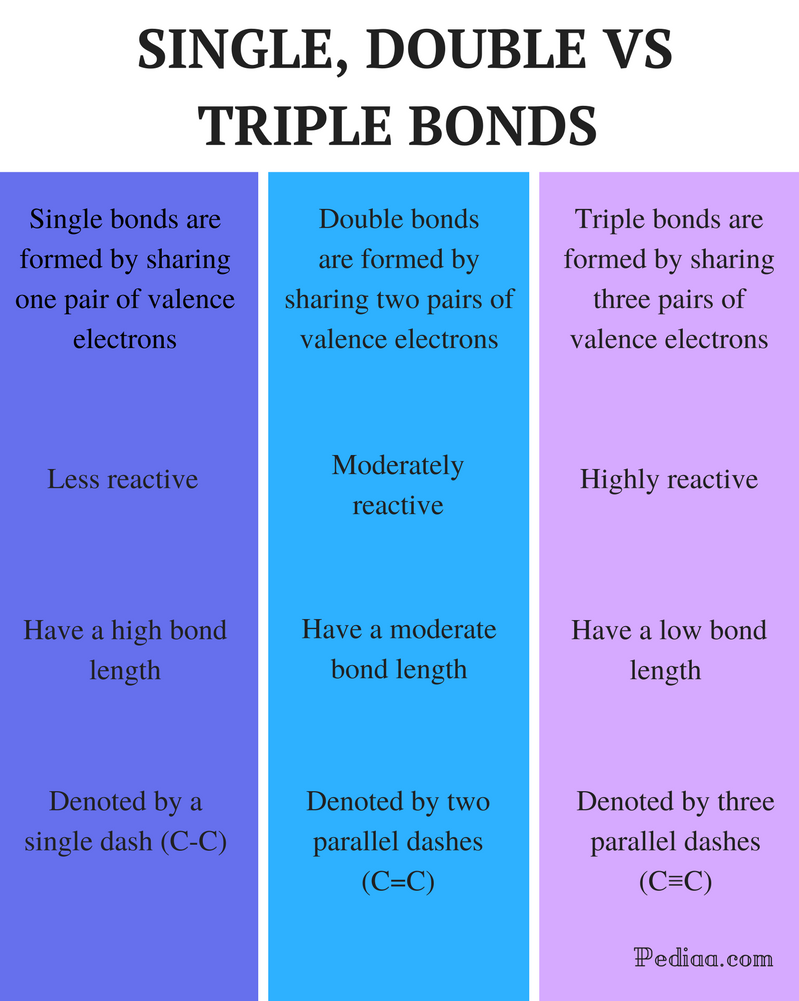
Diferencia Entre Enlaces Dobles Simples y Triples
Definición:
Enlace simple: Un enlace simple se forma compartiendo un par de electrones de valencia.Enlace doble: Un enlace doble se forma compartiendo dos pares de electrones de valencia. Enlace triple: Un enlace triple se forma compartiendo tres pares de electrones de valencia.
Reactividad:
Enlace simple: Los enlaces simples son menos reactivos.
Enlace doble: Los enlaces dobles son moderadamente reactivos. Enlace triple: Los enlaces triples son altamente reactivos.
Longitud de enlace:
Enlace simple: Los enlaces simples tienen una longitud de enlace alta.
Enlace doble: Los enlaces dobles tienen una longitud de enlace moderada.
enlace Triple: Los enlaces triples tienen una resistencia de enlace baja.
Denotado por:
Enlace simple: Los enlaces simples se denotan por un guion simple (C-C).
Enlace doble: Los enlaces dobles se denotan por dos guiones paralelos(C = C).
Enlace triple: Los enlaces triples se denotan por tres guiones paralelos (C C C).
Ejemplos:
Enlace simple: Los ejemplos incluyen alcanos como metano, etano, propano, butano, etc.
Doble enlace: Los ejemplos incluyen etileno, propeno, compuestos carbonílicos (C=O), compuestos azoicos (N=N), iminas (C=N) y sulfóxidos (S=O).
enlace Triple: Algunos ejemplos son el gas nitrógeno (N N N), el ion cianuro (C N N), el acetileno (CH CH CH) y el monóxido de carbono (C O O).
![]()
Leave a Reply