7, 2: kymotrypsiini
Johdanto
kymotrypsiini on yksi tutkituimmista entsyymeistä kaksivaiheisen kinetiikkansa vuoksi: pre – steady-state ja steady state. Näiden kahden kineettisen tilan tutkimus osoittaa ”Ping-Pong” – mekanismin, kovalenttisten kompleksien muodostumisen, joka johtaa kovalenttisiin hydrolyysireaktioihin, ja katalysoitujen reaktioiden nopeuden. Kymotrypsiinin synteesi tapahtuu pääasiassa haimassa. Aktiivisen muodon sijaan sitä valmistetaan kuitenkin inaktiivisena tsymogeeninä eli kymotrypsinogeeninä, jotta sen proteaasitoiminta ei pilkkoisi haimaa. Erittyessään ohutsuolen luumeniin se muuttuu aktiiviseen muotoonsa toisen entsyymin, trypsiinin, avulla. Tämä eri entsyymin riippuvuus proteaasin aktivointiin on yleinen tapa, jolla elimistö estää elinten pilkkoutumista ja muita haitallisia entsymaattisia sivuvaikutuksia.
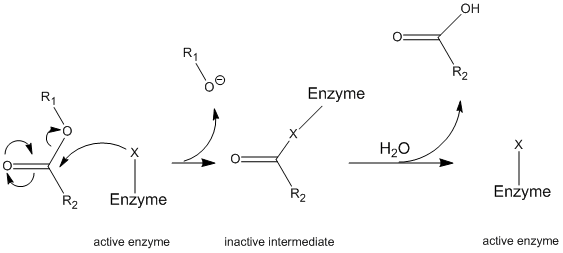
kymotrypsiini toimii ping-pong-mekanismina tunnetun yleismekanismin (Kuva \(\PageIndex{1}\)) kautta, jossa entsyymi reagoi substraatin kanssa muodostaen entsyymiväliaineen. Tällä välituotteella on erilaiset ominaisuudet kuin alkuperäisellä entsyymillä, joten alkuperäisen entsymaattisen aktiivisuuden regeneroimiseksi sen on reagoitava sekundaarisen substraatin kanssa. Tämä prosessi on kuvattu alla:

tarkemmin kymotrypsiini toimii tietyntyyppisen pingismekanismin eli kovalenttisen hydrolyysin kautta. Tällöin entsyymi muodostaa ensin kovalenttisen sidoksen kohdesubstraatin kanssa, jolloin stabiilimpi osa siirtyy liuokseen. Tätä entsyymi-substraattikompleksia kutsutaan entsyymin välituotteeksi. Tämän jälkeen Välituote reagoi veden kanssa, jolloin alkuperäisen substraatin jäljellä oleva osa syrjäytyy ja alkuperäinen entsyymi uudistuu.
kymotrypsiini, kuten useimmat entsyymit, on spesifinen substraateille, joiden kanssa se reagoi. Proteaasina se pilkkoo polypeptidejä, ja sen luontainen spesifisyys sallii sen vaikuttaa vain aromaattisten jäämien karboksipäätteeseen. Se on hieman monimutkainen mekanismi, ja se on parhaiten selitetty useita vaiheita.
1. Kohde menee kymotrypsiinin aktiiviseen kohtaan, ja sitä pitävät siellä hydrofobiset vuorovaikutukset altistuneiden ei-polaaristen entsyymijäämäryhmien ja substraatin ei-polaarisen aromaattisen sivuketjun välillä. On tärkeää huomata histidiini-57: n Schiff-typen ja seriini-195: n happisivuketjun välinen vetysidos.
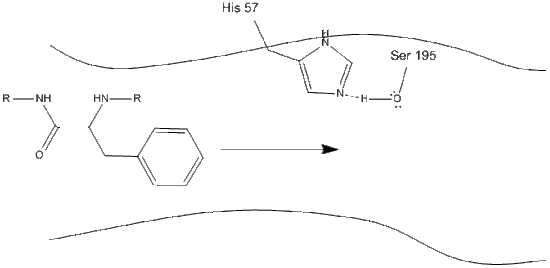
2. Histidiini-seriini-vetysidoksen avulla seriini-195: n hydroksyyliryhmä suorittaa nukleofiilisen hyökkäyksen aromaattisen aminohapon karbonyylihiileen siirtäen samalla hydroksyylivedyn histidiini-Schiff-typpeen. Tämä hyökkäys työntää pi-karbonyylielektronit karbonyylihapelle, jolloin muodostuu lyhytikäinen väli, joka koostuu C-terminaalisesta hiilestä, jossa on neljä yksittäistä sidosta: happianioni, aromaattisen aminohapon beetahiili, substraattiproteiinin myöhemmän aminohapon n-terminus ja seriini-195-sivuketjun happi.
.gif?revision=1&size=bestfit&width=720&height=192)
3. Tämä Välituote on lyhytikäinen, sillä oksianionielektronit uudistavat pi-sidoksen aromaattisen aminohapon C-terminaalilla. Aromaattisen aminohapon karboksiterminaalin ja myöhemmän jäännöksen n-terminaalin välinen sidos halkaistaan, ja sen elektroneja käytetään protonoidun Schiff-typen vedyn erottamiseen histidiini-57: stä. Karbonyylihiilen ja seriini-195-hapen väliset sidokset jäävät esterikonfiguraatioon. Tätä kutsutaan asyyli-entsyymin välituotteeksi. Polypeptidin C-terminaalinen puoli on nyt vapaa irrottautumaan entsyymin aktiivisesta kohdasta.

4. Vesimolekyylit pystyvät nyt tunkeutumaan ja sitoutumaan aktiiviseen kohtaan veden vetyatomien ja histidiini-57 Schiff-typen välisen vetysidoksen kautta.

5. Veden happi tekee nyt nukleofiilisen hyökkäyksen asyylientsyymiväliaineen karbonyylihiileen työntäen karbonyylin pi-elektronit karbonyylihiileen histidiini-57: n erottaessa yhden protonin vedestä. Tämä muodostaa toisen kvaternäärisen hiilen kovalenttisesti sitoutuneena seriinin, hydroksyylin, oksianionin ja aromaattisen aminohapon kanssa. Vastikään protonoidun histidiini-57: n protoni pystyy nyt tekemään vetysidoksen seriinihapen kanssa.

6. Oksianionielektronit uudistavat karbonyylipi-sidoksen pilkkoen karbonyylihiilen ja seriinihydroksyylin välisen sidoksen. Seriinihappi käyttää tämän sidoksen elektroneja histidiini Schiffin typen deprotonointiin ja alkuperäisen entsyymin uudistamiseen. Substraatilla ei ole enää affiniteettia aktiiviseen kohtaan, ja se irtoaa pian kompleksista.

Leave a Reply