Fosfofruktokinaasi (PFK)
sisältö
- 1 Johdanto
- 2 rooli Glykolyysissä
- 3 mekanismi ja Fosfofruktokinaasin säätely
- 4 säätely
- 5 Konformaatiomuutosta PFK: n Dimeerisessä yksikössä
- 6 tärkeimmät Konformaatiomuutokset PFK: n alayksikkö.
- 7 paikkaan kohdistuva mutageenisuus
- 8 tauti
- 9 PFK: n 3D-rakenteet
Johdanto
Fosfofruktokinaasi-1 (PFK-1) on glykolyyttinen entsyymi, joka katalysoi fosforyyliryhmän siirtymistä tuottoon ja . Katso Glykolyysientsyymit. Mg2+ on tärkeä myös tässä reaktiossa (). Fosfofruktokinaasi-2 (PFK-2) vaikuttaa samoihin substraatteihin tuottaen ADP: tä ja . . PFK-reaktio on fysiologisissa olosuhteissa voimakkaasti eksergoninen (irreversiibeli) ja siten yksi glykolyyttisen reitin nopeutta määräävistä vaiheista. Useimmissa organismeissa/kudoksissa PFK on glykolyyttisen reitin tärkein vuonsäätelyentsyymi; sen toimintaa säätelevät epätavallisen suuren määrän metaboliitteja, kuten ATP, ADP, AMP, PEP ja fruktoosi-2,6-bisfosfaatti.
on identtisistä 320-jäämäisistä alayksiköistä koostuva tetrameeri. Se on allosteerinen entsyymi, joka kuvataan allosterismin symmetriamallilla, jossa tapahtuu yhtenäinen siirtyminen korkea-aktiivisesta R-tilasta matala-aktiiviseen T-tilaan. Entsyymin sekä R-että T-tilojen Röntgenrakenteista on raportoitu. Yhden molekyylin sitoutuminen substraattiinsa F6P, joka sitoutuu R-tilan entsyymiin suurella affiniteetilla mutta t-tilan entsyymiin pienellä affiniteetilla, saa PFK: n ottamaan R-tilan, mikä puolestaan lisää entsyymin sitoutumisaffiniteettia ylimääräiseksi F6P: ksi (homotrooppinen vaikutus). Aktivaattorit, kuten ADP ja AMP sitoutuvat niin sanottuihin allosteerisiin paikkoihin, jotka ovat aktiivisesta kohdasta erillisiä sitoutumispaikkoja, joissa ne myös helpottavat R-tilan muodostumista ja siten aktivoivat entsyymin (heterotrooppinen vaikutus; ADP, joka on PFK-reaktion tuote, sitoutuu myös entsyymin aktiiviseen kohtaan). Vastaavasti inhibiittorit kuten Pep sitoutuvat allosteerisiin kohtiin (jotka PFK: n tapauksessa ovat päällekkäisiä aktivoivan allosteerisen kohdan kanssa), joissa ne edistävät T-tilan muodostumista estäen siten entsyymiä.
kaksi entsyymin aktiivisesta kohdasta sijaitsee magentan aktiivisen kohdan rajapinnassa syaanin substraattien kanssa. Kaksi muuta aktiivista kohdetta ovat alayksiköiden B (vihreä) ja C (vaaleanpunainen) rajapinnassa. Alayksikön d (keltainen) lähikuva osoittaa, että molempien alayksiköiden a (vaaleansininen) ja D (Keltainen) aminohapot vaikuttavat F6P: n sitoutumiseen. allosteerisista paikoista kaksi sijaitsee alayksiköiden C ja D rajapinnassa. A-alayksikön lähikuva osoittaa molempien alayksiköiden panokset ADP: n sitomiseen. PFK: n R-ja T-valtioiden väliset konformaatiomuutokset esitetään seuraavassa.
R state PFK: n atomikoordinaatit saatiin 4pfk: lta; t state PFK: n atomikoordinaatit saatiin Philip Evansilta, MRC Laboratory of Molecular Biology, Cambridge, U. K., mutta ne ovat nyt saatavilla nimellä 6pfk.
rooli Glykolyysissä
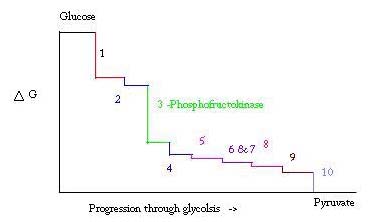
Glykolyysillä tarkoitetaan prosessia, jossa valmistetaan ja hajotetaan glukoosia palorypälehapoksi, jota käytetään anaerobisessa hengityksessä tai yhtenä sitruunahappokierron lähtöaineista. Kolme pistettä glykolyysin prosessissa esiintyy suurella negatiivisella vapaalla energialla ja ovat siksi peruuttamattomia. Nämä kolme pistettä ovat heksokinaasi, fosfofruktokinaasi ja pyruvaattikinaasi; näistä kolmesta PFK: ta pidetään lihaksen glykolyysin tärkeimpänä säätelypisteenä ΔG= -25.9 kJ/mol.
Fosfofruktokinaasin mekanismi ja säätely
Fosfofruktokinaasi sitoo sekä Mg2+-ATP: tä että fruktoosi-6-fosfaattia (F6P) muodostaen fruktoosi-1,6-bisfosfaattia ja Mg2+-ADP: tä. Vaikka kuvaa näistä molemmista tuotteista ei ole määritetty, sitoutuminen entsyymiin on ollut. Ligandien sitoutumispaikkoja on kolme alayksikköä kohden. Kaksi muodostaa aktiivisen kohdan, joka sitoo F6P: tä ja ATP: tä, kun taas kolmas on allosteerinen sitoutumiskohta. Joitakin ehdotettuja jäämiä, jotka liittyvät aktiiviseen kohtaan, ovat . PFK on olemassa kahdessa konformaatiotilassa, molemmissa ja jotka ovat tasapainossa. ATP sitoutuu sekä aktiivisiin että allosteerisiin kohtiin molemmissa konformaatioissa. Vaikka ATP sitoutuu aktiiviseen kohtaan yhtä hyvin, se sitoo ensisijaisesti T-tilan allosteerista kohtaa tämä etuoikeutettu sitoutuminen aiheuttaa siirtymisen kahden tilan tasapainotilasta suurempaan määrään t-tilaa , mikä vähentää affiniteettia F6P: hen. sitoutuu myös allosteeriseen kohtaan kasvattaakseen R-tilan fosfofruktokinaasin suhdetta. Yhdessä ADP: n,AMP: n ja F2: n kanssa 6P estää ATP: n sääntelyn. PFK: N Km ATP on .020 mm ja .032mm.
säätely
glykolyysi on eloonjäämisen kannalta välttämätön metabolinen prosessi. Siksi sen aktivointi ja tukahduttaminen on erittäin säänneltyä. Kolme pistettä glykolyysin prosessissa esiintyy suurella negatiivisella vapaalla energialla ja ovat siksi peruuttamattomia. Nämä kolme pistettä ovat heksokinaasi, fosfofruktokinaasi ja pyruvaattikinaasi. Nämä kolme reaktiota ovat ehdokkaita sääntelyn tärkeimmiksi kohdiksi niiden suuren negatiivisen vapaan energian vuoksi. Näistä kolmesta PFK: ta pidetään glykolyysin (#3 Alla olevassa kuvassa) tärkeimpänä säätelypisteenä lihaksessa ΔG= -25.9 kJ/mol, koska se on sitoutunut vaihe. Kun PFK muuntaa F6P: n F1: ksi,6P: ksi, reaktio ei ole helposti päinvastainen, koska suuri energiamäärä, joka on voitettava taaksepäin menemiseksi. . Tämä energiaeste on järkevä, koska pyruvaattikinaasi katalysoi lopullista reaktiota (#10) ja heksokinaasi (#1) ei osallistu glykolyysiin lainkaan, kun prosessi aloitetaan glykogeenistä.
PFK: ta säätelevät ATP, AMP ja ADP. Vaikka ATP sitoutuu aktiiviseen kohtaan yhtä hyvin sekä R-että T-tilassa, se sitoo ensisijaisesti T-tilan allosteerista kohtaa tämä etuoikeutettu sitoutuminen aiheuttaa siirtymisen näiden kahden tilan tasapainotilasta suurempaan t-tilan määrään, mikä vähentää affiniteettia F6P: hen. Allosteerinen aktivaattori ADP sitoutuu myös allosteeriseen kohtaan kasvattaen R-tilan fosfofruktokinaasin suhdetta. Kuten alla olevasta graafista näkyy, PFK: n toiminnan kuvaajat ovat sigmoidisia. Tämä osoittaa edelleen entsyymin yhteistoiminnallisuuden. Substraatin alkuperäinen sitoutuminen entsyymiin on vaikeaa, mutta kun se on sitoutunut ja pakottaa olomuutoksen t -> R, muut substraatit sitoutuvat paljon helpommin. Kuvaaja osoittaa myös, että ATP: n lisääminen siirtää tontin oikealle (eli vähentää affiniteettia F6P: lle), kun taas AMP: n lisääminen siirtää sen vasemmalle.
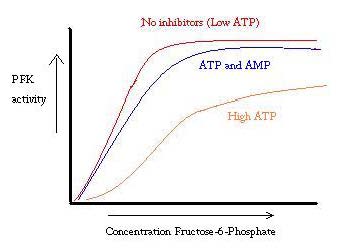
säätöjärjestelmä vastaa hyvin PFK: n toimintaa. Kun PFK on aktiivinen, siitä tuotetaan ATP: tä alavirtaan sitä mukaa, kun lisätuotteet hajoavat täydellisemmin. Kun ATP-tasot ovat matalat ja lisää on tehtävä, PFK: n aktiivisuus lisääntyy, koska ADP: tä on paljon. Tilanne on myös päinvastainen, sillä korkea ATP-pitoisuus estää proteiinin toimintaa. Ja vielä tämä selitys ei voi täysin selittää PFK: n säätelyä, koska ATP: n tasot eivät vaihtele tarpeeksi suuresti aktiivisten ja lepäävien lihasten välillä. Allosteeriseen säätelyyn on löydettävä toinen keino.
PFK: n Km ATP on .020 mm ja .032 mm.
Tämä Kinemage-harjoitus koostuu kahdesta kinemage-kohtauksesta, jotka havainnollistavat joitakin Bacillus stearothermophilus-bakteerin PFK: ssa esiintyviä allosteerisesti aiheutuneita konformaatiomuutoksia.
Konformaatiomuutokset PFK: n Dimeerisessä yksikössä
tämä kinemuoto näyttää tetrameerin kaksi alayksikköä, joiden rajapinnassa on kaksi aktiivista kohtaa. (KineMage tällä hetkellä ei tueta)ensimmäinen näkymä, 1: PFK dimer, näyttää kaksi alayksikköä niiden r-tilassa konformaatio edustettuina niiden Ca selkäruotot kanssa alayksikkö 1 vaaleanpunainen sävy ja alayksikkö 2 Vaaleanpunainen. Kussakin alayksikössä on kaksi sivuketjua, Glu 161 (punainen) ja ARG 162 (Syaani), jotka ovat osa F6P: n sidontapaikkaa T-ja R-tiloissa(KS.jäljempänä). F6P (hotpink) ja ADP (green; ”ADP-active”) on sidottu kunkin alayksikön aktiiviseen kohtaan. Ylimääräinen ADP (keltainen; ”ADP-allo”) sidotaan kunkin alayksikön erilliseen niin sanottuun allosteeriseen kohtaan. ADP: llä on kullakin siihen liittyvä MG2+, jota tässä edustaa samanvärinen pallo kuin ADP: llä, johon se sitoutuu.
Napsauta ”ANIMATE” – painiketta vaihtaaksesi dimeeriä sen R-ja T-tilojen välillä. T-tilassaan alayksikkö 1 on bluetint ja alayksikkö 2 on skyblue. Glu 161: n ja Arg 162: n sivuketjut ovat molemmissa alayksiköissä punaiset ja syaani kuten ennenkin (vain alayksikön 1 Arg 162 sivuketjun Ca-ja Cb-atomit havaitaan t-tilan Röntgenrakenteessa; alayksikön 2: n atomit ovat kaikki havaittavissa). T-tilan entsyymi sitoo inhibiittori 2-fosfoglykolaattia (kulta; ”PGC”), joka on glykolyyttisen välituotteen fosfoenolipyruvaatin (PEP) ei -fysiologinen analogi. Huomaa, että PGC: n sitova kohta t-tilassa on päällekkäinen ADP: n allosteerisen sitovan kohdan kanssa R-tilassa (”ADP-allo”), joten niiden sitominen on toisensa poissulkevaa. T – tilan aktiivisille paikoille, jotka eivät sisällä F6P: tä, on merkitty ”ghost” F6Ps (gray;”F6P site”), joiden sijainnit ovat samat kuin R-tilan entsyymin F6Ps: llä.
toinen näkymä, 2: Allo / Act Sites, on lähikuva ensimmäisen näkymän yläosasta, jossa näkyy sekä aktiivinen kohta että allosteerinen kohta tällä alueella. Huomaa, että aktiivinen sivusto sijaitsee kahden alayksikön rajapinnassa ja että allosteerinen sivusto on suoraan vuorovaikutuksessa viereisen alayksikön aktiivisen sivuston kanssa. Vertaa R-tilan ja T-tilan konformaatioita näyttämällä molemmat kerralla tai klikkaamalla ”ANIMATE”. Tunnistatko MG2+ – ionin, joka liittyy kuhunkin R-tilassa olevaan entsyymiin sitoutuneeseen ADPs: ään? Mitkä ADP-atomit koordinoivat näitä MG2+ – ioneja?
PGC: n fosfaattiryhmä sitoutuu allosteeriseen kohtaan T-tilassa hyvin lähes samassa asennossa kuin ”ADP-Allon” beetafosfaattiryhmä sitoutuu R-tilan allosteeriseen kohtaan; molemmat fosfaattiryhmät sitoutuvat samojen kolmen jäämän sivuketjuihin (2 arg ja 1 Lys; ei esitetty).
korkea-aktiivisessa R-tilassa ARG 162: n positiivisesti varautunut sivuketju muodostaa vetysidoksen suolasillan F6P: n negatiivisesti varautuneen 6-fosfaattiryhmän kanssa (valkoiset katkoviivat) vuorovaikutuksen, joka oletettavasti stabiloi R-tilan suhteessa t-tilaan ja on siten osittain vastuussa F6P: n homotrooppisesta vaikutuksesta.
tärkeimmät Konformaatiomuutokset PFK: n alayksikössä.
tässä KINEMAAGISSA näkyvät allosteerisen alueen lähellä olevat segmentit (jäämiä 53-60 ei näy tässä). Kuten KINEMAAGISSA 1, polypeptidiä edustaa sen Ca-ketju, jossa R-tilan alayksiköt ovat 1 ja 2 punatintissä ja vaaleanpunaisessa sekä t-tilan alayksiköt 1 ja 2 bluetintissä ja skybluessa. (KineMage ei tällä hetkellä tue)KINEMAGE 2 tulee esiin näkymässä 1: Allosteerinen alue, R-tilassa, jossa näkyy F6P: n (hotpink) fosfaattiryhmä, joka on sitoutunut entsyymin aktiiviseen kohtaan vetysidoksella sidotussa suolasillassa (murskatut valkoiset viivat), jossa on ARG 162: n sivuketju (Syaani). ADP (keltainen; ”ADP-allo”) sijaitsee viereisessä allosteerisessa paikassa. Napsauta kerran ”animoida” vaihtaa t tilaan. Tämä korvaa ADP: n r-tilan allosteerisessa kohdassa inhibiittorilla ja pep-analogisella PGC: llä (gold). F6P ei enää miehitä aktiivista sivustoa, mutta sen aseman r-tilassa osoittaa ”haamu” F6P (harmaa; katsotaan klikkaamalla ”F6P-sivustoa”).
Mitä tapahtuu keskeiselle polypeptidin kierteiselle segmentille (jäännökset 149-164) R-T-siirtymässä? Mitä tämä tekee negatiivisesti varautuneen Glu 161: n ja positiivisesti varautuneen Arg 162: n suhteellisille asemille? Klikkaa ”F6P site”. Miten Arg 162: n positiivisen varauksen puuttuminen vaikuttaisi F6P: n sitovuuteen? Selittääkö tämä ainakin osittain, miksi T state PFK: lla on alhainen affiniteetti F6P: hen? Siirry näkymä 2: Lähikuva, sillä lähikuva F6P-sidechain vuorovaikutusta. Keskitä molekyylit valitsemalla ”pickcenter” ”Työkalut” – valikosta ja klikkaamalla Athe Athe haluat olla keskellä. Liu ’uta” zoom ” liukusäädintä suurentaaksesi näkymää.
paikkaan kohdistuva mutageenisuus
aikoinaan Glu 161: n negatiivisen varauksen ajateltiin vaikuttavan negatiivisesti F6P: n sitoutumiseen T-tilassa. Tätä ajatusta eivät ole tukeneet paikkaohjatut mutageeniset kokeet. Useita mutantteja PFKs on tehty, mukaan lukien R162A, E161A ja R162A/E161A. R162A-mutaatio aiheutti 30-kertaisen F6P-sitoutumisen vähenemisen. E161A-mutaatiolla oli kuitenkin vain vähän vaikutusta PEP: n kykyyn estää F6P: n sitoutumista.
tauti
perinnöllinen punasolujen PFK-puutos liittyy myopatiaan ja hemolyysiin (Tarui-tauti).
PFK: n 3D-rakenteet
Fosfofruktokinaasi 3D-rakenteet
Leave a Reply