Frontiers in Oncology
Introduction
noin 25%: lla varhaisen vaiheen rintasyöpäpotilaista esiintyy edelleen paikallista uusiutumista ja etäpesäkkeitä aktiivisen hoidon jälkeen (1), ja lähes 10%: lla potilaista on kehittyneessä maailmassa ensimmäisen diagnoosin yhteydessä IV asteen tauti, josta käytetään nimitystä de novo metastasoitunut rintasyöpä (MBC) (2). Hoidon edistymisestä huolimatta MBC on edelleen parantumaton, ja jopa 70-80% MBC-potilaista kuolee syöpään 5 vuoden kuluessa (2). MBC: n heterogeenisyyden seurauksena kehitetään useita prognostisia malleja, jotka perustuvat prognostisiin tekijöihin tai pisteytyksiin niiden kliinisten tulosten ennustamiseksi ja kliinikoiden ohjaamiseksi tekemään asianmukaisia terapeuttisia päätöksiä (3-5). Lisäksi on olemassa myös erilaisia ennustemalleja rintasyövälle, jossa on aivojen etäpesäke (bcbm), jotta kliinikot voivat tarkasti ennustaa eloonjäämisen näillä potilailla (6, 7).
rintasyöpä voi etäpesäkkeitä missä tahansa kehossa, mutta ensisijaisesti etäpesäkkeitä voi syntyä keuhkoihin, luuhun, maksaan, kainalon ulkopuolisiin imusolmukkeisiin ja aivoihin (8). Erityisesti, maksan etäpesäke (lm) ei ole vain yleinen metastaattinen sivusto, mutta myös liittyy merkittävästi lisääntynyt kuolemanriski samanlainen aivojen etäpesäke, suhteettoman suurempi kuolleisuus verrattuna keuhkojen tai luun etäpesäkkeitä (5, 8). Koska bcbm-potilaiden asteittainen prognostinen arviointi (GPA) on laajalti hyväksytty, edellä mainitut prognostiset mallit kannustavat meitä ehdottamaan käytännön mallia BCLM: lle (3-7). Tavoitteenamme oli rakentaa luotettava ja käyttäjäystävällinen ennustemalli BCLM: lle ja arvioida sen vastaavuutta ja tarkkuutta validoimalla se sisäisesti ja ulkoisesti. Ennustemalli saattaa auttaa lääkäreitä arvioimaan BCLM-potilaiden kuolemanriskiä ja valitsemaan optimaalisen hoidon.
potilaat ja menetelmät
potilaiden valinta
fuscc: n riippumattomat eettiset komiteat hyväksyivät tämän tutkimuksen. Fuscc: ssä diagnosoitiin peräkkäisiä MBC-potilaita tammikuusta 2007 joulukuuhun 2018 (n = 9 062). Tukikelpoisuusperusteet olivat seuraavat:: (1) histologisesti vahvistettu rintasyöpä, (2) naispotilaat, (3) maksa ensimmäisenä metastasoituneen taudin sijaintipaikkana joko de novo metastasoituneessa tai uusiutuneessa rintasyövässä ja (4) täydelliset ja yksityiskohtaiset tiedot. Tutkimukseen ei osallistunut potilaita, joilla oli molemminpuolinen rintasyöpä, muita invasiivisia kasvaimia tai joiden seuranta oli tuntematon. Jatkotutkimuksiin valittiin 1 022 soveltuvaa potilasta. Valinnan täydet vaiheet on esitetty kuvassa S1.
muuttujien tutkiminen ja raja-arvojen valinta
tietoa kerättiin seuraavista kliinisopatologisista muuttujista: Ikä, molekyylitason alatyypit, aikaisemmat tiedot hoidosta (leikkaus ja systeeminen kemoterapia), rahalaitos, ekstrahepaattisten etäpesäkkeiden paikat (aivot, keuhkot, luu ja imusolmukkeet), maksan etäpesäkkeiden ominaisuudet (jakautuminen, lukumäärä, maksimihalkaisija), hemoglobiini (HB), maksan toimintakokeet ja eloonjäämisaika. Molekyylitason alatyyppejä olivat hormonireseptorin (HR) ja ihmisen epidermaalisen kasvutekijän reseptorin 2 (HER2) status. Määrittelimme rahalaitoksen primaarisen rintasyövän diagnosointipäivän ja ensimmäisen etäpesäkkeiden päivämäärän väliseksi ajaksi. Tässä tutkimuksessa käytetyt rahalaitosten leikkauspisteet olivat 3 ja 24 kuukautta viitteen (9) mukaan. Siksi potilaat voitiin jakaa kolmeen ryhmään: potilaat, joilla oli de novo MBC (MFI < 3 kk), potilaat, joilla oli lyhyt rahalaitos (≤ 24 kk) ja potilaat, joilla oli pitkä rahalaitos > 24 kk. Etäpesäkkeeksi määriteltiin etäpesäke ipsilateraalisesta kainalosta, supraklavikulaarisesta, infraklavikulaarisesta tai rintarauhasen sisäisistä imusolmukkeista. LM: n diagnoosi perustui radiologiseen kuvantamiseen tai patologiseen näyttöön. Ominaisuudet maksan etäpesäke arvioitiin avulla vatsan tietokonetomografia (CT), magneettikuvaus (MK), tai kirurginen resektio näytteitä. Tässä tutkimuksessa analysoitiin myös maksan toimintakokeita, kuten kokonaisbilirubiini, alaniiniaminotransferaasi (alat), aspartaattiaminotransferaasi (ASAT), alkalinen fosfataasi (ALP), laktaattidehydrogenaasi (LDH) ja γ-glutamyylitransferaasi-albumiini-suhde (GAR). Verinäytteet otettiin laboratoriokokeita varten 1 viikon kuluessa LM: n toteamisesta. Maksametastaasien ja LDH: n jakautuminen, lukumäärä tai maksimihalkaisija luokiteltiin muiden tutkimusten perusteella (10-13). HB: n, kokonaisbilirubiinin, ALAT: n, ASAT: n ja ALP: n raja-arvot määritettiin haittatapahtumien (CTCAE) yleisiin Terminologisiin kriteereihin perustuen, koska keskivaikeat tai II asteen poikkeamat hemoglobiinitasoissa tai maksan toiminnassa saattavat vaikuttaa terapeuttisiin valintoihin (14). GAR: n arvo määriteltiin yksinkertaisena seerumiglutamyylitransferaasiarvon (GGT, U/L) ja seerumin albumiinitason (ALB g/L) välisenä suhteena. OS alkaen aika etäpesäke mitattiin päivästä diagnoosi lm kuolemaan mistä tahansa syystä. Edellinen seuranta-aika oli marraskuussa 2019, jolloin seuranta-ajan mediaani oli 18,63 kuukautta. Jos potilaat katosivat seurantaan, se sensuroitiin seurannan viimeisenä päivänä.
tilastollinen analyysi
potilaat jaettiin koulutukseen (2007-2016, n = 715) ja validointiin (2016-2018, n = 307), joiden suhde oli 7:3. Optimaalinen raja-arvo GAR valittiin laskemalla Youden index and receiver operating characteristic curve (Roc) analyysi (Kuva S2). Pearsonin chi-potenssitestiä tai Fisherin tarkkaa testiä käytettiin vertailuun kategoristen muuttujien kesken. Monimuuttuja-analyysissä ja riskisuhteiden laskemisessa käytettiin COX: n suhteellisia vaarojen regressiomalleja, joissa käytettiin taaksepäin valintamenetelmää. Regressiokertoimet laskettiin monimuuttuja-regressioanalyysillä, minkä jälkeen ne kerrottiin 10: llä ja pyöristettiin edustamaan lopullisia ennustuspisteitä. Bootstrappingia käytettiin sisäisessä validoinnissa. Tämän jälkeen käytettiin ajasta riippuvia ROC-käyriä ja kalibrointikäyriä tämän ennustemallin erottelun ja kalibroinnin arvioimiseksi validointijoukossa. Riskiryhmien raja-arvot määritettiin X-laatan tonteilla (15). Elossaoloanalyysi tehtiin käyttäen Kaplan-Meier – elossaolokäyriä, ja log-rank-testejä käytettiin elossaolokäyrien vertailuun. Kaikki P-arvot olivat kaksipuolisia, ja arvoja p < 0, 05 pidettiin tilastollisesti merkitsevinä. Tilastollinen analyysi tehtiin käyttäen SPSS-ohjelmistoa (SPSS 20, Chicago, IL, USA) ja R-ohjelmistoversiota 4.0.1.
tulokset
ominaisuudet ja suhde Riskiositukseen
yhteensä 1 022 tähän tutkimukseen valittua potilasta jaettiin koulutus – (n = 715) ja validointiryhmiin (n = 307). Klinikopatologisia ominaisuuksia on kuvattu taulukoissa 1 ja S1. Harjoitusryhmässä oli 126 potilasta (17, 6%), joilla diagnosoitiin de novo-PUNASOLUAPLASIA ja 589 potilasta (82, 4%), joilla oli uusiutuva PUNASOLUAPLASIA, joista 297 potilaalla (50, 4%) oli lyhyt rahalaitos ja 292 potilaalla (49, 6%) oli pitkä rahalaitos. Mediaani-ikä LM-taudinmäärityksessä oli 50 vuotta (vaihteluväli 21-87 vuotta) ja 617 potilasta (86.3%) Alle 60 vuotta. Näistä potilaista HR-positiivisten osuus oli 62, 2% ja HER2-positiivisten 38, 0%. Uusiutuvista MBC-potilaista lähes kaikille potilaille tehtiin primaarikasvain leikkaus (584, 99, 2%) ja he saivat (neo)adjuvanttia kemoterapiaa (569, 96, 6%). Etäpesäkkeet osoittivat, että yleisin ekstrahepaattinen etäpesäke oli luu (42, 7%), jota seurasivat etäiset imusolmukkeet (36, 1%), keuhko (25, 6%) ja aivot (2, 9%). Maksan etäpesäkkeille oli ominaista hajanainen jakautuminen ja pienet kyhmyt, joista suurin osa oli useita (≥3 etäpesäkettä, 77, 3%), mutta pieniä kyhmyjä (≤3 cm, 59, 4%), ja niihin liittyi oikea ja vasen lohko (74, 4%). LM: n alkuvaiheessa maksan toiminta oli vaihtelevassa määrin heikentynyt, mutta yleensä lievää. LDH: n (36, 1%) ja GAR: n (35, 9%) nousu näytti olevan herkkiä maksan toimintahäiriön indikaattoreita, ja keskivaikeat tai sitä suuremmat poikkeavuudet HB: ssä (2, 9%), kokonaisbilirubiinipitoisuuksissa (2, 7%), alat-arvoissa (3, 6%), ASAT: ssa (9, 5%) ja ALP: ssä (3, 9%) olivat CTCAE: n mukaan melko harvinaisia. Verrattuna matalan riskin ryhmään, väli-ja korkean riskin ryhmään, jolla oli korkeampi HR ja HER2-negatiivisuus, lyhyt rahalaitos, ekstrahepaattinen etäpesäke, maksan etäpesäke tuumorikuorma ja poikkeavuuksia hemoglobiinitasoissa tai maksan toiminnassa (kaikki Ps ≤ 0,001), mikä viittaa siihen, että nämä tekijät saattavat vaikuttaa BCLM: n ennusteeseen.
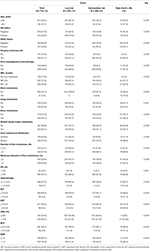
Taulukko 1. Perusominaisuudet ja sen suhde koulutussarjan riskiositukseen.
prognostinen malli ja validointi
Cox-regressiomallissa molekulaariset alatyypit (HR ja HER2-tila), rahalaitos, ekstrahepaattisten etäpesäkkeiden paikat (aivojen, keuhkojen ja luuston etäpesäkkeet) ja maksan toimintakokeet (kokonaisbilirubiini, LDH ja GAR) liittyivät OS: ään (Taulukko 2). Erityisesti HRD–negatiivisten (HR 1, 740, 95%: n luottamusväli 1, 424–2, 127, P < 0, 001) ja HER2-negatiivisten (HR 1, 615, 95%: n luottamusväli 1, 316-1, 983, p < 0, 001) potilaiden kuolemanriski kasvoi verrattuna riskiin tai HER2 positiivinen kollegansa. Rahalaitoksen pituudella oli myös merkittävä vaikutus BCLM–potilaiden elossaoloon, ja siksi niiden potilaiden elossaoloaika, joilla oli pitkä rahalaitos (HR 1, 612, 95% CI 1, 195–2, 174, p < 0, 001) lyheni verrattuna potilaisiin, joilla oli de novo MBC, ja potilaisiin, joilla oli lyhyt rahalaitos (HR 2, 563, 95% CI 1, 904-3, 449, p < 0, 001) oli yli kaksinkertainen riski kuolla heihin verrattuna. Lisäksi ekstrahepaattinen etäpesäke (aivojen, keuhkojen ja luuston etäpesäke) ja epänormaali maksan toiminta (kokonaisbilirubiini, LDH ja GAR) korreloivat kaikki epäedulliseen ennustavaan vaikutukseen OS: aan. Tässä ennustemallissa ajasta riippuvan ROC: n käyrän alle jäävä pinta-ala (AUC) oli 1 vuoden OS: n kohdalla 0, 78 koulutussarjassa ja 0, 80 validointisarjassa, mikä osoittaa, että tällä mallilla oli hyvä syrjintä (Kuva 1). Bootstrapping-menetelmää käytettiin vahvistamaan prognostisen mallimme vakaus harjoitussarjassa, ja lopputulokset olivat melko vankat (taulukko S2). Prognostisen mallin kalibrointikäyrät 1 vuoden ja 3 vuoden OS: lle koulutussarjassa sekä 1 vuoden OS: lle validointisarjassa osoittivat sen hyvän vastaavuuden (kuva 2).

Taulukko 2. Multivariate Cox regressiomalli (harjoitussarja).
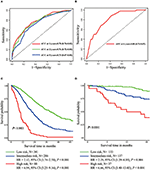
kuva 1. Aikariippuvaiset ROC-käyrät, jotka perustuvat ennustemalliin koulutussarjassa (A) ja validointisarjassa (B). Kokonaiselinaika kolmen prognostisen ryhmän metastaasista koulutus – (C) ja validointiryhmässä (d).
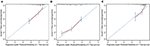
kuva 2. Kalibrointikäyrä, jolla ennustetaan potilaan eloonjäämistä 1 vuoden (A) ja 3 vuoden (B) kohdalla koulutusryhmässä ja 1 vuoden (C) kohdalla validointiryhmässä.
Riskiositus ja eloonjääminen

Taulukko 3. Prognostisten ryhmien pisteet ja katkaisupisteet lasketaan.
Keskustelu
tässä analyysissä, joka koski 1 022: ta laitoksessamme vuosina 2007-2018 hoidettua potilasta, osoitimme, että molekulaariset alatyypit (HR ja HER2 status), rahalaitos, ekstrahepaattisen etäpesäkkeiden paikat (aivojen, keuhkojen ja luuston etäpesäkkeet), maksan toimintakokeet (kokonaisbilirubiini, LDH ja GAR) olivat BCLM: n riippumattomia ennustavia tekijöitä.potilaat. Siksi BCLM-potilaiden prognostinen malli laadittiin prognostisia tekijöitä käyttäen.
molekulaaristen alatyyppien osalta HR-positiivisuus voi viitata siihen, että rintasyövän kasvua ja proliferaatiota säätelevät edelleen hormonit, joita kutsutaan hormoniriippuvaisiksi kasvaimiksi. Samaan aikaan hormonihoidolla on etuja, kuten vähän haittavaikutuksia ja pitkäkestoisia vaikutuksia, jotka voivat usein tuoda pitkän aikavälin selviytymishyötyjä HR-positiivisille potilaille. Siksi HR-positiivisuutta on pidetty merkittävänä tekijänä, joka viittaa suotuisaan ennusteeseen varhaisessa ja metastaattisessa rintasyövässä (1, 3-5, 8-10, 16). Vaikka HER2-vahvistusta ja yliekspressiota pidetään etäpesäkkeiden ja rintasyöpään liittyvän kuoleman riskin ennustajana, myöhemmin kehitetyt anti–HER2-lääkkeet ovat parantaneet huomattavasti HER2-positiivisten rintasyöpäpotilaiden (2, 9, 17) selviytymistä. Kohdennetun hoidon aikakaudella Kaakkois-Alankomaissa tehdyssä tutkimuksessa havaittiin, että HER2–negatiivisten potilaiden kuolleisuusriski kasvoi 44% (95%: n luottamusväli 1, 13-1, 83, P = 0, 003) verrattuna HER2-positiivisiin potilaisiin (9). Tutkimuksessamme HR-negatiivisten ja HER2-negatiivisten potilaiden kuolemanriski kasvoi verrattuna HR-tai HER2-positiivisiin vastaaviin, mikä on yhdenmukaista näiden havaintojen kanssa. Lyhyen rahalaitoksen (yleensä ≤24 kk) ennuste oli huonompi (3, 5, 9). Lisäksi de novo-potilailla näytti olevan huomattavasti parempi ennuste verrattuna uusiutuviin kroonista munuaistautia sairastaviin potilaisiin, vaikka tämä ero pienenikin vähitellen tautivapaan välin (DFI) tai rahalaitosten (9, 18, 19) pidentyessä. Lobbezoo ym. todettiin, että potilailla, joiden rahalaitos oli ≤24 kuukautta, oli merkitsevästi lyhyempi elinaika (9, 1 vs. 29.4 kuukautta, P < 0, 001) kuin ne, joilla oli de novo IV vaiheen tauti, mutta potilailla, joilla oli pitempi rahalaitos (>24 kuukautta), ennuste oli samanlainen (27, 9 vs. 29, 4 kuukautta, P = 0, 73) (9). Mahdollinen syy tähän ilmiöön on se, että aiemmin systemaattista hoitoa saaneet relapsoitunutta PUNASOLUTAUTIA sairastavat potilaat saattavat olla resistenttejä solunsalpaajahoidolle enemmän kuin aiemmin hoitamattomat potilaat, joilla on de novo-PUNASOLUTAUTIA, mutta lisätutkimukset ovat tarpeen (9, 18, 19). Tämä tutkimus vahvisti, että niiden potilaiden elossaoloaika, joilla oli pitkä rahalaitos, lyheni verrattuna de novo MBC-potilaisiin, joiden lyhyen rahalaitoksen tulos oli huomattavasti huonompi.
MBC: n eloonjääminen vaihteli merkitsevästi metastasoituneiden paikkojen mukaan, ja viskeraalista etäpesäkettä sairastaneisiin potilaisiin liittyi suurentunut kuolleisuusriski verrattuna potilaisiin, joilla oli ei-viskeraalista etäpesäkettä (3-5, 9, 18). Lisäksi läsnäolo aivojen etäpesäkkeiden oli suurempi vaikutus eloonjäämiseen kuin mikään muu etäpesäkkeitä (3, 5, 9, 18). Ei ollut yllättävää, että useilla etäpesäkkeillä oli epäsuotuisampi vaikutus ennusteeseen (3, 5, 9, 17, 18). Tässä analyysissä ekstrahepaattinen etäpesäke, lukuun ottamatta kaukaisia imusolmukkeita etäpesäke, voisi johtaa lyhentää elinaikaa, luultavasti koska maksan etäpesäke oli kriittisesti hengenvaarallinen tekijä verrattuna imusolmuke etäpesäke.
on huomattava, että potilailla, joilla oli korkeampi bilirubiinipitoisuus, oli paljon pienempi riski sairastua useisiin sairauksiin osittain sen antioksidantti-ja anti-inflammatoristen ominaisuuksien vuoksi (20). Tuoreessa tutkimuksessa todettiin myös, että kuolleisuusriski pieneni lähes 40 prosenttia niillä varhaisilla rintasyöpäpotilailla, joiden kokonaisbilirubiinipitoisuus oli suurempi (21). Hyperbilirubinemiaan liittyi kuitenkin huono ennuste BCLM-potilailla (22). On mahdollista, että toisin kuin suhteellisesti suurempi kokonaisbilirubiini ei-metastasoituneilla rintasyöpäpotilailla, kohonnut bilirubiini 1,5 kertaa suurempi kuin normaaliarvon yläraja (ULN) BCLM-potilailla voi ennustaa vakavaa maksavauriota ja siten edistää lääkkeen lopettamista tai maksan enkefalopatiaa.
Warburg-efekti ajaa syöpäsolut riippuvaisiksi aerobisesta glykolyysistä silloinkin, kun hapensaanti on riittävä, mikä on syövän aineenvaihdunnan tunnusmerkki verrattuna normaaleihin kudoksiin (23). LDH: lla on välttämätön rooli glykolyysissä, koska se kykenee muuntamaan pyruvaatin laktaatiksi anaerobisissa olosuhteissa (24). LDH: n säännöstelemättömät tasot voivat heijastaa kasvaintaakkaa, huonompaa hoitovastetta ja ennustetta, joka oli aiemmin raportoitu useissa kasvaimissa (21, 24-26). Rintasyöpäpotilaiden LDH: n ennustavaa vaikutusta koskeva meta-analyysi osoitti, että suurempi LDH johti epätyydyttävään OS: aan ja taudin etenemisvapaaseen elinaikaan, johon sisältyi 11 tutkimusta, joihin osallistui 6 102 potilasta (27).
GGT, tärkein endogeeninen antioksidantti, assimiloi esiasteisia aminohappoja ja osallistuu glutationisynteesiin (28). GGT kasvaimissa mahdollistaa solujen nopeasti täydentää glutationi saatuaan pro-hapetin syöpähoidon ja, siksi, korreloi lääkeresistenssi ja huono selviytyminen (29). Mielenkiintoista, Fentiman et al. raportoitu, että kohonneen GGT: n ja rintasyöpäriskin välillä havaittiin merkitsevästi positiivinen yhteys (30). Maksan syntetisoima Alb toimii antioksidanttina, ravinteiden kuljettajana, ja sillä on osallistuminen signaalireitteihin sen ainutlaatuisten rakenteellisten ominaisuuksien vuoksi (31). Hypoalbuminemia esiintyy yleensä pitkälle edenneillä syöpäpotilailla ja johtuu eri mekanismeista, mukaan lukien maksan vajaatoiminta, lisääntynyt katabolia ja kakeksia (21, 31). Hypoalbuminemia on riippumaton indikaattori huono ennuste eri kasvaimia (21, 22, 32, 33). Toisin kuin alentuneet seerumin albumiinipitoisuudet, seerumin GGT-arvot ovat yleensä koholla, kun maksan toiminta on heikentynyt. Siksi GAR perustuu edellä kaksi parametria voi olla etu heijastaa maksan varauskykyä ja ennustaa ennuste (32, 33). Tässä tutkimuksessa maksan toimintahäiriöt (kokonaisbilirubiini, LDH ja GAR) korreloivat kaikki epäedulliseen ennustavaan vaikutukseen OS: aan.
123 BCLM-potilaan ennusteen analysoinnin jälkeen, Duan et al. todettiin, että potilailla, joilla oli kolme tai useampia maksametastaaseja, oli 2.26-kertaistunut kuolemanriski verrattuna potilaisiin, joilla <3 maksametastaasia monimuuttuja-analyysissä (10). Tässä tutkimuksessa maksan etäpesäkkeiden ominaisuuksilla ei kuitenkaan näyttänyt olevan merkitystä. Tähän ristiriitaan voi olla kaksi syytä. Ensinnäkin maksametastaasien jakautuminen, lukumäärä ja maksimihalkaisija poikkesivat merkittävästi kolmesta riskiryhmästä, mikä viittaa siihen, että kuolleisuusriski kasvoi maksametastaasin laajenemisen myötä univariaattianalyysissä. Jälkeenpäin, epänormaali maksan toiminta liittyi läheisesti kasvain kuormitus maksan etäpesäkkeitä, säätämällä rooli näiden tekijöiden monimuuttuja analyysi.
BCLM-hoidon yhteydessä on tehty useita ennustavia tekijöitä koskevia tutkimuksia. Analyysi 145 BCLM-potilaasta osoitti, että hypoalbuminemia, vanhempi ikä ja ER-negatiivisuus olivat itsenäisiä ennustajia huonosta eloonjäämisestä (22). Kreikkalaisessa rekisterianalyysissä saatiin samanlaisia tuloksia, joissa HR-positiivisuus, Alhainen histologinen aste, ekstrahepaattisten etäpesäkkeiden puuttuminen ja hyvä suoritustaso olivat merkittäviä suotuisan ennusteen ennustavia tekijöitä univariaattianalyysissä (34). Tuoreessa väestöpohjaisessa tutkimuksessa, johon osallistui yli 4 000 de novo BCLM-potilasta, yksilöitiin demografiset ja sosioekonomiset tekijät, patologinen aste, ekstrahepaattisten etäpesäkkeiden kokonaismäärä, hoito ja molekyylitason alatyyppi parametreiksi, jotka vaikuttavat merkittävästi kokonaiselinaikaan (17). Regierer ym. laati MBC: lle prognostisen pisteytyksen, joka perustui HR-statukseen, rahalaitokseen ja etäpesäkkeiden sijaintiin ennusteen ennustamiseksi ja optimaalisen hoidon yksilöllistämiseksi, mikä validoitiin sisäisesti ja ulkoisesti (5). Valitettavasti HER2-tila ei sisältynyt prognostiseen pistemäärään ja rajoitti sen sovellettavuutta. Bcbm-potilaiden modifioidulla rinta-GPA: lla, joka sisälsi neljä yksinkertaista kliinistä muuttujaa, oli välitön merkitys eloonjäämisen ennustamisessa, mutta sitä ei sovellettu BCLM-potilaisiin (7). Tietääksemme ei ole prognostista mallia, joka integroisi nämä prognostiset tekijät BCLM-potilaille,joten mallimme on käytännöllinen.
tässä tutkimuksessa oli myös joitakin rajoituksia. Ensinnäkin, yhden keskuksen ja retrospektiivinen tutkimus johti väistämättä valintaharhaan, vaikka ennustemallimme validoitiin sisäisesti ja ulkoisesti. Toiseksi potilaat, joille kehittyi maksan etäpesäke myöhemmin taudin aikana, suljettiin pois, joten emme pystyneet arvioimaan näitä potilaita. Kolmanneksi tässä tutkimuksessa ei ollut saatavilla yksityiskohtaisia tietoja toimintakyvyn tilasta ja hoidosta.
päätelmät
näistä rajoituksista huolimatta tämä tutkimus voi tarjota yksinkertaisen ja luotettavan ennustemallin. Suuri etu tutkimuksessamme on sisällyttää parametrit helposti saatavilla kliinisessä käytännössä perusteella suuri otos BCLM potilaiden. Sen lisäksi hieno luokittelu kasvaimia mukaan seuraavan sukupolven sekvensointi menetelmiä, mallimme voi auttaa tunnistamaan alaryhmiä eri ennuste ja ohjata myöhempää hoitoa.
tiedon saatavuutta koskeva selvitys
tutkimuksessa esitetyt alkuperäiset kannanotot sisältyvät artikkeliin/täydentävään aineistoon, jatkotutkimukset voidaan osoittaa vastaavalle tekijälle/laatijoille.
eettinen lausunto
fuscc: n riippumattomat eettiset komiteat hyväksyivät tämän tutkimuksen. Potilaat / osallistujat antoivat kirjallisen tietoon perustuvan suostumuksensa osallistua tähän tutkimukseen.
Tekijäosuudet
Lj ehdotti tutkimusta. XZ ja YG keräsivät tiedot. Lj ja LF analysoivat tiedot ja kirjoittivat ensimmäisen luonnoksen. ZW Arvosteli käsikirjoitusta kriittisesti. Kaikki kirjoittajat osallistuivat artikkelin ja hyväksyi toimitetun version.
eturistiriita
kirjoittajat toteavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdollisiksi eturistiriidoiksi.
kiitokset
annamme Lei Chengille tunnustusta tietojen analysoinnista.
Täydennysaineisto
lyhenteet
BCLM, rintasyöpä, jossa on maksan etäpesäke; FUSCC, Fudan University Shanghai Cancer Center; ROC, receiver operating characteristic curve; MFI, metastasated-free interval; HR, hazard ratio; CI, confidence interval; OS, overall survival; MBC, metastasoitunut rintasyöpä; BCBM, breast cancer with brain metastasis; lm, liver metastasis; GPA, graded prognostic assessment; HB, hemoglobiini; HR, hormonireseptori; HER2, human epidermal growth factor receptor 2; CT, tietokonetomografia; MK, magneettikuvaus; alat, alaniiniaminotransferaasi; ASAT, aspartaattiaminotransferaasi; ALP alkalinen fosfataasi; LDH, laktaattidehydrogenaasi; Gar, γ-glutamyylitransferaasi albumiiniin; GGT, γ-glutamyylitransferaasi; ALB, albumiini; CTCAE, Common Terminology Criteria for Adverse Events; ULN, upper limit of normal.
4. Puente J, Lopez-Tarruella S, Ruiz A, Lluch A, Pastor M, Alba E, et al. Practical prognostic index for patients with metastasated receared breast cancer: retrospektiivinen analyysi 2322 potilaasta GEICAM Spanish El Alamo Registeristä. Rintasyöpä Res Treat. (2010) 122:591–600. doi: 10.1007/s10549–009-0687–4
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Regierer AC, Wolters R, Ufen MP, Weigel A, Novopashenny I, Kohne CH, et al. An internally and externally validated prognostic score for metastatic breast cancer: analysis of 2269 patients. Ann Oncol. (2014) 25:633–8. doi: 10.1093/annonc/mdt539
PubMed Abstract | CrossRef Full Text
6. Marko NF, Xu Z, Gao T, Kattan MW, Weil RJ. Selviytymisen ennustaminen naisilla, joilla on rintasyöpä ja aivojen etäpesäke: nomogrammi päihittää nykyiset eloonjäämisen ennustemallit. Syöpä. (2012) 118:3749–57. doi: 10.1002 / cncr.26716
PubMed Abstract | CrossRef Full Text/Google Scholar
7. Subbiah IM, Lei X, Weinberg JS, Sulman EP, Chavez-MacGregor M, Tripathy D, et al. Validointi ja kehittäminen modifioitu breast graded prognostic assessment as a tool for survival in patients with breast cancer and brain etäpesäkkeitä. J Clin Onkol. (2015) 33:2239–45. doi: 10.1200 / JCO.2014.58.8517
PubMed Abstract | CrossRef Full Text/Google Scholar
9. Lobbezoo DJ, van Kampen RJ, Voogd AC, Dercksen MW, van den berkmortel F, Smilde TJ, et al. Metastaattisen rintasyövän ennuste: onko de novo-potilaiden ja uusiutuvan metastaattisen rintasyövän välillä eroja? Br J Cancer. (2015) 112:1445–51. doi: 10.1038/bjc.2015.127
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Duan XF, Dong NN, Zhang T, Li Q. The prognostic analysis of clinical breast cancer subtypes among patients with liver metastases from breast cancer. Int J Clin Oncol. (2013) 18:26–32. doi: 10.1007/s10147–011-0336-x
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dueck AC, Mendoza TR, Mitchell SA, Reeve BB, Castro KM, Rogak Lj, et al. Yhdysvaltain kansallisen syöpäinstituutin Potilasraportoitujen tulosten Version (PRO-CTCAE) pätevyys ja luotettavuus. JAMA Onkol. (2015) 1:1051–9. doi: 10.1001/jamaoncol.2015.2639
PubMed Abstract | CrossRef Full Text/Google Scholar
17. Xie J, Xu Z. väestöpohjainen tutkimus Maksametastaaseista naisilla, joilla on äskettäin diagnosoitu rintasyöpä. Cancer Epidemiol Biomarkers Prev. (2019) 28:283–92. doi: 10.1158/1055–9965.EPI-18–0591
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Dawood S, Broglio K, Ensor J, Hortobagyi GN, Giordano SH. Survival differences among women with de novo stage IV and relapsed breast cancer. Ann Oncol. (2010) 21:2169–74. doi: 10.1093/annonc/mdq220
PubMed Abstract | CrossRef Full Text
19. den Brok WD, Speers CH, Gondara L, Baxter E, Tyldesley SK, Lohrisch CA. Eloonjääminen metastasoituneen rintasyövän kanssa perustuen alustavaan esitystapaan, de novo versus relapsed. Rintasyöpä Res Treat. (2017) 161:549–56. doi: 10.1007 / s10549–016-4080–9
PubMed Abstract | CrossRef Full Text/Google Scholar
20. Fujiwara R, Haag M, Schaeffeler E, Nies AT, zanger UM, Schwab M. bilirubiinin homeostaasin systeeminen säätely: hyperbilirubinemian mahdolliset hyödyt. Hepatologia. (2018) 67:1609–19. doi: 10.1002/hep.29599
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Liu X, Meng QH, Ye Y, Hildebrandt MAT, Gu J, Wu X. Prognostic significance of pretreatment serum levels of albumin, LDH and total bilirubin in patients with non-metastatic breast cancer. Carcinogenesis. (2015) 36:243–8. doi: 10.1093/carcin/bgu247
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Vander Heiden MG, Cantley LC, Thompson CB. Warburgin vaikutuksen ymmärtäminen: solujen proliferaation metaboliset vaatimukset. Tiede. (2009) 324:1029–33. doi: 10.1126 / tiede.1160809
PubMed Abstract | CrossRef Full Text/Google Scholar
24. Mishra d, Banerjee D. Laktaattidehydrogenaasit metabolisina yhteyksinä kasvaimen ja strooman välillä kasvaimen mikroympäristössä. Syöpä. (2019) 11:750. doi: 10.3390/cancers11060750
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Pelizzari G, Basile D, Zago S, Lisanti C, Bartoletti M, Bortot L, et al. Lactate dehydrogenase (ldh) response to first-line treatment predicts survival in metastatic breast cancer: first clues for a cost-effective and dynamic biomarker. Cancers. (2019) 11:1243. doi: 10.3390/cancers11091243
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Hopkins AM, Rowland A, McKinnon RA, Sorich MJ. Predictors of long-term disease control and survival for HER2-positive advanced breast cancer patients treated with pertuzumab, trastuzumab, and docetaxel. Front Oncol. (2019) 9:789. doi: 10.3389/fonc.2019.00789
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Pentheroudakis G, Fountzilas G,Bafaloukos D, Koutsoukou V, Pectasides D, Skarlos D, et al. Metastaattinen rintasyöpä, jossa on maksametastaaseja: 500 naisen kliinisenpatologisen, hoidon ja lopputuloksen ominaisuuksien rekisterianalyysi. Rintasyöpä Res Treat. (2006) 97:237–44. doi: 10.1007 / s10549–005-9117–4
PubMed Abstract / CrossRef Full Text / Google Scholar
Leave a Reply