Halobetasolipropionaattivoide
annosmuoto: voide
lääketieteellisesti arvosteltu Drugs.com. päivitetty viimeksi 1. Maaliskuuta 2020.
- yleiskatsaus
- haittavaikutukset
- yhteisvaikutukset
- More
annostus Professional
Halobetasolipropionaattivoide kuvaus
Halobetasolipropionaattivoide, 0, 05% sisältää halobetasolipropionaattia, synteettistä kortikosteroidia paikalliseen dermatologiseen käyttöön. Kortikosteroidit muodostavat luokan ensisijaisesti synteettisiä steroideja käytetään paikallisesti anti-inflammatorinen ja antipruriittinen aine.
kemiallisesti halobetasolipropionaatti on 21-kloori-6α, 9-difluori-11β, 17-dihydroksi-16β-metyylipregna-1, 4-dieeni-3-20-dioni, 17-propionaatti, C25H31ClF2O5. Sillä on seuraava rakennekaava:
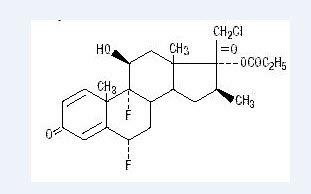
Halobetasolipropionaatin molekyylipaino on 485. Se on valkoista kiteistä jauhetta, joka ei liukene veteen.
yksi gramma Halobetasolipropionaattivoidetta sisältää 0.5 mg/g halobetasolipropionaattia alumiinistearaatista, mehiläisvahasta, pentaerytritolikokoaatista, vaseliinista, propyleeniglykolista, sorbitaaniseskvioleaatista ja stearyylisitraatista.
Halobetasolipropionaattivoide – Kliininen farmakologia
kuten muillakin paikallisesti käytettävillä kortikosteroideilla, halobetasolipropionaatilla on anti-inflammatorisia, antipruriittisia ja vasokonstriktiivisia vaikutuksia. Paikallisesti käytettävien kortikosteroidien anti-inflammatorisen aktiivisuuden mekanismi on yleensä epäselvä. Kortikosteroidien uskotaan kuitenkin vaikuttavan fosfolipaasi A2: ta estävien proteiinien induktiolla, joita kutsutaan yhteisesti lipokortiineiksi. Näiden proteiinien oletetaan säätelevän voimakkaiden tulehduksen välittäjien kuten prostaglandiinien ja leukotrieenien biosynteesiä estämällä niiden yhteisen esiasteen arakidonihapon vapautumista. Arakidonihappoa vapautuu kalvofosfolipideistä fosfolipaasi A2: n vaikutuksesta.
farmakokinetiikka
paikallisesti käytettävien kortikosteroidien imeytymisen laajuuteen vaikuttavat monet tekijät, kuten kantaja-aine ja epidermaalisen esteen eheys. Okkluusiosidosten, joissa hydrokortisoni on ollut enintään 24 tuntia, ei ole osoitettu lisäävän penetraatiota, mutta hydrokortisonin okkluusio 96 tunnin ajan lisää penetraatiota huomattavasti. Paikallisesti käytettävät kortikosteroidit voivat imeytyä normaalista ehjästä ihosta. Ihon tulehdus ja / tai muu sairaus voi lisätä ihon imeytymistä.
ihmisillä ja eläimillä tehdyt tutkimukset osoittavat, että alle 6% käytetystä halobetasolipropionaattiannoksesta tulee verenkiertoon 96 tunnin kuluessa halobetasolipropionaattivoiteen paikallisen annostelun jälkeen.
Halobetasolipropionaattivoiteella tehdyt tutkimukset osoittavat, että sen teho on erittäin korkea verrattuna muihin paikallisesti käytettäviin kortikosteroideihin.
Halobetasolipropionaattivoiteen käyttöaiheet ja käyttö
Halobetasolipropionaattivoide on erittäin voimakas kortikosteroidi, joka on tarkoitettu kortikosteroidille reagoivien dermatoosien tulehduksellisten ja kutisevien ilmenemismuotojen lievittämiseen. Hoitoa yli kaksi peräkkäistä viikkoa ei suositella, ja kokonaisannos ei saa ylittää 50 g/viikko, koska lääke saattaa tukahduttaa hypotalamus-aivolisäke-lisämunuaisen (hPa) akselin. Käyttöä alle 12-vuotiaille lapsille ei suositella.
kuten muidenkin erittäin aktiivisten kortikosteroidien, hoito tulee keskeyttää, kun kontrolli on saavutettu. Jos paranemista ei havaita 2 viikon kuluessa, diagnoosin uudelleenarviointi voi olla tarpeen.
vasta-aiheet
Halobetasolipropionaattivoide on vasta-aiheinen potilaille, jotka ovat aiemmin olleet yliherkkiä jollekin valmisteen aineosalle.
varotoimet
Yleiset
paikallisesti käytettävien kortikosteroidien systeeminen imeytyminen voi aiheuttaa palautuvan hypotalamus – aivolisäke-lisämunuaisakselin (hPa) suppression, joka saattaa johtaa glukokortikosteroidien vajaatoimintaan hoidon lopettamisen jälkeen. Ilmentymiä Cushingin oireyhtymä, hyperglykemia, ja glukosuria voidaan myös tuottaa joillakin potilailla systeeminen imeytyminen paikallisesti kortikosteroideja hoidon aikana.
potilaat, jotka käyttävät paikallista steroidia suurelle pinta-alalle tai okkluusioalueille, tulee tutkia säännöllisesti HPA-akselin suppression osoittamiseksi. Tämä voidaan tehdä käyttämällä ACTH-stimulaatiota, A. M. plasman kortisolia ja virtsavapaa-kortisolitestejä. Potilaita, jotka saavat erittäin voimakkaita kortikosteroideja, ei tule hoitaa enempää kuin 2 viikkoa kerrallaan ja vain pieniä alueita tulee hoitaa kerrallaan lisääntyneen hyperparatyreoosin estymisriskin vuoksi.
Halobetasolipropionaattivoide sai aikaan HPA-akselin suppression, kun sitä käytettiin jaettuna 7 gramman vuorokausiannoksiin viikon ajan psoriaasipotilailla. Nämä vaikutukset korjautuivat, kun hoito lopetettiin.
Jos HPA-akselin suppressiota havaitaan, lääke on pyrittävä poistamaan käytöstä, annostelutiheyttä on vähennettävä tai tilalle on annettava vähemmän voimakas kortikosteroidi. HPa-akselin toiminta palautuu yleensä nopeasti, kun paikallinen kortikosteroidihoito lopetetaan. Harvoin saattaa esiintyä glukokortikosteroidien vajaatoiminnan merkkejä ja oireita, jotka vaativat systeemisiä kortikosteroideja. Lisätietoja systeemisestä lisäravinteesta on näiden valmisteiden valmisteyhteenvedossa.
lapsipotilaat saattavat olla alttiimpia systeemiselle toksisuudelle ekvivalenttiannoksista johtuen suuremmasta ihon pinta-alasta ja painoindeksistä (KS.varotoimet: lapsipotilaat).
Jos ärsytystä ilmenee, Halobetasolipropionaattivoiteen käyttö tulee lopettaa ja asianmukainen hoito aloittaa. Allerginen kosketusihottuma kortikosteroideilla diagnosoidaan yleensä toteamalla epäonnistuminen parantua eikä huomata kliinisen pahenemisen kuten useimmissa paikallisesti valmisteet, jotka eivät sisällä kortikosteroideja. Tällainen havainto olisi vahvistettava asianmukaisella diagnostisella paikkatestillä.
Jos esiintyy tai kehittyy samanaikaisia ihoinfektioita, on käytettävä sopivaa sienilääkettä tai antibakteerista ainetta. Jos suotuisaa vastetta ei ilmene nopeasti, Halobetasolipropionaattivoiteen käyttö tulee lopettaa, kunnes infektio on saatu riittävästi hallintaan.
halobetasolipropionaattivoidetta ei tule käyttää ruusufinnin tai perioraalidermatiitin hoitoon, eikä sitä saa käyttää kasvoihin, nivusiin tai kainaloihin.
tietoa
paikallisesti kortikosteroideja käyttäville potilaille tulee antaa seuraavat tiedot ja ohjeet:
- lääkitystä tulee käyttää lääkärin ohjeiden mukaan. Se on tarkoitettu vain ulkoiseen käyttöön. Vältä kosketusta silmiin.
- lääkitystä ei tule käyttää mihinkään muuhun häiriöön kuin siihen, mihin se on määrätty.
- hoidettua ihoaluetta ei saa sitoa, muuten peittää tai kääriä okklusiiviseksi, ellei lääkäri määrää.
- potilaiden tulee ilmoittaa lääkärilleen kaikista paikallisista haittavaikutuksista.\
laboratoriokokeet
seuraavista testeistä voi olla apua arvioitaessa potilaiden HPA-akselin suppressiota: ACTH-stimulaatiotesti; A.M. plasman kortisolitesti; virtsatietulehdus-kortisolitesti.
karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
pitkäaikaisia eläinkokeita halobetasolipropionaatin karsinogeenisuuden arvioimiseksi ei ole tehty. Positiivisia mutageenisuusvaikutuksia havaittiin kahdessa genotoksisuuskokeessa. Halobetasolipropionaatti oli positiivinen kiinanhamsterin mikronukleustestissä ja hiiren lymfooman geenimutaatiotestissä in vitro.
oraalisen annon jälkeen rotilla tehdyt tutkimukset annoksella 50 mikrog/kg / vrk eivät viitanneet hedelmällisyyden tai yleisen lisääntymiskyvyn heikkenemiseen.
muissa genotoksisuustesteissä halobetasolipropionaatin ei todettu olevan genotoksinen Ames / Salmonella-määrityksessä, kiinanhamsterin somaattisilla soluilla tehdyssä sisarkromatidinvaihtotestissä, jyrsijöiden sukusolujen ja somaattisten solujen kromosomipoikkeavuustutkimuksissa eikä nisäkkäiden pistemutaatioiden määrittämiseksi tehdyssä spot-testissä.
raskaus
teratogeeniset vaikutukset: Raskauskategoria C
kortikosteroidien on todettu olevan teratogeenisiä koe-eläimillä, kun niitä annetaan systeemisesti suhteellisen pieninä annoksina. Joidenkin kortikosteroidien on todettu olevan teratogeenisiä ihon kautta annosteltaessa koe-eläimillä.
Halobetasolipropionaatin on osoitettu olevan teratogeeninen SPF-rotilla ja chinchilla-tyyppisillä kaniineilla, kun sitä annettiin systeemisesti tiineyden aikana rotilla 0, 04-0, 1 mg/kg ja kaniineilla 0, 01 mg / kg. Nämä annokset ovat noin 13 -, 33-ja 3-kertaisia ihmisen paikalliseen Halobetasolipropionaattivoiteeseen verrattuna. Halobetasolipropionaatti oli sikiötoksinen kaniineilla, mutta ei rotilla.
kitalakihalkiota havaittiin sekä rotilla että kaniineilla. Omphalocelea on havaittu rotilla, mutta ei kaniineilla.
ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia halobetasolipropionaatin teratogeenisuudesta raskaana olevilla naisilla. Halobetasolipropionaattivoidetta tulee käyttää raskauden aikana vain, jos mahdollinen hyöty on suurempi kuin mahdollinen riski sikiölle.
imettävät äidit
systeemisesti annetut kortikosteroidit erittyvät äidinmaitoon ja voivat tukahduttaa kasvua, häiritä endogeenisen kortikosteroidituotannon toimintaa tai aiheuttaa muita haitallisia vaikutuksia. Ei tiedetä, johtaako kortikosteroidien paikallinen annostelu riittävään systeemiseen imeytymiseen, jotta äidinmaitoon kertyisi havaittavissa olevia määriä. Koska monet lääkkeet erittyvät äidinmaitoon, varovaisuutta on noudatettava, kun halobetasolipropionaattivoidetta annetaan imettäville naisille.
lapsipotilailla
Halobetasolipropionaattivoiteen turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu, eikä sen käyttöä alle 12-vuotiaille lapsipotilaille suositella. Koska lapsipotilailla on suurempi ihon pinta-alan ja kehon massan suhde, heillä on aikuisia suurempi HPA-akselin suppression ja Cushingin oireyhtymän riski, kun heitä hoidetaan paikallisesti käytettävillä kortikosteroideilla. Siksi heillä on myös suurempi lisämunuaisen vajaatoiminnan riski hoidon aikana tai sen jälkeen. Imeväisillä ja lapsilla on raportoitu paikallisesti käytettävien kortikosteroidien epäasianmukaiseen käyttöön liittyviä haittavaikutuksia, mukaan lukien striae.
hPa-akselin suppressiota, Cushingin oireyhtymää, lineaarisen kasvun hidastumista, painonnousun hidastumista ja kallonsisäistä hypertensiota on raportoitu paikallisesti käytettäviä kortikosteroideja saavilla lapsilla. Lisämunuaisen suppression ilmentymiä lapsilla ovat alhainen plasman kortisolitaso ja vasteen puuttuminen ACTH-stimulaatiolle. Kallonsisäisen hypertension ilmenemismuodot ovat pullistuneet fontanellit, päänsärky ja molemminpuolinen papilledema.
geriatrinen käyttö
850 halobetasolipropionaattivoiteella hoidetusta potilaasta 21% oli yli 61-vuotiaita ja 6% yli 71-vuotiaita. Muiden raportoitujen kliinisten kokemusten perusteella ei ole havaittu eroja vasteissa iäkkäiden ja nuorempien potilaiden välillä, mutta joidenkin vanhempien potilaiden suurempaa herkkyyttä ei voida sulkea pois.
haittavaikutukset
kontrolloiduissa kliinisissä tutkimuksissa yleisimpiä halobetasolipropionaattivoiteella ilmoitettuja haittavaikutuksia olivat kirvely tai kuumotus 1, 6%: lla potilaista. Harvemmin raportoituja haittavaikutuksia olivat pustulaatio, eryteema, ihon atrofia, leukoderma, akne, kutina, sekundaarinen infektio, telangiectasia, urtikaria, kuiva iho, miliaria, parestesia ja ihottuma.
seuraavia muita paikallisia haittavaikutuksia on raportoitu harvoin paikallisesti käytettävien kortikosteroidien käytön yhteydessä, ja niitä saattaa esiintyä useammin voimakkaiden kortikosteroidien, kuten Halobetasolipropionaattivoiteen, käytön yhteydessä. Nämä reaktiot on lueteltu likimääräisesti laskevassa esiintymisjärjestyksessä: follikuliitti, hypertrichosis, acneiform purkaukset, hypopigmentaatio, perioral dermatiitti, allerginen kosketusihottuma, toissijainen infektio, striae ja miliaria.
ilmoittaaksesi epäillyistä haittavaikutuksista, ota yhteyttä Teligent Pharma, Inc. 1-856-697-1441 tai FDA 1-800-FDA-1088 tai www.fda.gov / medwatch.
yliannostus
Paikallisesti annosteltuna Halobetasolipropionaattivoidetta voi imeytyä riittävästi systeemisten vaikutusten aikaansaamiseksi (KS.varotoimet)h
Halobetasolipropionaattivoiteen Annostus ja anto
levitä ohut kerros Halobetasolipropionaattivoidetta sairaalle iholle kerran tai kahdesti päivässä lääkärisi ohjeiden mukaan ja hiero sitä kevyesti ja kokonaan.
Halobetasolipropionaattivoide on erittäin voimakas paikallinen kortikosteroidi; siksi hoito tulee rajoittaa kahteen viikkoon, eikä yli 50 g/wk: ta saa käyttää. Kuten muidenkin kortikosteroidien käytön yhteydessä, hoito on lopetettava, kun hoitotasapaino on saavutettu. Jos paranemista ei havaita 2 viikon kuluessa, diagnoosin uudelleenarviointi voi olla tarpeen.
Halobetasolipropionaattivoidetta ei tule käyttää okkluusiosidosten kanssa.
miten Halobetasolipropionaattivoidetta toimitetaan
Halobetasolipropionaattivoidetta, 0, 05% toimitetaan seuraavissa putkikooissa:
50 g (NDC 63739-998-67)
säilytys
säilytä Halobetasolipropionaattivoidetta 15°C-30°C (59°F-86°F).
valmistaja:
Teligent Pharma, Inc.
Buena, NJ 08310
Distributed by:
McKesson Corporation
DBA Sky Packaging
4971 Southridge Blvd., Suite 101
Memphis, TN 38141
PI-073-00
C101430 Rev 02/2020
pakkausmerkintä.Pääasiallinen näyttöpaneeli 50 gramman pakkaus
NDC 63739-998-67
Halobetasolipropionaatti
voide, 0, 05%
vain paikalliseen käyttöön.
Ei käytettäväksi silmissä.
netto Wt. 50 grams
Rx Only

| HALOBETASOL PROPIONATE Halobetasol Propionate Ointment |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – McKesson Corporation (140529962)
Registrant – Teligent Pharma, Inc. (011036910)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Teligent Pharma, Inc. | 011036910 | manufacture(63739-998) | |
Frequently asked questions
- Halobetasol vs. clobetasol – how do they compare?
- voiko tätä käyttää myrkkymurattiin?
- voiko sitä käyttää päänahkaan?
lisää halobetasolin ajankohtaisista
- haittavaikutukset
- annostustiedot
- lääkkeiden yhteisvaikutukset
- hinnoittelu &Kupongit
- 25 arviota
- Lääkeluokka: topical steroids
raskauden tai imetyksen aikana
ertaa vaihtoehtoja
Consumer resources
- Patient Information
- Halobetasol Topical application (Advanced Reading)
Professional resources
- Prescribing Information
- Halobetasol (FDA)
- Halobetasol Cream (FDA)
- Halobetasol Foam (FDA)
Other brands Ultravate, Lexette, Bryhali, Halonate
Related treatment guides
- Plaque Psoriasis
- Eczema
- Psoriasis
- Atopic Dermatitis
- Granuloma Annulare
- Dermatitis
Medical Disclaimer
Leave a Reply