Organic Chemistry II

kokeellisesti on kuitenkin havaittu, että C2-C3-sidoksen ympärillä on merkittävä pyörimiseste ja että koko molekyyli on tasomainen. Lisäksi C2-C3-sidos on 148 pm pitkä, lyhyempi kuin tyypillinen hiili-hiili-yksisidos (noin 154 pm), joskin pidempi kuin tyypillinen kaksoissidos (noin 134 pm).
Molekyyliorbitaaliteoria selittää näitä havaintoja delokalisoituneiden pi-sidosten käsitteellä. Tässä kuvassa neljä 2P-atomiorbitaalia yhdistyvät matemaattisesti muodostaen neljä pi-molekyyliorbitaalia, joiden energia kasvaa. Kaksi näistä-liimaus pi orbitaalit – ovat vähemmän energiaa kuin P atomiorbitaalit, joista ne on muodostettu, kun taas kaksi – antibonding pi* orbitaalit-ovat korkeampia energiaa.

matalaenergisellä molekyyliorbitaalilla, pi1: llä, on vain rakentavaa vuorovaikutusta ja nollasolmuja. PI2 – orbitaalilla on suurempi energia, mutta silti pienempi kuin eristetyillä p-orbitaaleilla, yksi solmu mutta kaksi rakentavaa vuorovaikutusta-näin ollen se on edelleen sidosorbitaali kokonaisuudessaan. Kun tarkastellaan kahta antibonding-orbitaalia, pi3*: llä on kaksi solmua ja yksi rakentava vuorovaikutus, kun taas pi4*: llä on kolme solmua ja nolla rakentavaa vuorovaikutusta.
Aufbau-periaatteella eristettyjen 2PZ: n atomiorbitaalien neljä elektronia sijoitetaan sidoksiin pi1 ja pi2 MO. Koska pi1 sisältää C2: n ja C3: n välisen rakentavan vuorovaikutuksen, on 1,3-butadieenimolekyylissä näiden kahden hiilen välinen pi-sidos-vuorovaikutus aste, mikä selittää sen lyhyemmän pituuden ja pyörimisen esteen. 1,3-butadieenin valenssisidoskuvassa kaksi pi-sidosta on eristetty toisistaan siten, että kukin pi-elektronipari on ”jumissa” omassa pi-sidoksessaan. Molekyyliorbitaaliteoria kuitenkin ennustaa (tarkasti), että neljä pi-elektronia ovat jossain määrin delokalisoituneet eli ”levittäytyneet” koko pi-systeemille.

1,3-butadieeni on yksinkertaisin esimerkki konjugoituneiden pi-sidosten järjestelmästä. Jotta voidaan pitää konjugoituneena, kaksi tai useampia pi-sidoksia on erotettava vain yhdellä sidoksella-toisin sanoen väliin ei voi tulla sp3-hybridisoitunutta hiiltä, koska tämä hajottaisi rinnakkaisten p-orbitaalien päällekkäisen järjestelmän. Alla olevassa yhdisteessä esimerkiksi C1-C2-ja C3-C4-kaksoissidokset ovat konjugoituneita, kun taas C6-C7-kaksoissidos eristetään kahdesta muusta pi-sidoksesta sp3-hybridisoituneella C5: llä.

erittäin tärkeä mielessä pidettävä käsite on, että konjugaatioon liittyy luontainen termodynaaminen stabiilisuus. Tämä stabiilisuus voidaan mitata kokeellisesti vertaamalla kahden eri dieenin hydrauksen lämpöä. (Hydraus on reaktiotyyppi, josta opimme paljon lisää luvussa 15: pohjimmiltaan se on prosessi, jossa P – sidokseen lisätään vetymolekyyli – kaksi protonia ja kaksi elektronia). Kun 1,3-pentadieenin kaksi konjugoitua kaksoissidosta ”hydrataan” pentaanin tuottamiseksi, vapautuu noin 225 kJ muodostunutta pentaania moolia kohden. Vertaa tätä noin 250 kJ / mol vapautuvaan, kun 1,4-pentadieenin kaksi eristettyä kaksoissidosta hydrataan, jolloin muodostuu myös pentaania.
synteettisten polymeerien muodostumista dieeneistä kuten 1,3-butadieenista ja isopreenista käsitellään kohdassa 18.5. Synteettiset polymeerit ovat suuria molekyylejä, jotka koostuvat pienemmistä toistuvista yksiköistä. Olet luultavasti jonkin verran perehtynyt näihin polymeereihin; esimerkiksi polyeteeni, polypropeeni, polystyreeni ja poly(vinyylikloridi).

kuva 13.6: 1,3-butadieenin hydrauksen energiakaavio (ei mittakaavassa).
koska 1,3-butadieenin hydrauksessa vapautuu vähemmän energiaa kuin on ennustettu, 1,3-butadieenin energiasisällön on oltava pienempi kuin saatoimme olettaa. Toisin sanoen 1,3-butadieeni on vakaampi kuin sen kaava antaa ymmärtää.
konjugoituneen dieenin energia on pienempi: toisin sanoen se on stabiilimpi. Yleensä konjugoituneet pi-sidokset ovat stabiilimpia kuin eristetyt pi-sidokset.
tässä on energiakaavio, jossa verrataan erityyppisiä sidoksia niiden vedytyslämpöihin (moolia kohti), jotta voidaan osoittaa kunkin molekyylin suhteellinen stabiilisuus (1 kcal = 4,18 kJ). (Mitä pienempi lämpö vedytys (per pi-sidos), sitä stabiilimpi rakenne on.)
dieenien stabilointi konjugaatiolla on vähemmän dramaattinen kuin bentseenin aromaattinen stabilointi. Konjugaatiosta voidaan kuitenkin kirjoittaa samanlaisia resonanssi-ja molekyyliorbitaalikuvauksia.
dieenien synteesi
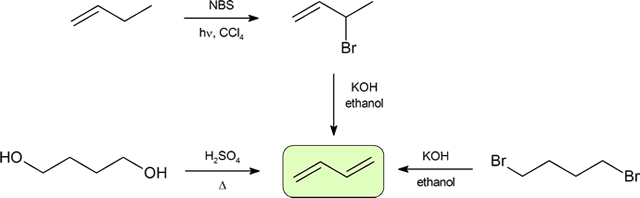
kaksi yleisintä tapaa syntetisoida konjugoituja dieenejä ovat alkoholien dehydraatio ja organohalidien dehydrohalogenointi, jotka otettiin käyttöön alkeenien valmistuksessa (kohta 9.9). Seuraavassa kaaviossa esitetään joitakin konjugoidun dieenin valmistusreittejä.
konjugoituneet pii-systeemit voivat sisältää happi-ja typpiatomeja sekä hiiltä. Rasvamolekyylien aineenvaihdunnassa osa keskeisistä reaktioista liittyy karbonyyliryhmiin konjugoituneisiin alkeeneihin.

MO-teoria on erittäin hyödyllinen selitettäessä, miksi orgaanisilla molekyyleillä, jotka sisältävät konjugoituneita pi-sidoksia, on usein tunnusomaisia värejä. beetakaroteenia, yhdiste vastuussa oranssi väri porkkanat, on laajennettu järjestelmä 11 konjugoitu pi sidoksia.

harjoitukset
harjoitus 2,9: Tunnista kaikki konjugoituneet ja eristetyt kaksoissidokset alla olevista rakenteista. Kunkin konjugoituneen pi-systeemin osalta määritetään päällekkäisten p-orbitaalien määrä ja kuinka monta pi-elektronia jaetaan niiden kesken.

harjoitus 2.10: Tunnista kaikki eristetyt ja konjugoituneet pi-sidokset lykopeenista, punaisesta yhdisteestä tomaateissa. Kuinka monta pi-elektronia on konjugoidussa pi-järjestelmässä?
Leave a Reply