Virusviive:
kun kuvittelet virusten piiloutuvan immuunijärjestelmältäsi, saatat ajatella herpes simplex-virusta, joka aiheuttaa huuliherpestä ja sukupuolielinten herpestä, tai varicella-zoster-virusta, joka aiheuttaa vyöruusua. Nämä virukset voivat säilyä vuosikymmeniä horroksen kaltaisessa tilassa, joka tunnetaan latenssina, ja välttää immuunijärjestelmän havaitsemisen (Kennedy et al., 2015). Piilevät virukset voivat joskus herätä ja alkaa monistua jälleen, aiheuttaen oireita ja levittää tartuntaa (Lieberman, 2016).
ihmisen immuunikatovirus (HIV) on samalla tavoin mestaripakolainen. Se muodostaa piilevän säiliön varhain tartunnassa, jolloin virus voi kiertää immuunijärjestelmää ja selviytyä pitkällä aikavälillä. HIV: n kanssa elävät ihmiset käyttävät päivittäin lääkkeitä, jotka tunnetaan yhdistelmähoitona antiretroviraalista hoitoa (tai ART-hoitoa) estääkseen viruksen replikaation. Taide ei kuitenkaan ole lääke, sillä se ei kohdistu viruksiin, jotka ovat jo piileviä. Näitä lääkkeitä annetaan siis yksilön eliniäksi: jos hoito lopetetaan jopa muutamaksi viikoksi, piilevät virukset aktivoituvat ja syttyvät uudelleen aktiiviseen infektioon. HIV: tä sairastavat voivat odottaa pitkää, tervettä elämää taiteen ansiosta, mutta piileviä viruksia on aina heidän elimistössään.
HIV: n parannuskeinon löytäminen edellyttää piilevän virussäiliön eliminoimista tai kontrolloimista. Joitakin keskeisiä kysymyksiä on kuitenkin vielä käsiteltävä tämän tavoitteen saavuttamiseksi. Miten, milloin ja missä HIV luo latenssin? Mikä on piilevän säiliön koko ja paras tapa mitata se? Mikä saa piilevät virukset aktivoitumaan uudelleen? Nyt, Elife, Miles Davenport, Brandon Keele ja kollegat University of New South Wales ja Frederick National Laboratory for Cancer Research-mukaan lukien Mykola Pinkevych ensimmäisenä kirjoittajana-raportoivat, kun latentti säiliö on perustettu ei-ihmisen kädellinen malli HIV ja kuinka paljon säiliö voidaan aktivoida uudelleen (Pinkevych et al., 2019).
tässä tutkimuksessa ryhmä tartutti reesusmakakkeja apinoiden immuunikatoviruksella (SIV), joka on esiastevirus, joka on endeeminen afrikkalaisilla apinoilla ja geneettisesti samanlainen kuin HIV (Williams and Burdo, 2009). Jossain vaiheessa 1900-luvulla SIV hyppäsi ei – ihmisapinoista ihmiseen; tämä lajien välinen transmissio yhdistettynä nopeaan evoluutioon mahdollisti viruksen tehokkaan leviämisen ihmisissä ja synnytti meneillään olevan HIV-pandemian (Keele et al., 2006).
Pkevytš et al. alkoi tartuttamalla reesusmakakkeja suunnitellulla SIV: llä, joka sisältää yli 10 000 ainutlaatuista satunnaistettua DNA-sekvenssiä; kun ne on sekvensoitu, nämä ’viivakoodit’ mahdollistavat yksittäisten virusten tunnistamisen (Fennessey et al., 2017). Apinoita hoidettiin antiretroviraalihoidolla 4, 10 tai 27 päivän kuluttua tartunnasta. Nämä intervallit simuloivat akuuttia (4 päivää), varhaista (10 päivää) tai myöhäistä interventiota (27 päivää) AVUSTEISELLA AVUSTEELLA ihmisillä. Lääkkeitä annettiin noin vuoden ajan, ja virus tukahdutettiin kokonaan kaikilla eläimillä. Tämän jälkeen hoito lopetettiin ja piilevän viruksen annettiin aktivoitua uudelleen. Geneettisen sekvensoinnin ja matemaattisen mallinnuksen avulla ryhmä määritteli SIV: n piilevän varaston koon ja sen aktivoitumisen.
apinoilla hoidon aloittaminen neljä päivää infektion jälkeen ei estänyt piilevän säiliön muodostumista, mutta pienensi sen kokoa noin 100-kertaiseksi myöhempään avusteisten avusteisten lisääntymismenetelmien aloitukseen verrattuna. Samoin ihmisillä, jotka aloittavat taiteen muutamassa päivässä HIV: n hankkimisesta, on erittäin pieni säiliö verrattuna niihin, jotka aloittavat hoidon myöhemmin (Luzuriaga et al., 2015; Henrich ym., 2017). Näistä suurista eroista huolimatta Kokonaisvaraston koossa piilevät virukset aktivoituivat uudelleen yhtä nopeasti akuutin, varhaisen ja myöhäisen hoidon saaneilla eläimillä, kun ART lopetettiin (Kuva 1). Pinvych ym. tästä syystä päätellään, että suurin osa viruksista, jotka voivat aktivoitua uudelleen, havaitsevat latenssin varhain tartunnan jälkeen.
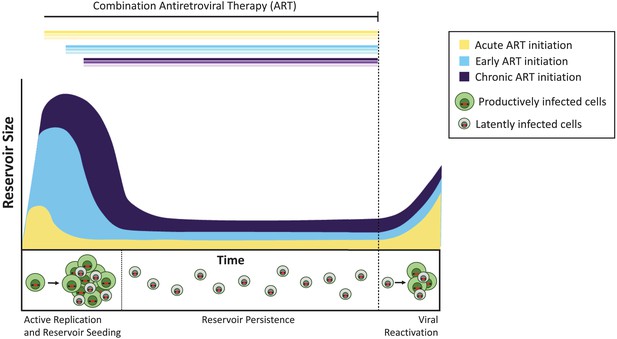
antiretroviraalisen hoidon ajoitus vaikuttaa piilevän säiliön kokoon.
ilman hoitoa aktiivisesti replikoituvan viruksen infektoimat solut (tuottavasti infektoituneet solut, jotka on merkitty vihreällä) luovat tarttuvia viruksia. Vähemmistö infektoituneista soluista sisältää viruksia, jotka voivat säilyä loputtomiin piilevänä varastona (latently infected cells; kuvassa harmaa), ja nämä virukset voidaan mahdollisesti aktivoida uudelleen myöhemmin. Akuutin infektion aikana (eli päivien tai viikkojen kuluessa primaarisesta infektiosta; keltainen käyrä) annettu hoito johtaa pienempään piilevään säiliöön kuin hoidon alussa (kuuden kuukauden kuluessa infektiosta, vaaleansininen) tai kroonisen infektion aikana (yli 6 kuukautta infektiosta, violetti). Jos hoito lopetetaan (katkaistu linja), virus aktivoituu uudelleen näistä säiliöistä samalla tasolla, jolloin aktiivinen infektio syttyy uudelleen ja piilevä säiliö kylvetään uudelleen.
selvittääkseen, miksi hoidon ajoitus ei näyttänyt vaikuttavan uudelleenaktivoitumisen nopeuteen, ryhmä mittasi latenttien virusten geenimutaatioiden tason. Jos viruksille kertyy sitä enemmän vahingollisia mutaatioita, mitä kauemmin ne ovat aktiivisesti lisääntyneet elimistössä, tämä viittaisi siihen, että eläimet, jotka saavat viivästynyttä taidetta, voisivat kantaa suuremman osan piilevistä viruksista, jotka ovat viallisia eivätkä voi herätä uudelleen. Ryhmä kuitenkin havaitsi, että suurin osa viruksista (yli 80%) oli geneettisesti koskemattomia kaikissa eläimissä riippumatta siitä, milloin hoito aloitettiin. Tämä on aivan eri asia kuin HIV-infektio ihmisillä, joissa suurin osa piilevistä viruksista sisältää suuria geneettisiä mutaatioita ja deleetioita, jolloin jäljelle jää vain pieni osa (2-11%), joka kykenee aktivoitumaan uudelleen (Ho et al., 2013; Bruner ym., 2019).
tuoreessa tutkimuksessa, jossa arvioitiin HIV-säiliön dynamiikkaa ihmisillä stabiililla taiteella, havaittiin toinen ristiriita tämän SIV-mallin ja HIV-latenssin välillä ihmisillä. Jatkuvasta taiteesta huolimatta piilevä HIV voi joskus spontaanisti aktivoitua uudelleen ja virukset tulevat havaittaviksi veressä hetkeksi. Ihmisillä nämä viruksen ”blips”liittyvät fylogeneettisesti virussäiliöön, joka ei ole perustettu vain alkuperäisen infektion yhteydessä, vaan vuosien hoitamattomien infektioiden aikana (Jones et al., 2018). Näiden erojen syitä ei tunneta hyvin, ja ne ovat tärkeitä aloja jatkuvalle tutkimukselle.
huolimatta eroista kädellisten mallien ja ihmisen HIV-infektion välillä, Pinvych et al. vahvistaa, että viruksen latenssi todetaan erittäin varhain tartunnan jälkeen. Nämä tulokset viittaavat siihen, että antiretroviraalinen hoito tulee aloittaa mahdollisimman pian HIV-infektion pitämiseksi hallinnassa ja piilevän säiliön koon pienentämiseksi. Paljon on vielä tuntematon siitä, miten HIV latenssi on perustettu ja ylläpidetään, erityisesti hoidon aikana; kuitenkin SIV mallit ovat edelleen tärkeä väline ymmärtää, miten hävittää piilevä säiliö.
Leave a Reply