Vuoden 2019 Gina Guidelines for astman Treatment in Adults
US Pharm. 2020;45(7/8):18-24.
Abstrakti: astman oireiden hallinnan varmistaminen farmakologisilla ja ei-farmakologisilla toimenpiteillä parantaa elämänlaatua ja ehkäisee astmaa sairastavien potilaiden pahenemisvaiheita. Global Initiative for Asthma 2019-ohjeissa annetaan suosituksia astman hoitoon, joka on järjestetty viiteen vaiheeseen, jotka korreloivat sairauden vakavuuden kanssa. Lääkitysvaihtoehtoja ovat hengitettävät kortikosteroidit (ICS), pitkävaikutteiset beeta2-agonistit, lyhytvaikutteiset beeta2-agonistit (SABAs), leukotrieenireseptoriantagonistit ja oraaliset kortikosteroidit. Viimeaikaiset tiedot osoittavat epäedullisia tuloksia SABAs käytetään yksinään tarpeen lievän astman oireiden hoitoon. Ohjemuutoksiin kuuluu pieniannoksisen ICS: n käyttö formoterolin kanssa tarvittaessa lievän astman hoitoon aikuisille tai käytettäväksi aina, kun SABA: ta käytetään. Asianmukainen, tehokas lääkitys hoito yhdistettynä oikean inhalaattoritekniikan neuvontaan auttaa potilaita saavuttamaan astman hallinnan tavoitteet.
astma on krooninen tulehduksellinen hengitystiesairaus, jolle on ominaista hengitysteiden ylivaste, ja sen oireita voivat olla hengityksen vinkuminen, hengenahdistus, puristava tunne rinnassa ja yskä.1 nämä oireet voivat vaihdella ajan ja voimakkuuden, joten tehokas hoito astman tärkeää. Oireita laukaisevia tekijöitä voivat olla liikunta, virusperäiset hengitystieinfektiot ja ympäristötekijät, kuten tupakointi. Hoitamatta jäävät oireet voivat johtaa pahenemisvaiheisiin. Paheneminen on akuutti episodi, jossa oireet pahenevat rajusti ja keuhkojen toiminta heikkenee asteittain. Mikä tahansa pahenemisvaihe antaa aihetta keskustella potilaan nykyisestä astman hoito-ohjelmasta sairaalahoidon, ensihoitokäyntien ja astmaan liittyvän kuoleman riskien vuoksi.
vuoden 2019 Global Initiative for Asthma (GINA) – ohjeissa ei suositella pelkän lyhytvaikutteisen beta2-agonistin (SABA) inhalaattorin käyttöä lievän astman hoitoon; sen sijaan he suosittelevat pieniannoksisen inhaloitavan kortikosteroidin (ICS)-formoterolin käyttöä tarpeen mukaan ja ylläpitohoidossa.2 potilailla, joilla on vaikea tai vaikeasti hoidettava astma, muita vaihtoehtoja voidaan harkita inhalaattorihoidon lisänä, kuten leukotrieenireseptoriantagonistit (Ltrat), tiotropium, biologiset lääkkeet, atsitromysiini ja oraaliset kortikosteroidit (OCS).
astman hallinta tarkoittaa sitä, missä määrin potilaalla voidaan havaita astman piirteitä tai ne ovat vähentyneet tai poistuneet hoidosta.2 astman hallinta on tarkistettava edellisten 4 viikon aikana. Potilaalle tulee esittää seuraavat kysymykset: ”Onko sinulla ollut edellisen 4 viikon aikana: 1) päiväaikaisia astmaoireita yli kaksi kertaa viikossa? 2)Onko astmasta johtuvia yöllisiä heräämisiä? 3) käyttää astmalääkettä oireisiin yli kaksi kertaa viikossa? 4) Onko astmasta johtuvia aktiivisuusrajoituksia?”Jos potilas vastaa” Ei ” kaikkiin neljään kysymykseen, hänen astmansa on hyvin hallinnassa. Jos potilas vastaa ”kyllä” yhteen tai kahteen kysymykseen, astma on osittain hallinnassa, mutta jos vastaus on ”kyllä” kolmeen tai neljään kysymykseen, astma ei ole hyvin hallinnassa.2 riskitekijöitä, jotka voivat aiheuttaa pahenemista ovat hallitsematon astma, tupakointi, allergeeni altistuminen, ilmansaasteet, liitännäissairauksia, kuten liikalihavuus, ja korkea SABA käyttö.
potilaan inhaloitavan lääkityksen noudattamisen arviointi on toinen tärkeä askel. On monia syitä siihen, että potilas ei ehkä ole sitoutunut astmalääkitykseen, mukaan lukien vaikeus käyttää inhalaattorilaitteita, lääkityskustannukset, unohdus, ohjeiden noudattamatta jättäminen ja käsitys siitä, että lääkitys ei ole tarpeen.2
hoito ja hoito
astman hoidon tavoitteisiin kuuluvat oireiden hallinta normaalin aktiivisuustason ylläpitämiseksi, jatkuvan ilmavirran rajoittamisen estäminen ja taulukossa 1 lueteltujen lääkkeiden haittavaikutusten vähentäminen. Farmakologiset ja ei-farmakologiset toimenpiteet vähentävät sairaalahoitoon tai astmaan liittyvän kuoleman aiheuttavien pahenemisvaiheiden riskiä tulevaisuudessa.2
Nonfarmakologinen hoito
Nonfarmakologinen hoito kaikille astmapotilaille sisältää hengitysharjoituksia, liikunnan lisäämistä, terveellisen ruokavalion sisällyttämistä sekä savulle ja muille aineille altistumisen välttämistä.2 joogan harjoittaminen ja hengitysmenetelmät, kuten Buteyko-ja Papworth-tekniikat, muuttavat hengitystapoja hyperventilaation vähentämiseksi, mikä edistää vapaaehtoista relieverin käytön vähentämistä ja parantaa astmaoireita.3 lihavilla potilailla laihtuminen yhdistettynä kahdesti viikossa tapahtuvaan aerobiseen ja voimaharjoitteluun on tehokkaampaa kuin pelkkä liikunta oireiden hallintaan.2 oikean inhalaattoritekniikan neuvonta auttaa potilaita saavuttamaan astman hallinnan tavoitteet.
farmakologinen hoito
astman lääkehoidon säätöjä tehdään kuvassa 1 kuvatun kontrolliin perustuvan astmanhallintasyklin läpi.2
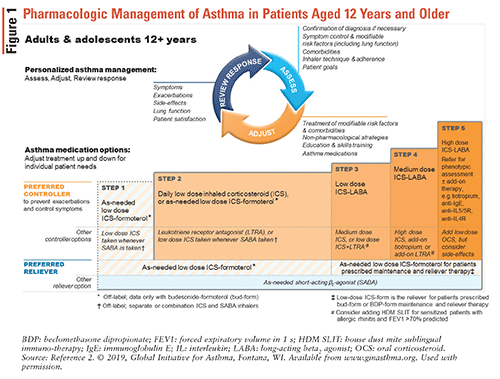
kun astma on diagnosoitu, tulee aloittaa ICS: ää sisältävä kontrollerihoito, koska keuhkojen toiminta paranee enemmän kuin silloin, kun ICS-kontrolleria ei käytetä. Tämä on merkittävä muutos vuoden 2019 GINA-ohjeissa, sillä aiemmin suositeltiin, että vasta diagnosoiduille potilaille annettaisiin pelkkä SABA. ICS-formoterol – yhdistelmä-inhalaattori on ensisijainen tarpeellinen reliever-hoito astman vakavuudesta riippumatta. Vaihtoehtoinen reliever hoito on SABA; se on kuitenkin yhdistettävä toiseen inhalaattoriin, joka sisältää ICS: ää. ICS-formoterol inhalaattorit ovat turvallisia ja tehokkaita, ja niiden kyky käyttää sekä tarpeen ja ylläpitohoidon tekee niistä helppokäyttöisiä potilaille.2
GINA suosittelee seuraavia astman hoitovaiheita2:
• Vaihe 1: tätä vaihetta suositellaan lievää astmaa sairastaville potilaille, joilla on oireita alle kaksi kertaa kuukaudessa eikä pahenemisvaiheiden riskiä ole. Kuten aiemmin mainittiin, uuden näytön perusteella vuoden 2019 Gina-ohjeissa ei enää suositella Saban käyttöä pelkästään astman hoitoon.
* Vaihe 2: Ensisijainen ohjain hoito on tarpeen pieni annos ICS-formoterolia tai päivittäin pieni annos ICS plus tarpeen SABA. ICS-formoterolihoito välttää päivittäisen ICS-hoidon tarpeen samalla kun se tarjoaa samanlaisia etuja rasituksen aiheuttaman bronkokonstriktion hoidossa kuin päivittäinen ICS tarvittaessa SABA: n kanssa.
* Vaihe 3: Suositeltavat kontrollointihoidot sisältävät pieniannoksisen ICS-pitkävaikutteisen beeta2–agonistin (LABA) ja tarvittaessa Saban tai pieniannoksisen ICS-formoterolin sekä ylläpito-että reliever-hoitoon.
* Vaihe 4: Ensisijainen controller hoito on pieni annos ICS-formoterol huolto-ja reliever hoito tai medium-annos ICS-LABA kuin huolto ja tarvittaessa SABA. Huomaa, että ICS-formoterolia ei tule yhdistää eri Laban sisältävään ICS-LABA: han.
* Vaihe 5: pysyviä pahenemisvaiheita tai oireiden pahenemista tapahtuu huolimatta noudattamisesta ja oikeasta inhalaattoritekniikasta. Näillä potilailla katsotaan olevan vaikea tai vaikeasti hoidettava Astma, ja heidät on ohjattava pulmonologille.
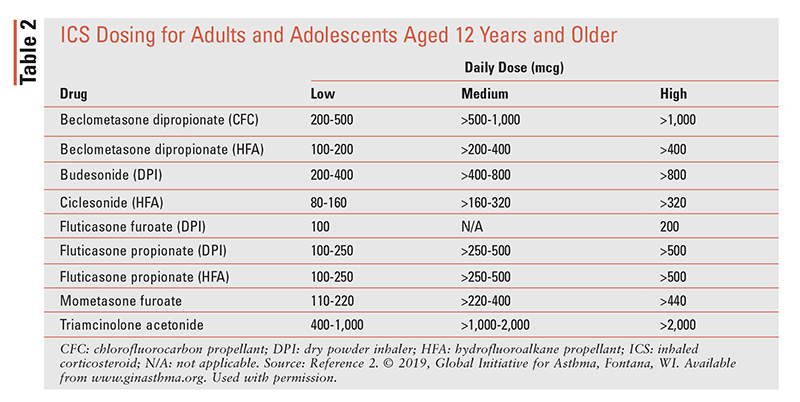
edellä kuvattujen vaiheiden tehostaminen on tarkoituksenmukaista, jos potilaalla on jatkuvasti huono oireiden hallinta tai pahenemisvaiheita pieniannoksisesta ICS-hoidosta huolimatta 2-3 kuukauden ajan. Astuminen alas on paikallaan, kun potilaalla on hyvä oireiden hallinta ja vakaa keuhkojen toiminta vähintään 3 kuukautta. Vaihtoehdot astua alas riippuu siitä, mitä lääkitystä potilas ottaa ja mikä vaihe potilas on, mutta useimmille potilaille, lopputulos on huonompi, jos ICS tai LABA lopetetaan kokonaan.2 ICS-annostelu on esitetty taulukossa 2.
oireita voidaan arvioida muun muassa astman Kontrollikyselyllä, astman Kontrollitestillä ja Royal College of Physiciansin kolmella kysymyksellä.2 Nämä kyselylomakkeet mahdollistavat pisteiden yhdistämisen oireisiin ja kysyvät potilailta oireiden esiintymistiheydestä ja tyypeistä, kuten yöllisistä heräämisistä ja päivittäisten toimintojen rajoituksista.
pahenemisvaiheet
termillä astman paheneminen tarkoitetaan keuhkojen toiminnan ja oireiden akuuttia huononemista enemmän kuin potilas yleensä kokee. Ensisijainen lievittävä hoito pahenemisvaiheen aikana on pieni annos ICS-formoterolia, jota voidaan lisätä tarpeen mukaan oireiden pahentuessa. ICS-Laban (beklometasoni tai budesonidi ja formoteroli) käyttö sekä reliever-että controller-lääkkeenä parantaa oireiden hallintaa ja vähentää sairaalahoitoa ja OCS: n käyttöä verrattuna samaan tai suurempaan ohjainannokseen sekä tarvittavaan SABA-annokseen.4
lyhyt OCS-hoito on hoitovaihtoehto pahenemisvaiheen aikana, kun potilas ei saa vastetta kohottajan ja kontrolloijan suuremmalle annokselle 2-3 päivän kuluttua, hänellä on ollut äkillisiä vakavia pahenemisvaiheita tai keuhkojen toiminta on heikentynyt nopeasti (ekspiratorinen huippuvirtaus tai pakotettu ekspiratorinen tilavuus 1 sekunnissa <60% henkilökohtaisesta parhaasta tai ennustetusta arvosta).4
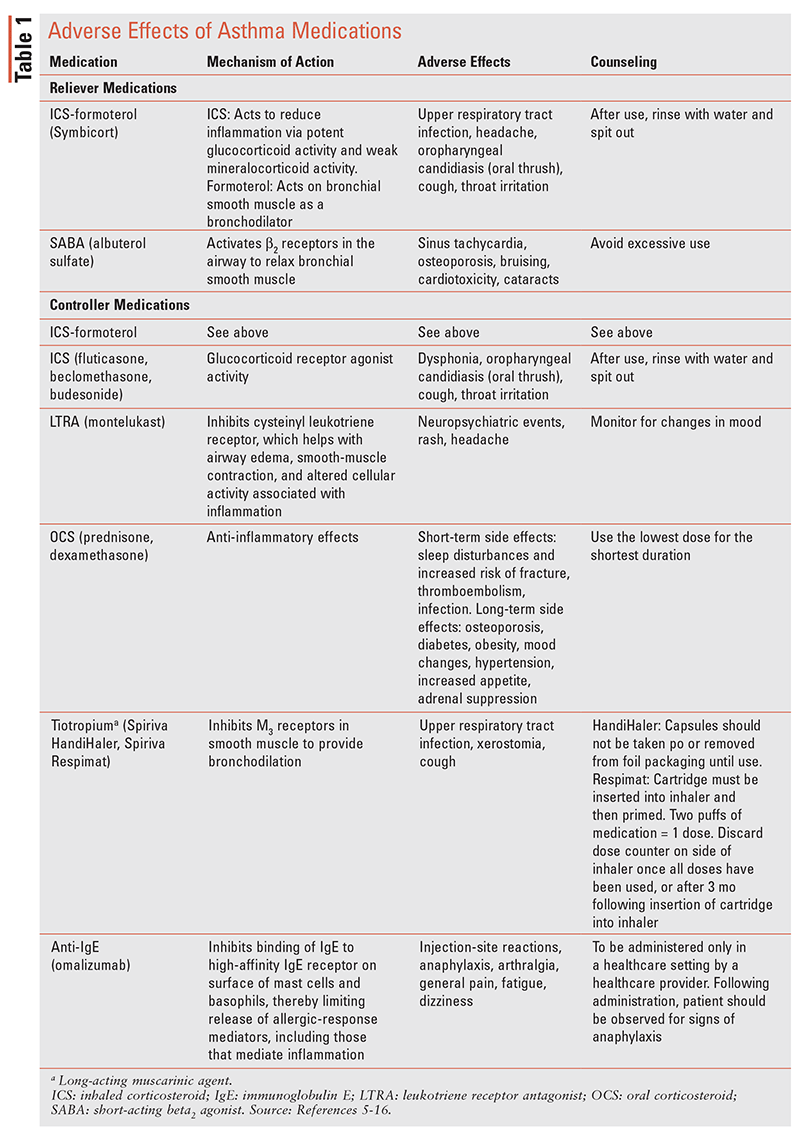
astmalääkkeiden haittavaikutukset
katso taulukosta 1 yhteenveto eri astmalääkkeiden haittavaikutuksista.5-16
vaikea tai vaikeasti hoidettava astma
vaikea tai vaikeasti hoidettava astma viittaa hoitamattomaan astmaan hoitovaiheissa 4 ja 5 huolimatta siitä, että hoitoa ja siihen vaikuttavien tekijöiden hoitoa noudatetaan riittävästi. Alkukartoituksen jälkeen 12-vuotiaat ja sitä vanhemmat potilaat, joilla on riittämätön astman hoitotasapaino ja jotka saavat keskiannoksisen ICS: n sekä laba: n ja/tai kolmannen kontrollaattorin, kuten LTRA: n tai pitkäkestoisesti vapautuvan teofylliinin, siirrytään suuriannoksisen ICS: n tutkimiseen 3-6 kuukaudeksi. ICS: n lisäämisen lisäksi voidaan harkita lisäaineen, kuten tiotropiumin, leukotrieeni-modifierin tai OCS: n, tutkimista. Aikuispotilaille, joilla on jatkuvia astmaoireita keskivaikeista tai suuriannoksista ICS: stä ja LABA: sta huolimatta, vuoden 2019 Gina-ohjeissa suositellaan atsitromysiiniä lisänä.
Jos nonbiologisilla lääkkeillä, kuten LABA -, tiotropium-ja leukotrieenimuunnoksilla, ei pystytä hoitamaan potilaan astmaoireita, biologisia lääkkeitä voidaan harkita hinnasta ja potilaan resursseista riippuen. Allergista astmaa sairastavilla voidaan harkita immunoglobuliini E-hoitoa, kuten omalitsumabia. Jos biologiset lääkkeet eivät ole vaihtoehto potilaalle, voidaan harkita OCS-hoitoa annoksella, joka on 7,5 mg tai vähemmän päivässä prednisoniekvivalenttina. Kuitenkin OCS liittyy merkittäviä sivuvaikutuksia, kuten osteoporoosi, liikalihavuus, diabetes, kaihi, verenpainetauti, ja lisämunuaisen suppressio, ja siksi olisi pidettävä viimeinen rivi.17
tutkimukset
o ’ Byrnen ja kollegoiden tekemässä kaksoissokkotutkimuksessa selvitettiin ICS: n ja SABA: n käytön hyötyä tavanomaiseen hoitoon verrattuna.Yhteensä 3 849 lievää astmaa sairastavaa 12-vuotiasta tai sitä vanhempaa potilasta satunnaistettiin saamaan terbutaliinia (lumelääke kahdesti vuorokaudessa + terbutaliini 0, 5 mg prn), budesonidiformoterolia (lumelääke kahdesti vuorokaudessa + budesonidiformoteroli 200 mikrog/6 mikrog prn) tai budesonidia ylläpitohoitona (budesonidi kahdesti vuorokaudessa 200 mikrog plus terbutaliini prn). Ensisijaisena tavoitteena oli selvittää, oliko tarpeen mukainen budesonidiformoteroli parempi kuin oireiden hallintaan tarvittava terbutaliini. Tulos mitattiin sähköisestä oirepäiväkirjasta saaduilla tiedoilla.
tarpeellinen budesonidiformoteroli oli astman oireiden hallinnassa parempi kuin tarpeellinen terbutaliini lievää astmaa sairastavilla potilailla. Budesonidiformoterolipotilailla astma oli hyvin hallinnassa 34, 4%: lla viikoista ja 31, 1%: lla viikoista terbutaliiniryhmässä (p = .046). Terbutaliiniin liittyi eniten vakavia pahenemisvaiheita (0.20) verrattuna budesonidiformoteroliin (0, 07) ja budesonidihoitoon (0, 09). Budesonidiformoterolin käytön etuna oli se, että kortikosteroideille altistuminen väheni, koska budesonidiannos oli tässä ryhmässä 17% pienempi kuin ylläpitoryhmässä (57 mikrog ja 340 mikrog).18
Bateman ja kollegat tutkivat inhaloidun glukokortikoidikomponentin ja nopeavaikutteisen relieverin tehoa lievään astmaan.5 Tässä 52 viikkoa kestäneessä kaksoissokkoutetussa monikeskustutkimuksessa oli mukana 4 215 lievää astmaa sairastavaa, iältään vähintään 12-vuotiasta potilasta, joille voitiin antaa säännöllistä inhaloitavaa glukokortikoidihoitoa. Osallistujat jaettiin kahteen ryhmään sen arvioimiseksi, oliko tarpeen mukaan annetulla budesonidiformoterolilla tai budesonidihoidolla kaksi kertaa päivässä parempi teho suhteessa vaikeiden pahenemisvaiheiden vuotuiseen määrään. Budesonidiformoteroliryhmä oli vähemmän inferior kuin vaikeiden pahenemisvaiheiden ylläpitoryhmä budesonidi. Lisäksi inhaloidun glukokortikoidiannoksen mediaani päivässä oli pienempi budesonidiformoteroliryhmässä (66 mikrog) kuin ylläpitoryhmässä (267 mikrog). Aika ensimmäiseen pahenemiseen oli samanlainen ryhmien välillä; budesonide-ylläpitoryhmässä oli kuitenkin 0, 11 U: n ero, jolla oli pienemmät pisteet astman Kontrollikyselyssä-5 (ACQ-5) verrattuna budesonidi-formoteroliryhmään. Pienin kliinisesti merkittävä ero ACQ-5-pisteissä on 0,5 U. Haittatapahtumissa, astmaan liittyvissä keskeyttämisissä tai kuolleisuudessa ei havaittu eroa näiden kahden ryhmän välillä. Tämä tutkimus ja O ’ Byrne-tutkimus tukevat nykyistä 2019 Ginan suositusta, joka kieltää pelkän Saban käytön ja sen sijaan ICS-formoterolin käytön.
Gibsonin ja kollegoiden tekemässä tutkimuksessa tutkittiin oraalisen atsitromysiinin tehoa ja turvallisuutta lisähoitona potilailla, joilla oli hallitsematon jatkuva astma ja jotka saivat myös keskisuuria tai suuria annoksia ICS: ää ja laba: ta.17 tässä satunnaistetussa lumekontrolloidussa kaksoissokkotutkimuksessa 420 potilasta satunnaistettiin toiseen kahdesta hoitoryhmästä (atsitromysiini 500 mg tai lumelääke kolmesti viikossa 48 viikon ajan). Tehon ensisijaisia päätetapahtumia olivat astman pahenemisvaiheiden kokonaismäärä (vaikeat ja keskivaikeat) ja astmaan liittyvä elämänlaatu kokonaisuudessaan tutkimusjakson aikana.
Gibsonin tutkimuksessa atsitromysiinin todettiin vähentävän astman pahenemisvaiheita; 44%: lla atsitromysiinipotilaista esiintyi vähintään yksi pahenemisvaihe, kun taas plasebopotilailla vastaava luku oli 61% (p <.0001). Lisäksi atsitromysiinin käyttö paransi merkittävästi astmaan liittyvää elämänlaatua, mikä näkyy astmaan liittyvän elämänlaadun parantumisena kaikissa luokissa (ts.aktiivisuus, oireet, tunteet ja ympäristönäkökohdat). Ainoa merkittävä ero tutkimusryhmien välillä oli ripulin esiintyminen, joka oli merkitsevästi suurempi atsitromysiinipotilailla (34% vs. 19% plasebopotilaista). Turvallisuusseurantaa varten ECGs tehtiin seulonnassa, 6 hoitoviikon jälkeen ja hoidon päätyttyä. Yli 480 ms: n pituinen QTc-aika johti tutkimuksen keskeyttämiseen kahdella potilaalla (yksi kustakin ryhmästä).17
muutokset vuoden 2019 ohjeissa
vuoden 2019 ohjeissa on viisi merkittävää muutosta aikuisten astman hoidossa. Ensimmäinen muutos on siirtyminen vain Saba-hoidosta ICS-lääkkeisiin lievän astman oireiden tarpeen mukaan.4 Toinen muutos on pieniannoksisen atsitromysiinin lisääminen kolmesti viikossa oireisen astman pitkäaikaishoitoon keskivaikeasta tai suuriannoksisesta ICS-LABA-hoidosta huolimatta; mahdolliset haittavaikutukset on kuitenkin otettava huomioon.
kolmas muutos on suositus dupilumabista, Anti–interleukiini-4-reseptorin alfa-monoklonaalista vasta-ainetta, lisähoitona 12-vuotiaille ja sitä vanhemmille potilaille, joilla on vaikea tyypin 2 astma tai OCS: stä riippuvainen astma.Wenzelin ja kollegoiden tekemä tutkimus osoitti, että dupilumabi lisäsi keuhkojen toimintaa ja vähensi vaikeita pahenemisvaiheita potilailla, joilla oli hallitsematon, jatkuva astma.20
neljäs muutos on suurten annosten ICS-LABA-hoidon sisällyttäminen vain vaiheeseen 5, kun aiemmin se oli sisällytetty vaiheeseen 4 kohtalaisen annoksen ICS-LABA-hoidon yhteydessä; tämä johtuu suosituksesta, että suuria annoksia ICS: ää tulisi määrätä vain muutaman kuukauden ajan siihen liittyvien haittavaikutusten huomioon ottaen.17 viides muutos on kunnossapidon OCS: n vaihtaminen ”suositusta” hoitovaihtoehdosta ”muuhun kontrollivaihtoehtoon” vaiheessa 5, joka perustuu haitallisten tulosten suureen riskiin.19
johtopäätös
uusien tietojen perusteella päivitetyissä vuoden 2019 Gina-ohjeissa ei suositella pelkän Saba-inhalaattorin käyttöä lievän astman hoitoon, vaan pieniannoksista ICS-formoterolia suositellaan tarpeen mukaan ja ylläpitohoitona. Potilailla, joilla on vaikea tai vaikeasti hoidettava astma, muita vaihtoehtoja voidaan harkita inhalaattorihoidon lisähoitona, mukaan lukien LTRA, tiotropium, biologiset lääkkeet, atsitromysiini ja OCS. Paremman lääkityksen noudattamisen varmistamiseksi astman hoito-ohjelmien tulisi olla potilaskohtaisia, ja niiden tulisi olla vaiheittaisia, jotta löydettäisiin hoito, joka ohjaa potilaan astmaoireita pitäen potilaan mahdollisimman pienellä annoksella, ja niiden tulisi olla myös kustannustehokkaita.
1. Astma and Allergy Foundation of America. Astma. www.aafa.org/asthma-symptoms. Accessed April 8, 2020.
2. Global Initiative for Asthma. Global strategy for astman management and prevention, 2019. www.ginasthma.org. Accessed April 8, 2020.
3. Santino TA, Chaves GS, Freitas DA, et al. Hengitys harjoituksia aikuisille, joilla on astma. Cochrane Database Syst Rev. 2020; 3(3):CD001277.
4. O’Byrne PM, FitzGerald JM, Bateman ED, et al. Inhaloitu yhdistetty budesonidi-formoteroli tarpeen lievässä astmassa. N Engl J Med. 2018;378(20):1865-1876.
5. Bateman ED, Reddel HK, O ’ Byrne PM, et al. Tarvittava budesonidi-formoteroli vs. ylläpitobudesonidi lievässä astmassa. N Engl J Med. 2018;378(20):1877-1887.
6. Symbicort (budesonidi-formoteroli) – pakkausseloste. Wilmington, DE: AstraZeneca Pharmaceuticals LP; tammikuu 2017.
7. Reed CE. Astma vanhuksilla: diagnoosi ja hoito. J Allergia Clin Immunol. 2010;126(4):681-687.
8. ProAir HFA (albuterol) pakkausseloste. Frazer, PA: Teva Respiratory, LLC; helmikuu 2019.
9. Flovent HFA (fluticasone) pakkausseloste. Research Triangle Park, NC: GlaxoSmithKline; tammikuu 2019.
10. Singulair (montelukasti) pakkausseloste. Whitehouse Station, NJ: Merck & Co, Inc; Huhtikuu 2020.
11. Waljee AK, Rogers MA, Lin P, et al. Oraalisten kortikosteroidien lyhytaikainen käyttö ja siihen liittyvät haitat aikuisten keskuudessa Yhdysvalloissa: populaatiopohjainen kohorttitutkimus. BMJ. 2017;357:j1415.
12. Foster JM, McDonald VM, M Guo, Reddel HK. ”Olen menettänyt elämäni kaikilla osa-alueilla”: vaikean astman kätketty taakka. EUR Respir J. 2017;50(3):1700765.
13. Rayos (prednisoni) pakkausseloste. Deerfield, IL: Horizon Pharma, Inc; 2012.
14. Spiriva HandiHaler (tiotropium) pakkausseloste. Ridgefield, CT: Boehringer Ingelheim Pharmaceuticals, Inc; Helmikuu 2018.
15. Spiriva Respimat (tiotropium) pakkausseloste. Ridgefield, CT: Boehringer Ingelheim Pharmaceuticals, Inc; maaliskuu 2019.
16. Xolair (omalitsumabi) pakkausseloste. South San Francisco, CA: Genentech, Inc; toukokuu 2019.
17. Gibson PG, Yang IA, Upham JW, et al. Atsitromysiinin vaikutus astman pahenemisvaiheisiin ja elämänlaatuun aikuisilla, joilla on jatkuvaa, hallitsematonta astmaa (AMAZES): satunnaistettu, lumekontrolloitu kaksoissokkotutkimus. Lancet. 2017;390(10095):659-668.
18. O’Byrne PM, Barnes PJ, Rodriguez-Roisin R, et al. Pieni annos inhaloitua budesonidia ja formoterolia lievässä jatkuvassa astmassa: OPTIMA-satunnaistettu tutkimus. Am J Respir Crit Care Med. 2001;164(8):1392-1397.
19. Castro M, Corren J, Pavord ID, et al. Dupilumabin teho ja turvallisuus keskivaikean tai vaikean hoitamattoman astman hoidossa. N Engl J Med. 2018;378(26):2486-2496.
20. Wenzel S, Castro M, Corren J, et al. Dupilumabin teho ja turvallisuus aikuisilla, joilla on hallitsematon jatkuva astma huolimatta keskipitkän tai suuren annoksen inhaloitavien kortikosteroidien ja pitkävaikutteisen beeta2-agonistin käytöstä: satunnaistettu lumekontrolloitu kaksoissokkotutkimus, jossa käytettiin faasin 2b keskeistä annosta. Lancet. 2016;388(10039):31-44.
tämän artikkelin sisältö on tarkoitettu vain tiedoksi. Sisällön ei ole tarkoitus korvata ammattineuvontaa. Tässä artikkelissa annettuihin tietoihin turvautuminen on yksinomaan omalla vastuullasi.
Leave a Reply