Différence Entre les liaisons Simples Doubles et Triples
Différence Principale – Liaisons Simples vs Doubles vs Triples
Les liaisons chimiques maintiennent les atomes d’une molécule ensemble en établissant des forces entre les électrons et les noyaux de deux atomes. Les réactions chimiques sont régies par l’établissement ou la rupture des liaisons chimiques. Il existe différents types de liaisons telles que covalentes, ioniques, de van der Waal, etc. Les propriétés des liaisons varient en fonction de divers aspects tels que la nature de la molécule, le type solide (cristallin ou amorphe) etc. Les liaisons covalentes sont formées en partageant deux électrons ou plus. Le nombre d’électrons partagés entre les atomes détermine le nombre de liaisons; qu’il soit simple, double ou triple. Par conséquent, les liaisons simples, doubles et triples sont des liaisons covalentes. La principale différence entre la double liaison simple et la triple liaison est le nombre d’électrons partagés. Si le nombre partagé est une paire d’électrons, la liaison sera une liaison unique, alors que si deux atomes sont liés par deux paires (quatre électrons), elle formera une double liaison. Les liaisons triples sont formées en partageant trois paires (six atomes) d’électrons. Ces électrons de partage sont communément appelés électrons de valence. Cet article se penchera sur,
1. Qu’est-ce qu’un Lien unique?
– Définition, Propriétés, Exemples
2. Qu’est-ce qu’un Double Lien ?
– Définition, Propriétés, Exemples
3. Qu’est-ce qu’une Triple Obligation?
– Définition, Propriétés, Exemples
4. Quelle est la différence entre les obligations Simples Doubles et Triples?
Qu’est-ce qu’une Liaison simple
Une liaison simple est formée par le partage d’une paire d’électrons de valence entre deux atomes adjacents. Une liaison simple est la forme la plus simple d’une liaison covalente, où chaque atome fournit un électron de valence. Ces électrons de valence sont situés dans l’enveloppe la plus externe des atomes. Ici, les électrons partagés chargés négativement sont attirés par les noyaux chargés positivement des atomes. Ces forces de traction maintiennent les atomes ensemble. Cet arrangement est connu sous le nom de liaison unique. Les molécules à liaisons simples sont moins réactives contrairement aux molécules à liaisons multiples. De plus, ils sont plus faibles que les liaisons multiples et ont des longueurs de liaisons plus élevées en raison de la faible force de traction entre les atomes par rapport aux liaisons multiples. Une liaison unique est désignée par un seul tiret; ex: C C. Les alcanes tels que le méthane, l’éthane, le propane sont quelques exemples de composés à liaisons simples.
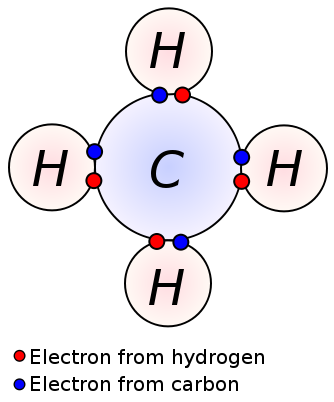
Méthane
Qu’est-ce qu’une Double liaison
Une double liaison est formée en partageant deux paires d’électrons de valence situés sur l’orbite la plus externe des atomes. Les composés à doubles liaisons sont très réactifs que les composés à liaison simple, mais moins réactifs que les composés à triple liaison. Les doubles liaisons sont notées par deux tirets parallèles ; ex : C = C. Quelques exemples de composés à doubles liaisons comprennent les alcènes tels que l’éthylène, le propène, les composés carbonylés (C = O), les composés azoïques (N = N), les imines (C = N) et les sulfoxydes (S = O).
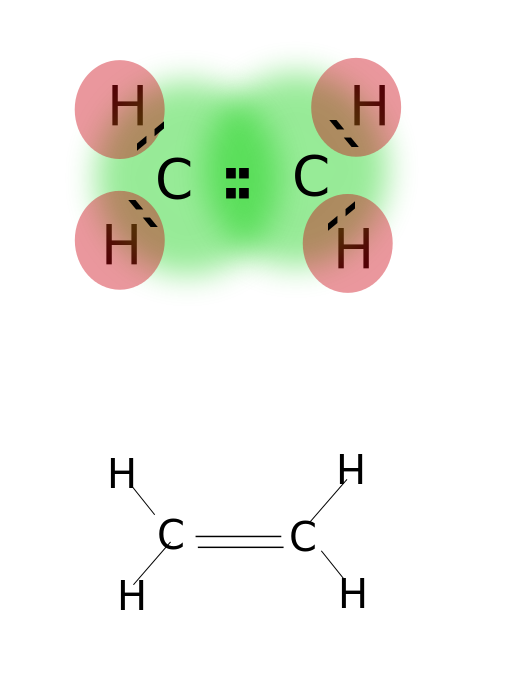
Éthylène
Qu’est-ce qu’une Triple liaison
Lorsque deux atomes partagent trois paires d’électrons de valence (six électrons de valence), les liaisons établies sont appelées liaisons triples. Les liaisons triples sont les liaisons covalentes les plus fortes et les plus réactives. Par rapport aux liaisons simples et doubles, les liaisons triples ont la longueur de liaison la plus faible en raison de la force de traction plus élevée entre deux atomes. Une triple liaison est désignée par trois tirets parallèles entre deux atomes ; ex : C-C. Quelques exemples de composés à triple liaison incluent l’azote gazeux (N-N), l’ion cyanure (C-N), l’acétylène (CH-CH) et le monoxyde de carbone (C-O).
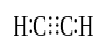
Acétylène
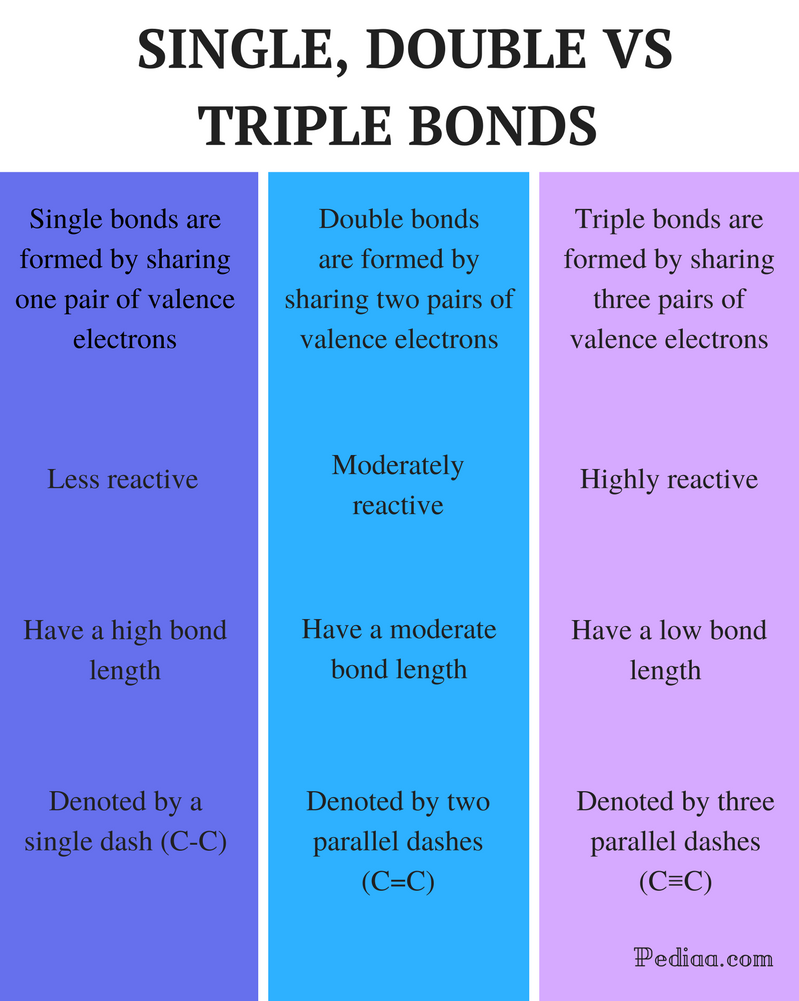
Différence Entre Les Liaisons Simples Doubles et Triples
Définition:
Liaison Simple: Une liaison unique est formée en partageant une paire d’électrons de valence.
Double liaison : Une double liaison est formée en partageant deux paires d’électrons de valence.
Triple liaison : Une triple liaison est formée en partageant trois paires d’électrons de valence.
Réactivité :
Liaison simple : Les liaisons simples sont moins réactives.
Double liaison : Les doubles liaisons sont modérément réactives.
Triple Liaison : Les liaisons triples sont très réactives.
Longueur de liaison:
Liaison simple: Les liaisons simples ont une longueur de liaison élevée.
Liaison double: Les liaisons doubles ont une longueur de liaison modérée.
Triple liaison: Les liaisons triples ont une faible force de liaison.
Désigné par :
Liaison simple : Les liaisons simples sont désignées par un seul tiret (C-C).
Double Liaison : Les doubles liaisons sont désignées par deux tirets parallèles (C = C).
Liaison triple : Les liaisons triples sont désignées par trois tirets parallèles (C≡C).
Exemples:
Liaison simple: Les exemples incluent les alcanes tels que le méthane, l’éthane, le propane, le butane, etc.
Double liaison : Les exemples incluent l’éthylène, le propène, les composés carbonylés (C=O), les composés azoïques (N= N), les imines (C = N) et les sulfoxydes (S=O).
Triple liaison: Les exemples incluent l’azote gazeux (N≡N), l’ion cyanure (C≡N), l’acétylène (CH≡CH) et le monoxyde de carbone (C≡O).
![]()
Leave a Reply