Nouvelles – Leucémie congénitale après un abus important de pulvérisation de perméthrine pendant la grossesse

RAPPORT DE CAS
Leucémie congénitale après un abus important de pulvérisation de perméthrine pendant la grossesse
A Borkhardt, M Wilda, U Fuchs, L Gortner et I Reiss
Hôpital universitaire pour enfants de Giessen, Feulgenstr 12, 35392 Giessen, Allemagne
Correspondance à:
Dr Borkhardt, Hématologie et oncologie pédiatriques, Feulgenstr 12, 35392 Giessen, Allemagne;
arndt.borkhardt {à} paediat.med.uni-giessen.de
Accepté le 6 octobre 2002
RÉSUMÉ
Un seul cas de leucémie congénitale avec réarrangement 11q23/MLL est décrit chez un nouveau-né prématuré. En raison de l’arachnophobie, la mère avait fortement abusé de la perméthrine aérosolisée, un insecticide domestique largement utilisé. La perméthrine est considérée comme relativement sûre, mais, compte tenu des antécédents de la mère, son potentiel à induire le clivage du gène MLL en culture cellulaire a été testé. L’incubation de la lignée cellulaire BV173 avec de la perméthrine de 50 µM induit facilement un clivage MLL.
Mots clés: leucémie congénitale; leucémie; perméthrine; la leucémie congénitale est une maladie rare qui touche environ un enfant sur 200 000 à 250 000 naissances vivantes par an. Malgré sa rareté, la leucémie congénitale a suscité beaucoup d’intérêt en raison de l’opportunité d’en apprendre davantage sur les causes sous-jacentes de la leucémogenèse in utero. De nombreux facteurs de risque peuvent augmenter le risque d’induction précoce d’un phénotype leucémique — par exemple, l’exposition des parents à des toxines professionnelles et environnementales, la consommation de tabac, de marijuana, d’alcool et d’autres toxines.1 Les leucémies congénitales et infantiles sont souvent associées à des réarrangements du gène MLL au chromosome 11q23.2 Plusieurs substances ont été examinées pour leur potentiel à franchir la barrière placentaire et à induire une telle rupture chromosomique au 11q23/MLL.3,4
Nous étendons ici la liste des médicaments capables de cliver le gène MLL, du moins lorsque des cellules sont exposées en culture. Avec une histoire de cas plutôt inhabituelle, nos données expérimentales éclairent la génération de leucémies congénitales et peuvent aider à prévenir certains des cas mortels de cette maladie.
RAPPORT DE CAS
Une femme en bonne santé de 27 ans a été admise au service de gynécologie en raison d’un accouchement prématuré. Elle était à la 35e semaine de sa première grossesse. Les examens prénataux avaient été normaux. Comme le cardiotocogramme ne montrait aucun rythme cardiaque fœtal, une césarienne d’urgence était prévue. Cependant, six minutes plus tard, la femme a spontanément donné naissance à un prématuré pesant 2300 g et ne présentant aucun signe vital mais une couleur livide frappante de la peau. La réanimation cardiopulmonaire primaire a commencé immédiatement avec une intubation endotrachéale, une compression thoracique et une administration répétitive d’adrénaline. Cependant, le score d’Apgar est resté 0 après cinq et 10 minutes. L’équipe d’urgence pédiatrique est arrivée 10 minutes plus tard et a continué à effectuer une réanimation cardiopulmonaire. Une ligne centrale a été obtenue par cathétérisme de la veine ombilicale. À 25 minutes après l’accouchement, une circulation stable a été établie, avec une fréquence cardiaque de 140 battements / min. Un examen physique a montré une hépatomégalie de 5 cm en dessous de la marge costale et des infiltrations nodulaires livides de la peau (figure 1A ci-dessous).
|
|
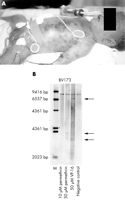
Figure 1 (A) Le patient à l’âge de 2 heures. Notez l’infiltration cutanée leucémique (« taches de myrtille »). (B) Southern blot montrant un réarrangement MLL dans la lignée cellulaire BV173 incubée avec de la perméthrine de 50 µM pendant six heures. Le clivage MLL induit par VP16 a été utilisé comme témoin. |
Outre l’anatomie normale du cœur, l’échographie a montré une hypertension pulmonaire importante associée à une insuffisance du deuxième au troisième degré de la valve tricuspide. Outre l’hépatomégalie, une hémorragie intracrânienne bilatérale a été trouvée. Pour une oxygénation et une élimination suffisantes du dioxyde de carbone, une ventilation à haute fréquence était nécessaire avec 10 Hz, FIO2 = 1 et une pression moyenne des voies respiratoires de 13 cm H2O. Le nombre initial de globules blancs était de 400 000 / µl avec un excès de cellules blastiques myéloïdes. L’examen de la moelle osseuse a confirmé le diagnostic d’une leucémie myéloïde aiguë congénitale, avec 95% de cellules blastiques de morphologie myélomonocytaire (FAB-M5). Un échange sanguin complet a été effectué, ce qui a réduit le nombre de globules blancs à 56 000 / µl et a entraîné une amélioration de l’oxygénation et de la ventilation. Douze heures plus tard, le nombre de globules blancs avait de nouveau augmenté, pour atteindre 125 000/µl. L’oxygénation de la membrane extracorporelle a été envisagée mais finalement rejetée en raison de l’hémorragie intracrânienne progressive impliquant une grande partie du parenchyme. Le nourrisson est décédé 48 heures après la naissance d’une défaillance multiorganique. Outre les graves lésions cérébrales déjà diagnostiquées par échographie, l’autopsie a montré une infiltration diffuse des poumons, du foie, de la rate et des cuti.
EXPÉRIENCES DE CULTURE CELLULAIRE: INDUCTION DE RÉARRANGEMENTS MLL PAR LA PERMÉTHRINE
L’essai expérimental a été effectué exactement comme décrit par Strick et al.3, qui ont analysé un large éventail de substances naturelles dans les aliments et les compléments alimentaires pour leur capacité à induire un clivage spécifique au site au sein du gène MLL.
LES RÉSULTATS ET LA DISCUSSION
L’analyse cytogénétique de l’aspirat de moelle osseuse a montré la présence d’une translocation t(11;19) (q23;p13) dans toutes les métaphases analysées. De plus, nous avons montré un réarrangement de l’oncogène MLL au chromosome 11q23 par Southern blot. L’immunophénotypage de routine a montré l’expression de CD15, CD33, CD 65 et MPO (données non présentées). Dans des études antérieures, l’anticorps monoclonal 7.1 est apparu comme un outil immunophénotypique précieux pour la détection des cellules leucémiques, avec une expression de l’antigène NG2 qui est fortement corrélée aux réarrangements de la MLL chez les nourrissons.5,6 Dans notre cas, cependant, la coloration avec cet anticorps monoclonal est restée négative, ce qui nous a empêché de mener d’autres expériences de tri cellulaire.
La mère souffrait apparemment d’arachnophobie depuis la petite enfance. Deux ans avant sa grossesse, elle a commencé à surutiliser de la perméthrine aérosolisée. Depuis, elle vivait seule. Les gens évitaient de lui rendre visite à cause de l’odeur pénétrante dans sa maison. La perméthrine est un insecticide domestique largement utilisé qui protège contre les anophèles vecteurs du paludisme.7,8 Il est également connu pour être un médicament efficace contre la gale et la capite pédiculose du pou de tête.9,10 Comparé à d’autres médicaments, il est considéré comme sûr et son utilisation topique est recommandée même pour les nouveau-nés atteints de gale.11 Cependant, il a été lié à la génération d’aberrations chromosomiques dans les cellules de la moelle osseuse de souris et de lésions de l’ADN dans les lymphocytes humains.12-14 Nous avons donc émis l’hypothèse que la perméthrine traversait le placenta de la femme enceinte et affectait les cellules précurseurs hématopoïétiques du fœtus en développement, entraînant une leucémogenèse. Nous avons donc essayé de générer les réarrangements au sein de l’oncogène MLL in vitro en exposant des cellules BV173 à de la perméthrine de 50 µM. Après 24 heures d’exposition, les cellules BV173 traitées à la perméthrine ont montré un réarrangement clair de la MLL, alors que les cellules non traitées ont montré le gène MLL de type sauvage uniquement (figure 1B ci-dessus). Par conséquent, nous recommandons fortement une grande prudence dans l’utilisation de la perméthrine pendant la grossesse. Même si des conclusions définitives ne peuvent être tirées d’un seul cas isolé, nos données suggèrent fortement que la perméthrine peut avoir des effets secondaires graves lorsque des cellules précurseurs hématopoïétiques fœtales sont exposées in utero. Dans le même ordre d’idées, un rapport récent d’une collaboration multinationale a indiqué que l’utilisation de médicaments mosquitocides pendant la grossesse est significativement associée à la leucémie infantile.4 Il est particulièrement intéressant de noter que les auteurs ont constaté cette association uniquement pour les cas réarrangés MLL et non pour les cas de lignée germinale MLL. Cela soutient fortement le biais de sélection dans leur étude cas-témoins et soutient l’hypothèse selon laquelle l’exposition in utero provoque les réarrangements de la MLL.
Enfin, la mère dans notre cas a été traitée avec succès pour arachnophobie par psychothérapie. Deux ans plus tard, elle a donné naissance à un garçon né à terme en bonne santé qui n’avait aucun signe clinique de leucémie et qui est toujours en bonne santé à l’âge de 13 mois.
REMERCIEMENTS
L’assistance technique experte de Claudia Keller et Stefanie Garkisch est très reconnaissante. Nous remercions Jochen Harbott, Giessen, Allemagne, de nous avoir fourni les données cytogénétiques. Les données immunophénotypiques ont été gracieusement fournies par W-D Ludwig, Centre de cancérologie Robert Rössle, Université Humboldt, Berlin, Allemagne. Les études moléculaires ont été soutenues par la Fondation allemande contre le cancer (subvention 10-1658-Bo2).
- Sande JE, Arceci RJ, Lampkin BC. Leucémie congénitale et néonatale. Semin Perinatol 1999; 23:274-85.
- Ford AM, Ridge SA, Cabrera ME, et al. réarrangements In utero dans l’oncogène lié au trithorax dans les leucémies infantiles. Nature 1993; 363:358–60.
- Strick R, Strissel PL, Borgers S, et al. Les bioflavonoïdes alimentaires induisent un clivage du gène MLL et peuvent contribuer à la leucémie infantile. Proc Natl Acad Sci USA 2000; 97:4790-5.
- Alexander FE, Patheal SL, Biondi A, et al. Exposition chimique transplacentaire et risque de leucémie infantile avec fusion du gène MLL. Cancer Res 2001; 61:2542-6.
- Smith FO, Rauch C, Williams DE, et al. L’homologue humain du NG2 de rat, un protéoglycane au sulfate de chondroïtine, n’est pas exprimé à la surface cellulaire des cellules hématopoïétiques normales, mais est exprimé par des blastes de leucémie myéloïde aiguë de patients de mauvais pronostic présentant des anomalies de la bande chromosomique 11q23. Blood 1996; 87:1123-33.
- Behm FG, Smith FO, Raimondi SC, et al. L’homologue humain du protéoglycane du sulfate de chondroïtine de rat, NG2, détecté par l’anticorps monoclonal 7.1, identifie les leucémies lymphoblastiques aiguës infantiles avec réarrangements des gènes t(4; 11) (q21; q23) ou t(11; 19) (q23; p13) et MLL. Blood 1996; 87:1134-9.
- Rowland M, Durrani N, Hewitt S, et al. Chaddars et feuilles supérieures traités à la perméthrine: technologie appropriée pour la protection contre le paludisme en Afghanistan et dans d’autres situations d’urgence complexes. Trans R Soc Trop Med Hyg 1999; 93:465-72.
- Binka FN, Mensah OA, Mills A. The cost-effectiveness of permethrin impregnated bednets in preventing child mortality in Kassena-Nankana district of Northern Ghana. Health Policy 1997; 41:229-39.
- Blanshard ME, Schofield J. Scabies: une approche pratique. Prof Care Mère Enfant 1999; 9:15-16.
- Dodd CS. Interventions pour le traitement des têtes. Base de données Cochrane Syst Rev 2000; CD001165.
- Quarterman MJ, Lesher JL, Jr. Gale néonatale traitée avec de la crème à 5% de perméthrine. Pediatr Dermatol 1994; 11:264-6.
- Cantalamessa F. Toxicité aiguë de deux pyréthroïdes, la perméthrine et la cyperméthrine chez les rats néonatals et adultes. Arch Toxicol 1993; 67:510-13.
- Barrueco C, Herrera A, Caballo C, et al. Induction of structural chromosome aberrations in human lymphocyte cultures and CHO cells by permethrin. Teratog Carcinog Mutagen 1994; 14:31-8.
- Santoni G, Cantalamessa F, Spreghini E, et al. Altérations de la distribution et des fonctions des lymphocytes T chez les rats exposés à la cyperméthrine avant la naissance: implication possible des catécholamines. Toxicology 1999; 138:175-87.
Leave a Reply