7.2: kimotripszin
Bevezetés
kimotripszin az egyik leginkább vizsgált enzim két fáziskinetikája miatt: pre-steady-state és steady state állapot. E két kinetikus állapot vizsgálata bizonyítja a” Ping-Pong ” mechanizmust, a kovalens komplexek kialakulását, amelyek kovalens hidrolízis reakciókhoz vezetnek, valamint a katalizált reakciók sebességét. A kimotripszin szintézise elsősorban a hasnyálmirigyben fordul elő. Az aktív forma helyett azonban inaktív zimogénként állítják elő, amelyet kimotripszinogénnek neveznek, hogy megakadályozzák proteázaktivitásának a hasnyálmirigy emésztését. A vékonybél lumenébe történő szekréció után egy másik tripszin nevű enzim átalakítja aktív formájává. Ez a függőség egy másik enzim aktiválására proteáz egy közös módja a szervezet számára, hogy megakadályozzák az emésztést a szervek, valamint egyéb káros enzimatikus mellékhatások.
a kimotripszin egy általános mechanizmuson keresztül működik, amelyet ping-pong mechanizmusnak neveznek (\ábra (\PageIndex{1}\)), amelynek során az enzim reakcióba lép egy szubsztráttal, hogy enzim közbenső legyen. Ez a köztes különböző tulajdonságokkal rendelkezik, mint a kezdeti enzim, így a kezdeti enzimatikus aktivitás regenerálásához másodlagos szubsztráttal kell reagálnia. Ezt a folyamatot az alábbiakban szemléltetjük:

pontosabban, a kimotripszin egy bizonyos típusú ping-pong mechanizmuson keresztül működik, amelyet kovalens hidrolízisnek neveznek. Ez azt jelenti, hogy az enzim először kovalens kötést képez a cél szubsztráttal, kiszorítva a stabilabb részt oldatba. Ezt az enzim-szubsztrát komplexet intermedier enzimnek nevezik. A köztes ezután vízzel reagál, ami kiszorítja a kezdeti szubsztrát fennmaradó részét, és átalakítja a kezdeti enzimet.
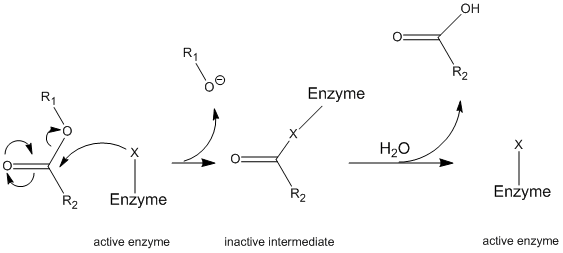
a kimotripszin, mint a legtöbb enzim, specifikus a szubsztrátok típusaiban, amelyekkel reagál. Proteázként a polipeptideket hasítja, és a benne rejlő specificitás lehetővé teszi, hogy csak az aromás maradványok karboxi-terminálisán járjon el. Ez egy kissé bonyolult mechanizmus, amelyet a legjobban egy sor lépésben lehet megmagyarázni.
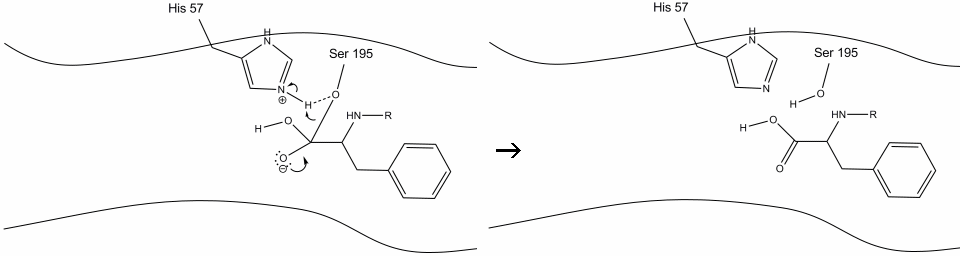
1. A cél belép a kimotripszin aktív helyére, és ott hidrofób kölcsönhatások tartják az enzimmaradványok kitett nem poláris csoportjai és a szubsztrát nem poláris aromás oldallánca között. Fontos megjegyezni, hogy a hisztidin-57 Schiff-nitrogénje és a szerin-195 oxigén oldallánca között hidrogénkötés van.
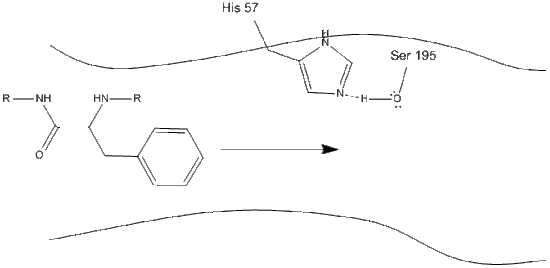
2. A hisztidin-szerin-hidrogén kötés segítségével a szerin-195 hidroxilcsoport nukleofil támadást hajt végre egy aromás aminosav karbonil-szénje ellen, miközben a hidroxil-hidrogént egyidejűleg a hisztidin-Schiff nitrogénre továbbítja. Ez a támadás a PI-karbonil elektronokat a karbonil-oxigénre tolja, rövid életű köztiterméket képezve, amely egy C-terminális szénből áll, négy egyetlen kötéssel: egy oxigén anion, az aromás aminosav béta-szénje, a szubsztrát fehérje későbbi aminosavának n-terminusa, valamint a szerin-195 oldalláncú oxigén.
.gif?revision=1&size=bestfit&width=720&height=192)
3. Ez a köztes rövid életű, mivel az oxianion elektronok megreformálják a PI kötést az aromás aminosav c-terminusával. A kötelék a karboxi-terminális az aromás aminosav, valamint az n-terminális, a későbbi maradék hasított, valamint az elektronok használt kivonat a hidrogén a protonated Schiff nitrogén a hisztidin-57. A karbonil-szén és a szerin-195 oxigén közötti kötések észter-konfigurációban maradnak. Ezt az acil-enzim köztiterméknek nevezik. A polipeptid C-terminális oldala most szabadon disszociál az enzim aktív helyétől.
4. A vízmolekulák a víz hidrogénatomjai és a hisztidin-57 Schiff nitrogén közötti hidrogénkötés révén képesek az aktív helyre belépni és kötődni.
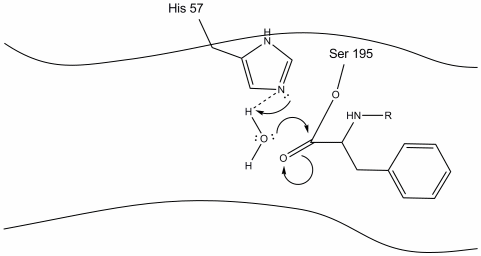
5. A víz oxigén most tesz egy nukleofil támadás a karbonil-szén az acil-enzim közbenső, nyomja a karbonil pi elektronok rá a karbonil-szén, mint hisztidin – 57 kivonatok egy proton a vízből. Ez egy másik kvaterner szén kovalens kötésű szerin, egy hidroxil, egy oxianion, és az aromás aminosav. A proton a nemrég protonált hisztidin-57-en most képes hidrogénkötést kötni a szerin oxigénnel.
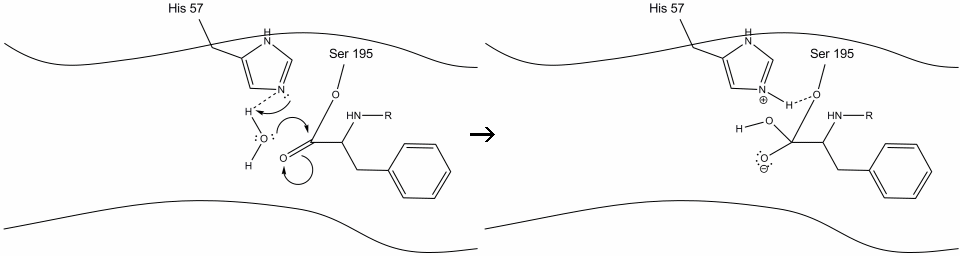
6. Az oxianion elektronok megreformálják a karbonil-pi kötést, hasítva a karbonil-szén és a szerin-hidroxil közötti kötést. A kötésben lévő elektronokat a szerin oxigén használja a hisztidin-Schiff nitrogén deprotonálására és az eredeti enzim reformjára. A szubsztrátnak már nincs affinitása az aktív helyre, és hamarosan elválik a komplextől.
Leave a Reply