A vírus Lappangási: Le, de nem
Amikor tudod képzelni, vírusok elől az immunrendszert, talán azt hiszed, a herpes simplex vírus felelős, herpesz, illetve a nemi szervi herpesz, vagy a varicella-zoster vírus, amelynek hatására a zsindely. Ezek a vírusok évtizedeken át hibernált állapotban, úgynevezett latenciában is fennmaradhatnak, és elkerülhetik az immunrendszerünk általi észlelést (Kennedy et al., 2015). A látens vírusok néha újra felébredhetnek és elkezdhetnek szaporodni, tüneteket okozva és fertőzést terjesztve (Lieberman, 2016).
a humán immundeficiencia vírus (HIV) hasonlóan mester menekülési művész. A fertőzés korai szakaszában látens tározót képez, amely lehetővé teszi a vírus számára az immunrendszer elkerülését és a hosszú távú túlélést. A HIV-vel élő emberek napi kombinált antiretrovirális terápiának (vagy ART) nevezett gyógyszereket szednek, hogy megakadályozzák a vírus replikációját. Az ART azonban nem gyógyítás, mivel nem célozza meg a már látens vírusokat. Ezeket a gyógyszereket ezért az egyén élettartamára adják: a kezelés leállítása, akár néhány hétig is, lehetővé teszi a látens vírusok újbóli aktiválását és az aktív fertőzés újraindítását. A HIV-fertőzöttek hosszú, egészséges életet várhatnak a művészet miatt, de a látens vírusok mindig jelen lesznek a testükben.
a HIV gyógymódjának megtalálása megköveteli a látens vírustartály megszüntetését vagy szabályozását. E cél elérése érdekében azonban néhány kulcsfontosságú kérdést még meg kell oldani. Hogyan, mikor és hol állapítja meg a HIV a latenciát? Mi a látens tározó mérete, és a legjobb módja annak mérésére? Mi váltja ki a látens vírusokat újraaktiválni? Most, Elife, Miles Davenport, Brandon Keele és kollégái a University of New South Wales és a Frederick National Laboratory for Cancer Research-beleértve Mykola Pinkevych mint első szerző-jelentés, amikor a látens tározó jön létre egy nem emberi főemlős modell HIV és mennyi a tározó lehet újra (Pinkevych et al., 2019).
ebben a vizsgálatban a csoport a rhesus makákókat simian immundeficiencia vírussal (SIV) fertőzte meg, amely prekurzor vírus afrikai majmokban endemikus, és genetikailag hasonló a HIV-hez (Williams and Burdo, 2009). Egy bizonyos ponton a 20. század folyamán, SIV ugrott a nem emberi főemlősök emberre; ez a fajok közötti átviteli esemény, párosulva a gyors evolúció, lehetővé tette a vírus, hogy hatékonyan terjed az emberekben, és hogy megteremtse a folyamatban lévő HIV-járvány (Keele et al., 2006).
Pinkevych et al. kezdődött azzal, hogy megfertőzze a rhesus makákók egy mesterséges SIV, amely több, mint 10.000 egyedi randomizált a DNS-szekvenciák; egyszer szekvenált, ezek a vonalkódok’ lehetővé teszik az egyes vírusok azonosítását (Fennessey et al., 2017). A majmokat ezután 4, 10 vagy 27 nappal a fertőzés után antiretrovirális terápiával kezelték. Ezek az intervallumok szimulálják az akut (4 nap), korai (10 nap) vagy késői beavatkozást (27 nap) az ART-val emberekben. A gyógyszereket körülbelül egy évig adták, a vírust pedig minden állatban teljesen elnyomták. A kezelést ezután leállították, és a látens vírus újra aktiválódhat. Genetikai szekvenálás és matematikai modellezés segítségével a csapat meghatározta a siv látens tározójának méretét és azt, hogy hogyan fog újra aktiválódni.
majmoknál a fertőzés után négy nappal megkezdett kezelés nem gátolta a látens tartály kialakulását, hanem körülbelül 100-szor csökkentette annak méretét a későbbi ART-kezelés megkezdéséhez képest. Hasonlóképpen, azok az emberek, akik a HIV megszerzését követő napokban kezdik el az ART-t, rendkívül kicsi tározóval rendelkeznek, mint azok, akik később kezdik el a kezelést (Luzuriaga et al., 2015; Henrich et al., 2017). Annak ellenére, hogy ezek a nagy különbségek a teljes tartály mérete, miután ART megállt a látens vírusok reaktivált hasonló sebességgel akut, korai, és későn kezelt állatok (1.ábra). Pinkevych et al. ezért arra a következtetésre jut, hogy a vírusok többsége, amelyek képesek újraaktiválni, a fertőzés után korai késleltetést állapít meg.
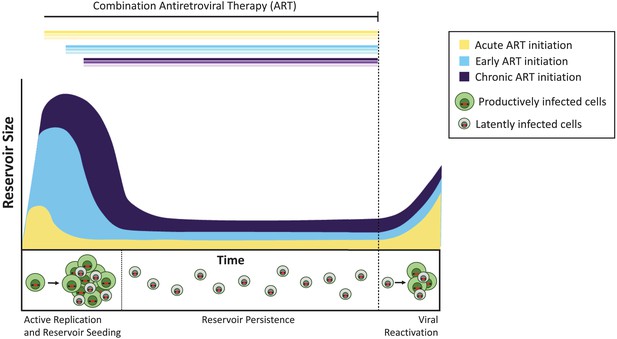
az antiretrovirális terápia időzítése befolyásolja a látens tartály méretét.
kezelés nélkül az aktívan replikáló vírussal fertőzött sejtek (produktív módon fertőzött sejtek; zölden látható) fertőző vírusokat hoznak létre. A fertőzött sejtek egy része olyan vírusokat tartalmaz, amelyek látens tározóként (latently infected cells; in gray) tartósan fennmaradhatnak,és ezek a vírusok egy későbbi időpontban újra aktiválhatók. A fertőzés akut fázisában (azaz az elsődleges fertőzéstől számított napokban vagy hetekben; sárga görbe) alkalmazott kezelés kisebb látens tartályt eredményez, mint a kezelés korai megkezdésekor (a fertőzéstől számított hat hónapon belül, világoskék) vagy krónikus fertőzés esetén (a fertőzés óta több mint 6 hónap, ibolya). Ha a kezelést leállítják (szaggatott vonal), a vírus hasonló szinteken reaktiválódik ezekből a tározókból, hogy újra felélessze az aktív fertőzést, és újra magolja a látens tartályt.
annak feltárása érdekében, hogy a kezelés időzítése miért nem befolyásolta az újraaktiválás sebességét, a csapat megmérte a látens vírusok genetikai mutációinak szintjét. Ha a vírusok több káros mutációt halmoznak fel, minél hosszabb ideig aktívan szaporodnak a szervezetben, ez arra utal, hogy a késleltetett ART-t kapó állatok nagyobb arányban hordozhatják a látens vírusokat, amelyek hibásak, és nem tudnak újra feléledni. A csapat azonban úgy találta, hogy a vírusok többsége (több mint 80%) genetikailag érintetlen volt minden állatban, függetlenül attól, hogy mikor kezdődött a kezelés. Ez egészen más, mint mi történik a HIV-fertőzés emberben, ahol a legtöbb látens vírusok tartalmaznak jelentős genetikai mutációk és törlések, így csak egy kis töredéke (2% és 11%), amelyek képesek reaktiválás (Ho et al., 2013; Bruner et al., 2019).
egy nemrégiben készült tanulmány, amely a HIV-tartály dinamikáját értékelte a stabil ART-ban szenvedő embereknél, újabb eltérést azonosított a siv-modell és a HIV-késleltetés között az emberekben. A folyamatos ART ellenére a látens HIV néha spontán újraaktiválódhat, és a vírusok rövid ideig kimutathatóvá válnak a vérben. Emberben, ezek a vírusos “blips” filogenetikailag kapcsolódik egy vírustartály létre nem csak a kezdeti fertőzés, hanem az egész éves kezeletlen fertőzés (Jones et al., 2018). A különbségek mögött meghúzódó okok nem ismertek jól, és a folyamatban lévő kutatások fontos területeit képviselik.
a nem humán főemlős modellek és a humán HIV-fertőzés közötti különbségek ellenére Pinkevych et al. megerősíti, hogy a vírus késleltetése rendkívül korai a fertőzés után. Ezek az eredmények azt mutatják, hogy az antiretrovirális kezelést a lehető leghamarabb el kell kezdeni a HIV-fertőzés visszaszorítása és a látens rezervoár méretének csökkentése érdekében. Sok még nem ismert arról, hogy a HIV-késleltetés hogyan alakul ki és tart fenn, különösen a kezelés alatt; azonban a SIV modellek továbbra is fontos eszköz a látens tartály felszámolásának megértéséhez.
Leave a Reply