Foszfofruktokináz (PFK)
tartalom
- 1 Bevezetés
- 2 szerep a Glikolízisben
- 3 mechanizmus és a Foszfofruktokináz szabályozása
- 4 előírás
- 5 konformációs változás a PFK
- 6 Dimeriális egységében az a a PFK alegysége.
- 7 Site-Directed Mutagenesis
- 8 Disease
- 9 3D structures of PFK
Introduction
Foszfofruktokináz-1 (PFK-1) egy glikolitikus enzim, amely katalizálja a foszforilcsoport átvitelét a hozamra és a hozamra . Lásd A Glikolízis Enzimeket. Az Mg2+ szintén fontos ebben a reakcióban (). A foszfofruktokináz-2 (PFK-2) ugyanazon a szubsztrátumon hat, hogy ADP-t adjon . . A PFK reakció fiziológiás körülmények között erősen exergonikus (irreverzibilis), ezért a glikolitikus út egyik sebességmeghatározó lépése. A legtöbb szervezetben/szövetekben a PFK a glikolitikus út fő fluxusszabályozó enzimje; aktivitását szokatlanul nagy számú metabolit, köztük ATP, ADP, AMP, PEP és fruktóz-2,6-biszfoszfát koncentrációja szabályozza. a
azonos 320 maradék alegységből álló tetramer. Ez egy alloszterikus enzim, amelyet az alloszterizmus szimmetriamodelljével írnak le, amelynek során a nagy aktivitású R állapotból az alacsony aktivitású T állapotába összehangolt átmenet történik. Az enzim R és T állapotának röntgenszerkezeteiről számoltak be. Az F6P szubsztrátjának egy molekulájának kötődése, amely nagy affinitással kötődik az R állapot enzimhez, de az alacsony affinitású T állapot enzimhez, a PFK felveszi az R állapotot, ami viszont növeli az enzim kötési affinitását további F6P-hez (homotróp hatás). Az aktivátorok, mint például az ADP és az AMP kötődnek az úgynevezett alloszterikus helyekhez, az aktív helytől eltérő kötőhelyekhez, ahol szintén megkönnyítik az R állapot kialakulását, és ezáltal aktiválják az enzimet (heterotróp hatás; az ADP, amely a PFK reakció terméke, szintén kötődik az enzim aktív helyén). Hasonlóképpen, az olyan inhibitorok, mint a PEP, kötődnek az alloszterin helyekhez (amelyek a PFK esetében átfedik az aktiváló alloszterin helyet), ahol elősegítik a T állapot kialakulását, ezáltal gátolják az enzimet.
az enzim két aktív helye a magenta aktív hely interfészeivel a cián szubsztrátjaival való interfészen helyezkedik el. Két aktívabb helyszín található a B (zöld) és C (rózsaszín) alegységek interfészén. A D (sárga) alegység közelítése azt mutatja, hogy mind az a (világoskék), mind a D (sárga) alegységek aminosavai hozzájárulnak az F6P kötődéséhez. az alloszterin helyek közül kettő a C és D alegységek interfészén található, kettő pedig a C és D alegységek interfészén. Az a alegység közelítése mindkét alegység hozzájárulását mutatja az ADP kötelezéséhez. Az alábbiakban bemutatjuk a PFK R és T állapota közötti megfelelő változásokat.
az R state PFK atomkoordinátáit a 4pfk-tól szerezték be; a T state PFK-t Philip Evans, a molekuláris biológia MRC laboratóriuma, Cambridge, U. K. szerezte be, de jelenleg 6pfk-ként állnak rendelkezésre.
Szerepet Glikolízis
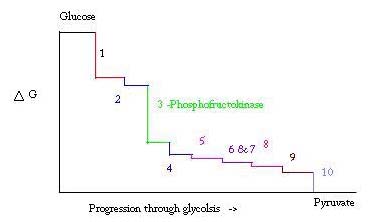
Glikolízis az a folyamat előkészítése, majd összeomlanak, glükóz, hogy pyruvic sav, ami anaerob légzés vagy, mint az egyik a kezdő fehérjék a citromsav-ciklus. A glikolízis folyamatának három pontja nagy negatív szabad energiával fordul elő, ezért visszafordíthatatlan. Ez a három pont hexokináz, foszfofruktokináz és piruvát kináz; e három PFK tekinthető a fő szabályozási pont glikolízis izom egy ΔG = -25,9 kJ / mol.
A Foszfofruktokináz mechanizmusa és szabályozása
a Foszfofruktokináz mind az Mg2+-ATP, mind a fruktóz-6-foszfát (F6P) kötődik a fruktóz-1,6-biszfoszfát és az Mg2+-ADP előállításához. Bár a kép mindkét ilyen termékek még nem határozták meg, kötődik az enzim volt. Alegységenként három ligandum kötőhely van. Kettő alkotja az aktív helyet, amely megköti az F6P-t és az ATP-t, míg a harmadik egy alloszterikus kötőhely. Néhány javasolt maradékanyag az aktív helyszínen található . A PFK két konformációs állapotban létezik, mindkettő egyensúlyban van. Az ATP mindkét konformációban kötődik mind az aktív, mind az alloszterikus helyekhez. Miközben ATP kötődik az aktív oldalon egyformán jól, kedvezményesen kötődik a allosteric helyén a T állami Ezt a kedvezményes kötelező okoz váltás egyensúly a két állam, nagyobb mennyiségű T állam , amely csökkenti a affinitása F6P. szintén kötődik a allosteric oldalon, hogy növelje az arány a R állam phosphofructokinase. Az ADP, az AMP és az F2 mellett a 6P gátolja az ATP szabályozási szerepét. A PFK Km ATP .020mM és .032mM.
A glikolízis a túlélés alapvető metabolikus folyamata. Ezért aktiválásában és elnyomásában erősen szabályozni kell. A glikolízis folyamatának három pontja nagy negatív szabad energiával fordul elő, ezért visszafordíthatatlan. Ez a három pont a hexokináz, a foszfofruktokináz és a piruvát-kináz. Ez a három reakció a szabályozás legfontosabb pontjai a magas negatív szabad energiáik miatt. A három közül a PFK az izom glikolízisének fő szabályozási pontja (#3 az alábbi képen), ΔG= -25,9 kJ/mol, mert elkötelezett lépés. Miután a PFK átalakítja az F6P-t F1,6P-re, a reakció nem lesz könnyen megfordítható a nagy mennyiségű energia miatt, amelyet le kell küzdeni, hogy visszafelé haladjon. . Ennek az energiagátnak van értelme, mivel a piruvát kináz katalizálja a végső reakciót (#10), a hexokináz (#1) pedig egyáltalán nem vesz részt a glikolízisben, amikor a folyamat glikogénből indul.
a PFK-t az ATP, az AMP és az ADP szabályozza. Miközben ATP kötődik az aktív oldalon egyformán jól mindketten R T tagállamok, kedvezményesen kötődik a allosteric helyén a T állami Ezt a kedvezményes kötelező okoz váltás egyensúly a két állam, nagyobb mennyiségű T állam , amely csökkenti a affinitása F6P. Allosteric aktivátor ADP is kötődik a allosteric oldalon, hogy növelje az arány a R állam phosphofructokinase. Amint az az alábbi grafikonból látható, a PFK aktivitásának parcellái sigmoidálisak. Ez tovább mutatja az enzim kooperatív jellegét. A szubsztrát kezdeti kötődése az enzimhez nehéz, de amint megkötik és T -> r állapotváltozásra kényszerítik, a többi szubsztrát sokkal könnyebben kötődik. A grafikon azt is mutatja, hogy az ATP hozzáadása jobbra mozgatja a cselekményt (azaz csökkenti az affinitást az F6P-hez), míg az erősítő hozzáadása balra mozgatja.
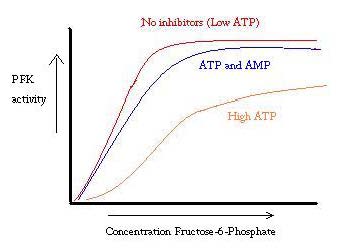
a szabályozási rendszer jól illeszkedik a PFK funkciójához. Amikor a PFK aktív, az ATP-t lefelé állítják elő, mivel a további termékek teljesen le vannak bontva. Így, amikor az ATP szintje alacsony, és többet kell tenni, a PFK aktivitása növekedni fog, mert az ADP nagy koncentrációban lesz. Az ellenkezője is igaz, mivel a magas ATP-koncentráció gátolja a fehérje aktivitását. Ez a magyarázat azonban nem tudja teljes mértékben figyelembe venni a PFK szabályozását, mivel az ATP szintje nem változik eléggé az aktív és a pihenő izmok között. Az alloszterikus szabályozás másik eszközét meg kell találni.
PFK Km ATP is .020mM és .032mM.
Ez a Kinemage gyakorlat két kinemage jelenetből áll, amelyek bemutatják a PFK-ban a Bacillus stearothermophilus által okozott alloszterikusan indukált konformációs változásokat.
konformációs változások a PFK
dimer egységében ez a kinemage a tetramer két alegységét mutatja, amelyek interfésze két aktív helyet tartalmaz. (KineMage jelenleg nem támogatott) az első nézet, 1: PFK dimer, mutatja a két alegység saját R állapot konformáció által képviselt Ca gerinc Subunit 1 rózsaszín árnyalat és alegység 2 Rózsaszín. Az egyes alegységekben két oldallánc látható, a Glu 161 (piros) és az Arg 162 (Cián), amelyek a T és R Államokban az F6P kötőhely részét képezik(lásd alább). Az egyes alegységek aktív helyén egy F6P (hotpink) és egy ADP (zöld; “ADP-active”) található. Egy további ADP (sárga; “ADP-allo”) az egyes alegységek külön úgynevezett alloszterikus helyén van kötve. Az ADP-k mindegyikének van egy kapcsolódó Mg2+, amelyet itt egy ugyanolyan színű golyó képvisel, mint az ADP, amelyhez kötődik.
kattintson az” ANIMATE ” gombra a dimer R és T állapotok közötti váltásához. T állapotában az 1.alegység a bluetint, a 2. alegység pedig a skyblue. Az oldalon láncok Glu 161 Arg 162 mindkét része piros-cián, mint korábban (csak a Ca, Cb atomok a Arg 162 oldalon lánc Alegység 1 figyelhetők meg az X-ray szerkezet a T állam; azok az Alegység 2 összes megfigyelt). A T állapot enzim megköti az inhibitor 2-foszfoglikolátot (arany; “PGC”), a glikolitikus intermedier foszfoenolpiruvát (PEP) nemfiziológiai analógját. Vegye figyelembe, hogy a T állapotban lévő PGC kötőhelye átfedi az ADP alloszterikus kötőhelyét az R állapotban (“ADP-allo”), így azok kötése kölcsönösen kizárja egymást. A T állapotú aktív helyeket, amelyek nem tartalmaznak F6P-t, a “ghost” F6Ps (szürke;”F6P hely”) jelöli, amelyek ugyanolyan pozíciókkal rendelkeznek, mint az F6Ps az R állapot enzimben.
a második nézet, 2: Allo / Act oldalak, az első nézet felső részének nagyítása, amely mind az aktív webhelyet, mind az alloszterikus webhelyet mutatja ebben a régióban. Vegye figyelembe, hogy az aktív hely a két alegység közötti interfészen található, és hogy az alloszterikus hely közvetlenül kölcsönhatásba lép a szomszédos alegység aktív helyével. Hasonlítsa össze az R és T állapot konformációkat úgy, hogy egyszerre jeleníti meg, vagy az “ANIMATE”gombra kattint. Meg tudja határozni az R állapotban lévő enzimhez kötött ADP-k mindegyikéhez kapcsolódó Mg2+ iont? Mely ADP atomok koordinálják ezeket az Mg2 + ionokat?
a PGC foszfátcsoportja a T állapotban lévő alloszterikus helyhez nagyon közel azonos helyzetben kötődik, mint az ” ADP-allo “béta-foszfátcsoportja az R állapot alloszterikus helyéhez; mindkét foszfátcsoport ugyanazon három maradék oldalláncához kötődik (2 arg és 1 Lys; nem látható).
a nagy aktivitású R állam, a pozitív töltésű oldala lánc Arg 162 képezi egy hidrogén-ragasztott só híd a negatív töltésű 6-foszfát csoport F6P (fehér szaggatott vonalak), az interakció, amely feltehetően stabilizálja a R állam képest a T állam, ezért részben felelős F6P van homotropic hatása.
A PFK egyik Alegységében bekövetkezett főbb konformációs változások.
Ez a KINEMAGE azokat a szegmenseket mutatja az alloszterikus hely közelében (az 53-60 maradványok itt nem jelennek meg). Mint KINEMAGE 1, a polipeptid képviseli a Ca lánc R állami Alegységek 1. 2 redtint, rózsaszín, valamint a T állami Alegységek 1. 2 bluetint, majd égszínkék. (KineMage jelenleg nem támogatott)a KINEMAGE 2 az 1 nézetben jelenik meg: az alloszterikus hely, az R állapotban, amely az F6P (hotpink) foszfátcsoportját mutatja az enzim aktív helyén, hidrogénkötésű sóhídban (szaggatott fehér vonalak), az Arg 162 (Cián) oldalláncával. Az ADP (sárga; “ADP-allo”) a szomszédos alloszterikus helyet foglalja el. Kattintson egyszer az “ANIMATE” gombra a T állapotra való váltáshoz. Ez helyettesíti az ADP-t az R állapot alloszterikus helyén az inhibitorral és a PEP analóg PGC-vel (arany). Az F6P már nem foglalja el az aktív helyet, de az R állapotban lévő pozícióját a “ghost” F6P jelzi (Szürke; az “F6P webhelyre”kattintva megtekinthető).
mi történik a központi polipeptid spirális szegmensével (149-164 maradványok) az R-T átmenet során? Mit tesz ez a negatív töltésű Glu 161 és a pozitív töltésű Arg 162 viszonylagos helyzetével? Kattintson az “F6P webhelyre”. Milyen hatással lenne az Arg 162 pozitív töltésének hiánya az F6P kötésére? Ez legalább részben megmagyarázza, hogy a T state PFK miért rendelkezik alacsony affinitással az F6P iránt? Ugrás a Nézet 2: Closeup, egy Vértes az F6P-sidechain kölcsönhatások. Központosítsa a molekulákat a ” pickcenter “kiválasztásával az” Eszközök ” menüből, majd kattintson az atomra, amelyet középen szeretne lenni. Csúsztassa a” zoom ” csúszkát a nézet nagyításához.
Site-Directed Mutagenesis
egy időben úgy gondolták, hogy a Glu 161 negatív töltése negatív hatással van az F6P kötődésére a T állapotban. Ezt az elképzelést nem támogatták a helyszíni mutagenezis kísérletek. Számos mutáns PFK készült, köztük az R162A, az E161A és az R162A/E161A. az R162A mutáció 30-szor csökkentette az F6P kötődését. Az E161A mutáció azonban kevés hatással volt a PEP azon képességére, hogy gátolja az F6P kötődést.
betegség
örökletes eritrociták a PFK-hiány myopathiához és hemolízishez (Tarui-betegség) kapcsolódik.
PFK
Foszfofruktokináz 3D struktúrák
Leave a Reply