Halobetasol propionát kenőcs
adagolási forma: kenőcs
orvosilag felül Drugs.com. Utoljára frissítve: 2020. március 1.
- Áttekintés
- Mellékhatások
- Adagolás
- Szakmai
- Kölcsönhatások
- Több
Halobetasol Propionát Kenőcs Leírás
Halobetasol Propionát Kenőcs, 0,05% – os tartalmaz halobetasol propionát, szintetikus kortikoszteroid lokális bőrgyógyászati használatra. A kortikoszteroidok elsősorban szintetikus szteroidok egy csoportját alkotják, amelyeket helyileg gyulladáscsökkentő és antipruritikus szerként alkalmaznak.
kémiailag a halobetazol-propionát 21-klór-6α, 9-difluor-11β, 17-dihidroxi-16β-metilpregna-1, 4-dién-3-20-Dion, 17-propionát, C25H31ClF2O5. A következő szerkezeti képlettel rendelkezik:
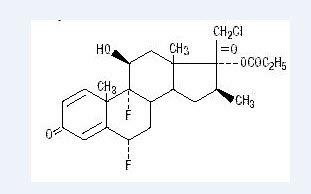
Halobetasol propionát molekulatömege 485. Ez egy vízben oldhatatlan fehér kristályos por.
minden gramm Halobetaszol-propionát kenőcs 0-t tartalmaz.5 mg/g halobetazol-propionát alumínium-sztearát, méhviasz, pentaeritrit-kokoát, petrolátum, propilénglikol, szorbitán-szeszkvioleát és sztearil-citrát alapjában.
Halobetaszol propionát kenőcs-klinikai farmakológia
mint más helyi kortikoszteroidok, a halobetaszol-propionát gyulladáscsökkentő, antipruritikus és vasoconstrictív hatású. A lokális kortikoszteroidok gyulladáscsökkentő hatásának mechanizmusa általában nem tisztázott. Úgy gondolják azonban, hogy a kortikoszteroidok a foszfolipáz A2 gátló fehérjék indukciójával járnak el, amelyeket együttesen lipokortinoknak neveznek. Feltételezik, hogy ezek a fehérjék szabályozzák a gyulladás erős mediátorainak, például a prosztaglandinoknak és a leukotrieneknek a bioszintézisét azáltal, hogy gátolják közös prekurzoruk, az arachidonsav felszabadulását. Az arachidonsavat a foszfolipáz A2 szabadítja fel a membrán foszfolipidekből.
farmakokinetika
a lokális kortikoszteroidok perkután felszívódásának mértékét számos tényező határozza meg, beleértve a járművet és az epidermális gát integritását. A hidrokortizonnal legfeljebb 24 órán át tartó elzáródó kötszerek nem bizonyították a penetráció növelését; a hidrokortizon 96 órán át történő elzáródása azonban jelentősen növeli a penetrációt. A helyi kortikoszteroidok felszívódhatnak a normál ép bőrből. A bőr gyulladása és/vagy más betegségfolyamatok fokozhatják a perkután felszívódását.
humán és állatkísérletek azt mutatják, hogy a halobetaszol-propionát alkalmazott dózisának kevesebb mint 6% – A kerül forgalomba a halobetaszol-propionát kenőcs helyi alkalmazását követő 96 órán belül.
a Halobetaszol-propionát kenőccsel végzett vizsgálatok azt mutatják, hogy a hatásosság szuper-nagy tartományában van, mint más helyi kortikoszteroidokkal szemben.
A Halobetaszol propionát kenőcs javallata és alkalmazása
a Halobetaszol propionát kenőcs szuper-nagy hatékonyságú kortikoszteroid, amely a kortikoszteroid-érzékeny dermatózisok gyulladásos és viszkető megnyilvánulásainak enyhítésére javallt. A két egymást követő héten túli kezelés nem ajánlott, a teljes dózis nem haladhatja meg az 50 g/hét értéket, mivel a gyógyszer képes elnyomni a hypothalamus-hipofízis-mellékvese (HPA) tengelyt. A 12 év alatti gyermekek használata nem ajánlott.
mint más nagy aktivitású kortikoszteroidok esetében, a kezelést a kontroll elérésekor abba kell hagyni. Ha 2 héten belül nem tapasztalható javulás, szükség lehet a diagnózis újraértékelésére.
ellenjavallatok
a Halobetasol propionát kenőcs ellenjavallt azoknál a betegeknél, akiknél a készítmény bármely összetevőjével szembeni túlérzékenység fordult elő.
óvintézkedések
Általános
a lokális kortikoszteroidok szisztémás felszívódása reverzibilis hypothalamus – hipofízis-mellékvese (HPA) tengely szuppressziót eredményezhet a glükokortikoszteroid elégtelenség lehetőségével a kezelés abbahagyása után. Megnyilvánulásai Cushing-szindróma, hiperglikémia, glucosuria is előállítható egyes betegeknél szisztémás felszívódása lokális kortikoszteroidok a kezelés alatt.
a Betegek alkalmazása lokális szteroid, hogy a nagy terület vagy területek alatt elzáródás kell értékelni rendszeresen bizonyíték a HPA tengely elnyomás. Ezt az ACTH stimuláció, a plazma kortizol és a vizelet-szabad kortizol vizsgálatok segítségével lehet elvégezni. A szuper erős kortikoszteroidokat kapó betegeket nem szabad egyszerre több mint 2 hétig kezelni, és a HPA-szuppresszió fokozott kockázata miatt csak kis területeket kell egyszerre kezelni.
A Halobetaszol-propionát kenőcs HPA tengely szuppressziót okozott, ha egy héten át napi 7 grammban osztott dózisban alkalmazták psoriasisban szenvedő betegeknél. Ezek a hatások a kezelés abbahagyásakor reverzibilisek voltak.
ha HPA tengely elnyomást észlelnek, meg kell kísérelni a gyógyszer visszavonását, az alkalmazás gyakoriságának csökkentését vagy egy kevésbé hatékony kortikoszteroid helyettesítését. A HPA tengely funkció helyreállítása általában a lokális kortikoszteroidok abbahagyása után gyors. Ritkán a glükokortikoszteroid elégtelenség jelei és tünetei fordulhatnak elő, amelyek kiegészítő szisztémás kortikoszteroidokat igényelnek. A szisztémás kiegészítéssel kapcsolatos információkat lásd az e termékekre vonatkozó alkalmazási előírásban.
A gyermekgyógyászati betegek nagyobb bőrfelszínük és testtömeg-arányuk miatt az ekvivalens dózisok hatására hajlamosabbak lehetnek a szisztémás toxicitásra (lásd óvintézkedések: gyermekgyógyászati alkalmazás).
irritáció kialakulása esetén a Halobetazol-propionát kenőcsöt fel kell függeszteni, és megfelelő terápiát kell alkalmazni. Allergiás kontakt dermatitis kortikoszteroidok általában diagnosztizált megfigyelése elmulasztása gyógyítani, ahelyett, hogy a klinikai súlyosbodása, mint a legtöbb helyi termékek nem tartalmazó kortikoszteroidok. Ezt a megfigyelést megfelelő diagnosztikai tapaszvizsgálattal kell alátámasztani.
ha egyidejű bőrfertőzések vannak jelen vagy alakulnak ki, megfelelő gombaellenes vagy antibakteriális szert kell alkalmazni. Ha a kedvező válasz nem következik be azonnal, a Halobetasol propionát kenőcs alkalmazását addig kell abbahagyni, amíg a fertőzést megfelelően nem ellenőrzik.
A Halobetasol propionát kenőcs nem alkalmazható rosacea vagy perioralis dermatitis kezelésére, és nem alkalmazható az arcon, az ágyékon vagy az axillákon.
A lokális kortikoszteroidokat alkalmazó betegeknek a következő információkat és utasításokat kell kapniuk:
- a gyógyszert az orvos utasításai szerint kell alkalmazni. Csak külső használatra szolgál. Kerülje a szemmel való érintkezést.
- a gyógyszert nem szabad olyan rendellenességre alkalmazni, amelyre azt felírták.
- a kezelt bőrfelületet nem szabad bekötni, más módon lefedni vagy becsomagolni, hogy az orvos utasítása nélkül elzáródhasson.
- a betegeknek jelenteniük kell orvosuknak a helyi mellékhatások bármely jelét.\
laboratóriumi vizsgálatok
a következő vizsgálatok hasznosak lehetnek a betegek értékelésében a HPA tengely szuppresszió szempontjából: ACTH-stimulációs teszt; a plazma kortizol teszt; Vizeletmentes-kortizol teszt.
karcinogenezis, Mutagenesis, Fertilitásromlás
hosszú távú állatkísérleteket nem végeztek a halobetazol-propionát karcinogén potenciáljának értékelésére. Két genotoxicitási vizsgálatban pozitív mutagenitási hatásokat figyeltek meg. A halobetazol-propionát pozitív volt egy kínai hörcsög micronucleus tesztben, valamint egy egér lymphoma génmutációs vizsgálatban in vitro.
patkányokon végzett, szájon át történő alkalmazást követő, legfeljebb 50 mcg/kg/nap dózisszinttel végzett vizsgálatok nem mutatták a termékenység vagy az Általános reprodukciós teljesítmény romlását.
más genotoxicitási vizsgálatok során a halobetaszol-propionát nem bizonyult genotoxikusnak az Ames/Salmonella vizsgálatban, a kínai hörcsög szomatikus sejtjeiben végzett testvérkromatidcsere-vizsgálatban, a rágcsálók germinális és szomatikus sejtjeinek kromoszóma aberrációs vizsgálataiban, valamint a pontmutációk meghatározására szolgáló emlős spot tesztben.
terhesség
teratogén hatások: A C terhességi kategória
a kortikoszteroidok laboratóriumi állatokban teratogénnek bizonyultak, ha viszonylag alacsony dózisszint mellett szisztematikusan alkalmazták őket. Néhány kortikoszteroidról kimutatták, hogy teratogén a laboratóriumi állatokban történő dermális alkalmazás után.
a Halobetaszol-propionát teratogénnek bizonyult SPF patkányokban és csincsilla típusú nyulakban, ha a vemhesség alatt rendszeresen 0, 04-0, 1 mg/ttkg dózisban adták patkányokban és 0, 01 mg/ttkg nyulakban. Ezek az adagok körülbelül 13, 33, illetve 3-szorosa a Halobetaszol-propionát kenőcs humán helyi adagjának. A halobetazol-propionát nyulakban embriotoxikus volt, patkányokban azonban nem.
Szájpadhasadást figyeltek meg patkányokban és nyulakban egyaránt. Az Omphalocele-t patkányokban figyelték meg, de nyulakban nem.
terhes nőkön nem végeztek megfelelő és jól kontrollált vizsgálatokat a halobetazol-propionát teratogén potenciáljára vonatkozóan. A Halobetasol propionát kenőcsöt terhesség alatt csak akkor szabad alkalmazni, ha a potenciális előny indokolja a magzatra gyakorolt potenciális kockázatot.
szoptató anyák
szisztémásan alkalmazott kortikoszteroidok jelennek meg az anyatejben, és gátolhatják a növekedést, zavarhatják az endogén kortikoszteroid termelést, vagy egyéb nemkívánatos hatásokat okozhatnak. Nem ismert, hogy a kortikoszteroidok helyi alkalmazása elegendő szisztémás felszívódást eredményezhet-e az emberi anyatejben kimutatható mennyiségek előállításához. Mivel sok gyógyszer kiválasztódik az anyatejbe, óvatosan kell eljárni, ha a halobetasol propionát kenőcsöt szoptató nőnek adják be.
gyermekgyógyászati alkalmazás
a Halobetazol-propionát kenőcs biztonságosságát és hatásosságát gyermekgyógyászati betegeknél nem állapították meg, és a 12 év alatti gyermekgyógyászati betegeknél történő alkalmazás nem javasolt. A bőrfelszín és a testtömeg közötti nagyobb arány miatt a gyermekgyógyászati betegek nagyobb kockázatnak vannak kitéve, mint a HPA tengely szuppresszió és Cushing-szindróma felnőttjei, amikor helyi kortikoszteroidokkal kezelik őket. Ezért nagyobb a mellékvese-elégtelenség kockázata a kezelés abbahagyása alatt vagy után. A lokális kortikoszteroidok nem megfelelő alkalmazása mellett a striae-t is beleértve, mellékhatásokról számoltak be csecsemőknél és gyermekeknél.helyi kortikoszteroidokat kapó gyermekeknél HPA-tengely szuppressziót, Cushing-szindrómát, lineáris növekedési retardációt, késleltetett súlygyarapodást és intracranialis hypertoniát jelentettek. A mellékvese szuppressziójának megnyilvánulása gyermekeknél az alacsony plazma kortizolszint és az ACTH stimulációra adott válasz hiánya. Az intrakraniális hipertónia megnyilvánulásai közé tartozik a kidudorodó fontanellák, fejfájás, kétoldalú papilledema.
geriátriai alkalmazás
a klinikai vizsgálatokban Halobetaszol-propionát kenőccsel kezelt 850 beteg közül 21% 61 éves, 6% pedig 71 éves vagy annál idősebb volt. Összességében nem különbségek biztonságát vagy hatékonyságát figyelték meg, ezek között a betegek fiatalabb betegeknél; valamint a többi bejelentett klinikai tapasztalatok nem azonosított különbség a válaszok között az idősebb, illetve fiatalabb betegek, de nagyobb érzékenységet néhány idősebb egyének nem zárható ki.
mellékhatások
kontrollos klinikai vizsgálatokban a Halobetaszol propionát kenőcs esetében jelentett leggyakoribb mellékhatások közé tartozott a betegek 1, 6% – ánál a szúrás vagy az égés. Ritkábban jelentett mellékhatások a következők voltak: pustuláció, erythema, bőr atrófia, leukoderma, akne, viszketés, másodlagos fertőzés, telangiectasia, urticaria, száraz bőr, miliaria, paresthesia és bőrkiütés.
a lokális kortikoszteroidokkal kapcsolatban ritkán további helyi mellékhatásokról számoltak be, és ezek gyakrabban fordulhatnak elő nagy hatásfokú kortikoszteroidokkal, például Halobetaszol-propionát kenőccsel. Ezek a reakciók közelítő csökkenő sorrendben vannak felsorolva: folliculitis, hypertrichosis, acneiform eruptions, hypopigmentation, perioralis dermatitis, allergiás kontakt dermatitis, másodlagos fertőzés, striae és miliaria.
a feltételezett mellékhatások bejelentéséhez forduljon a Teligent Pharma, Inc. – hez. a 1-856-697-1441, vagy FDA 1-800-FDA-1088 vagy www.fda.gov / medwatch.
Túladagolás
Helyileg alkalmazott, Halobetasol Propionát Kenőcs is felszívódik elegendő mennyiségben előállítani, szisztémás hatások (lásd ÓVINTÉZKEDÉSEK)h
Halobetasol Propionát Kenőcs Adagolás, alkalmazás
Alkalmazni egy vékony réteg Halobetasol Propionát Kenőccsel az érintett bőrfelületet naponta egyszer vagy kétszer, mint rendezte az orvos, majd gyengéden, teljesen bedörzsölni.
a Halobetasol propionát kenőcs egy szuper-nagy hatékonyságú helyi kortikoszteroid; ezért a kezelést két hétre kell korlátozni, és 50 g/wk-nál nagyobb mennyiséget nem szabad alkalmazni. A többi kortikoszteroidhoz hasonlóan a kezelést is abba kell hagyni a kontroll elérésekor. Ha 2 héten belül nem tapasztalható javulás, szükség lehet a diagnózis újraértékelésére.
A Halobetaszol-propionát kenőcs nem alkalmazható okklúziós kötszerekkel.
hogyan kerül forgalomba a Halobetaszol-propionát kenőcs
Halobetaszol-propionát kenőcs, 0, 05% A következő csőméretekben kerül forgalomba:
50 g (NDC 63739-998-67)
Tárolás
tárolja a Halobetaszol propionát kenőcsöt 15°C és 30°C között (59°F és 86°F).
gyártotta:
Teligent Pharma, Inc.
Buena, NJ 08310
forgalmazója:
McKesson Corporation
DBA Sky Packaging
4971 Southridge Blvd., Suite 101
Memphis, TN 38141
PI-073-00
c101430 Rev 02/2020
CSOMAGCÍMKE.Fő kijelzőpanel 50 gramm karton
NDC 63739-998-67
Halobetasol propionát
kenőcs, 0,05%
kizárólag helyi alkalmazásra.
nem használható a szemében.
Net Wt. 50 grams
Rx Only

| HALOBETASOL PROPIONATE Halobetasol Propionate Ointment |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – McKesson Corporation (140529962)
Registrant – Teligent Pharma, Inc. (011036910)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Teligent Pharma, Inc. | 011036910 | manufacture(63739-998) | |
Frequently asked questions
- Halobetasol vs. clobetasol – how do they compare?
- lehet ezt használni poison ivy?
- használható a fejbőrön?
További információ a halobetasol lokális
- mellékhatások
- terhesség vagy szoptatás alatt
- adagolási információ
- Gyógyszerkölcsönhatások
- alternatívák összehasonlítása
- árképzés & kuponok
- 25 vélemények
- : topical steroids
Consumer resources
- Patient Information
- Halobetasol Topical application (Advanced Reading)
Professional resources
- Prescribing Information
- Halobetasol (FDA)
- Halobetasol Cream (FDA)
- Halobetasol Foam (FDA)
Other brands Ultravate, Lexette, Bryhali, Halonate
Related treatment guides
- Plaque Psoriasis
- Eczema
- Psoriasis
- Atopic Dermatitis
- Granuloma Annulare
- Dermatitis
Medical Disclaimer
Leave a Reply