Határok a Farmakológiai
Bevezető
Liposzómák egy típusú nanocarrier, hogy már széles körben vizsgálták a gyógyszer-szállítási célokra. Foszfolipid kétrétegekből állnak, amelyek különálló vizes teret zárnak be, ezáltal lehetővé téve mind a hidrofil, mind a hidrofób vegyületek kapszulázását (Metselaar and Storm, 2005). A liposzómák képesek stabilizálni a terápiás vegyületeket és leküzdeni a sejtek és szövetek felvételének akadályait (Ding et al., 2006; Hua és Wu, 2013). Ez lehetővé teszi számukra, hogy javítsák a vegyületek célzását a betegség helyszíneire, következésképpen csökkentsék a nem célszervek felhalmozódását (Bakker-Woudenberg et al., 1994; Mastrobattista et al., 1999; Hua, 2013; Hua et al., 2015; Sercombe et al., 2015; Zununi Vahed et al., 2017). A liposzómák négy fő típusa létezik felületi jellemzőik alapján-hagyományos liposzómák, pegilált liposzómák, ligand-célzott liposzómák és theranosztikus liposzómák (1. ábra; Sercombe et al., 2015). A Ligand-célzott liposzómák lehetővé teszik a gyógyszerek helyspecifikus szállítását bizonyos szövetekbe vagy szervekbe, amelyek szelektíven kifejezik a célzott ligandumot (Willis and Forssen, 1998; Bendas, 2001; Sawant and Torchilin, 2012), mivel a pegilált liposzómák szterikus akadályt jelentenek a szisztémás beadást követő szállítási rendszer keringési felezési idejének növelésére (Torchilin, 1994; Wang et al., 2015). A különböző szállítási platformok kombinációját tartalmazó liposzómák tovább javíthatják a kapszulázott vegyületek szállítását, a beadás módjától és a betegség helyétől függően.
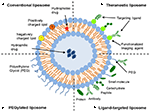
1.ábra. Sematikus ábrázolása a különböző típusú liposzómás gyógyszer szállítási rendszerek – (a) hagyományos liposzóma, (B) pegilált liposzóma, (C) Ligand-célzott liposzóma, és (D) Theranosztikus liposzóma (Sercombe et al., 2015).
a Következő a gyártási folyamat, liposzómák jellemzi, hogy biztosítsa homogenitás át a paraméterek száma, beleértve a kábítószer beágyazási, ligand-ragozás, lipid-összetétel, felületi töltés, valamint morfológiai tulajdonságok (pl., mérete, alakja, száma lamellák) (Kuntsche et al., 2011). Ezek a jellemzők fontosak, mivel jelentős hatással lehetnek a liposzómák viselkedésére mind in vitro, mind in vivo (Sawant and Torchilin, 2012; Sercombe et al., 2015). Az elismerés, a kiürülés, a liposzómák a szervezet védekező rendszerét, beleértve a reticuloendothelial rendszer (RES), valamint az adszorpciós a opsonins a későbbi felvételi a mononukleáris fagocita rendszer, jelentős támogatója az engedély bomlás liposzómák (Vezető, 1987; Cullis et al., 1998; Ishida et al., 2001). Ezért a gyártott liposzómák fizikai-kémiai tulajdonságainak meghatározása fontos a készítmény további transzlációs értékeléséhez.
a liposzómák fizikai-kémiai értékelésének egyik fő szempontja a nanorészecskék morfológiájának mikroszkópiával történő ábrázolása. Számos technika áll rendelkezésre a liposzómák és más nanorészecskék képalkotására, amelyek széles körben kategorizálhatók fény -, elektron-vagy atomerő-mikroszkópiára (Bibi et al., 2011). Minden technikának megvannak a maga előnyei és korlátai, amelyeket figyelembe kell venni a nanorészecskén alapuló gyógyszeradagoló rendszerekkel kapcsolatos vizsgálatok értékelésekor (1.táblázat). Ez a felülvizsgálat értékelni fogja a liposzómák morfológiai jellemzőinek értékelésére használt minden képalkotó technikát.

1. táblázat. A liposzóma morfológiájának jellemzésére szolgáló jelenlegi képalkotó technikák összefoglalása.
Fénymikroszkópia
fény-vagy optikai mikroszkóp olyan mikroszkópokra utal, amelyek látható fényt és lencsék elrendezését használják fel egy látómező nagyítására (Murphy and Davidson, 2012c). Maga az alapvető fénymikroszkópia nem képes átfogó információkat szolgáltatni a lipid kétrétegről a többi mikroszkópos technika által kínált részletekhez képest. Ezt fel lehet használni, hogy gyorsan kap egy képet a hólyagok segítségével alapvető laboratóriumi berendezések (Bibi et al., 2011). Ez a technika különösen hasznos lehet A liposzómaminta méretére, alakjára, homogenitására és aggregációjának mértékére vonatkozó általános információk összegyűjtésekor (Nallamothu et al., 2006). Fény mikroszkóp egy végső állásfoglalás ∼250 nm (szabályozza a legkisebb diffrakció-limitált hely méretét, hogy lehet elérni, hogy a műszer), és mint ilyen, jellemzően képtelen nyújt részletes információt a struktúrák kis unilamellar hólyagok (Suv-ok), valamint a lamellarity a hólyagok (Bibi et al., 2011). Általában a fénymikroszkópia csak jelentős információkat nyújthat az Óriás unilamelláris vezikulumokról (GUVs), amelyek átmérője egytől több száz mikrométerig terjedhet (Bagatolli, 2009). A fluoreszkáló szondák beépítése, a polarizációs technikák, valamint a nagy felbontású konfokális mikroszkópia alkalmazása további információkat nyújthat a hólyagok 3D szerkezetéről és lamellaritásáról (Bagatolli, 2009).
polarizációs mikroszkópia
Az ilyen típusú fénymikroszkópia a polarizált fény egyedülálló képességét használja a rendezett molekulák polarizálható kötéseivel való kölcsönhatásra (Murphy and Davidson, 2012d). A fokozott fényelnyelés akkor következik be, amikor a mintában lévő molekuláris dipólusok igazodnak az incidens fényhullám polarizációs vektorához; ami a fázis különbség a mintavételi fénysugarak, ami viszont termel interferencia-függő változások amplitúdója a kép sík (Murphy Davidson, 2012d). A képkontraszt ezután nemcsak az interferencia és a diffrakció hatásai miatt merül fel, hanem a rendezett molekuláris elrendezések jelenléte miatt is (Murphy and Davidson, 2012d). Számos rendezett sejtszerkezet, köztük a plazmamembránok lipid bilayereinek (Bibi et al., 2011; Murphy and Davidson, 2012d). A képeket monokróm vagy színes formában lehet beszerezni. Ez a technika alternatív módszert kínál a liposzómák megjelenítésére, különösen a hólyagok kialakulásának megerősítésére. Nem nyújt meggyőző észrevételeket a hólyagok kétrétegű jellemzőivel vagy lamellaritásával kapcsolatban (Bibi et al., 2011). Ezenkívül a polarizációs mikroszkópiát a megjeleníthető hólyagok mérete is korlátozza, a mikrométer tartományban lévő nagy hólyagok optimális tisztasággal rendelkeznek. Ez a technika nem nyújt egyértelmű képet a nanométeres tartományban lévő részecskékről.
fluoreszcens mikroszkópia
fluoreszcencia vagy “epifluoreszcencia” mikroszkópia a fénymikroszkópia egy speciális formája, amely kihasználja a fluorokrómok azon képességét, hogy bizonyos hullámhosszú fény hatására fényt bocsátanak ki (Murphy and Davidson, 2012b). Ezt a technikát széles körben használják a biofizikában, hogy lényeges információkat szolgáltassanak a membránkomponensek szerkezetéről és dinamikájáról (Bouvrais et al., 2010). Ezekben a vizsgálatokban a fluoreszkáló szondákat kifejezetten beépítették a vizsgált membránba, lehetővé téve a szerkezet vizualizációját. A különböző kémiai és fotonikus tulajdonságokkal rendelkező fluoreszkáló festékek széles skálája kereskedelmi forgalomban kapható, számos kutatási kérdésre válaszolva. Például egyes fluoreszkáló festékek előnyben részesíthetik a különböző elrendezésű és oldalirányú csomagolást mutató speciális membránkörnyezeteket (Bouvrais et al., 2010). Mint ilyen, a fluoreszcens mikroszkópia lehetővé teszi, hogy egyszerre több szondát alkalmazzanak egy mintán belül, hogy információt nyújtsanak magáról a membránszerkezetről. A fluoreszkáló szondák a vizes rekeszbe, valamint a liposzómák lipid kétrétegébe helyezhetők (Bibi et al., 2011). Ez az elrendezés különösen hasznos lehet, ha megtekinti GUVs, ahol információt lehet szerezni a forma, méret és folyékonyság a lipid vezikulumok (Klymchenko et al., 2009; Bouvrais et al., 2010). A szondák, például a rodaminnal jelölt lipidek beépítése közvetlenül a lipid kétrétegbe lehetővé teszi a liposzómák lamellaritásának megjelenítését (Bibi et al., 2011).
a fluoreszkáló mikroszkópia hátránya, hogy a szondák és színezékek membránrendszerhez való hozzáadása potenciálisan befolyásolhatja a liposzómás szállítási rendszer tulajdonságait (Bouvrais et al., 2010; Bibi et al., 2011; Murphy és Davidson, 2012b). Az alacsony festékkoncentrációk (≤1 mol%) alkalmazása azonban minimális hatást gyakorolt a membrán fizikai tulajdonságaira (Bouvrais et al., 2010). Fontos megjegyezni azt is, hogy a fluoreszkáló festék kiválasztása kritikus lépés, mivel egyes festékek nagy változásokat idézhetnek elő a gazdamembránban és/vagy kísérleti műtárgyakat okozhatnak, ami pontatlan adatértelmezést eredményez (Bouvrais et al., 2010). Ezenkívül a fotó által kiváltott lipidperoxidáció akár egyszerű festékrendszerekben is doménképződéshez vezethet. Ez a folyamat nagy tutajok képződését és spontán felszínképződést eredményezhet (Bouvrais et al., 2010). A fluoreszkáló fénynek való tartós kitettség fehérítést és a fluoreszcencia intenzitásának elvesztését is eredményezheti. Ezért a fluoreszcens festék kiválasztása és az új membránszondák kifejlesztése fontos szempont a fluoreszcens mikroszkópia (Klymchenko et al., 2009).
konfokális mikroszkópia
a konfokális pásztázó mikroszkópia előrelépést jelentett a fluoreszcens mikroszkópia területén. A teljes minta megvilágítása helyett egy képet úgy készítenek, hogy egy (vagy több) fókuszált fénysugarat szkennelnek a mintán. A megvilágított mintából visszatérő fény áthalad egy olyan nyíláson, amely elutasítja a fókuszon kívüli fényt az érdekes sík felett vagy alatt; annak biztosítása, hogy csak kis mélységű képeket kapjanak, jelentősen javítva a síkon kívüli felbontást (Bibi et al., 2011; Murphy és Davidson, 2012a). Ezzel a technikával egy” z-stack ” képeket gyűjtünk össze, kezdve a vezikulum tetejétől, majd meghatározott z-lépésekben a minta aljára készített képeket, ami a minta összetett 3D képét eredményezi (Bibi et al., 2011; Murphy és Davidson, 2012a). A konfokális pásztázó mikroszkópia vonzóbb technikává vált az epifluoreszcens fénymikroszkópokkal szemben a kiváló képtisztaság miatt. Guv-k esetében ez a technika képes megjeleníteni a lipidrendszerek belső szerkezetét, ami gyakran nem lehetséges más mikroszkópos módszerekkel (Ruozi et al., 2011; Mertins és Dimova, 2013). Például a vizes és lipid kétrétegű fázis elválasztása egyértelműen láthatóvá válik nagyobb vezikulumokban (Mertins and Dimova, 2013). A konfokális mikroszkópia azonban még mindig diffrakciós-korlátozott, ezért nem képes nagy felbontású képeket készíteni SUV – król vagy oligolamelláris liposzómákról (Ruozi et al., 2011).
elektronmikroszkópos technikák
az elektronmikroszkópia egy módszer a vezikulumok megjelenítésére nagyon nagy nagyítás alatt (Henry, 2005). Széles körben használják, a jellemzés a lipid hólyagok, mint az elektron hullámhossz (ezért diffrakció-limitált felbontás), sok nagyságrenddel alacsonyabb, mint az optikai mikroszkópia, ezért előírja a szuper-felbontású a tiszta vizualizáció kis liposzómák (Bibi et al., 2011; Ruozi et al., 2011). Ez a technika különböző elektromágneses lencsékkel a minta felületére fókuszált elektronsugarat használ. Az elektronokat ezután a minta szétszórja, majd a képalkotó oszlopban egy további elektromágneses lencsék sorozatával újra fókuszálják és nagyítják, hogy vetített képet készítsenek (Henry, 2005). Számos különböző típusú elektronmikroszkóp létezik, amelyek mindegyike eltérő mintaelőkészítési módszert igényel.
pásztázó elektronmikroszkópia (SEM)
a pásztázó elektronmikroszkópok (SEMs) egy olyan elektronsugarat használnak, amelyet egy mintán vagy mintán keresztül szkennelnek (nem mintán keresztül) egy tárgy nagyított képének előállításához (Adler és Schiemann, 1985). Alder et al. először 1984-ben kísérelték meg a SEM-t liposzómák jellemzésére (Adler és Schiemann, 1985). Azt mutatták, hogy a fagyasztva szárítási módszerrel a LIPOSZÓMAMINTÁK SEM-re történő elkészítéséhez a látható csomók és porított anyagok nagy részét eredményezték (Adler and Schiemann, 1985). Újabb vizsgálatok kimutatták, hogy maga a liposzómaszerkezet is perturbációkat szenvedhet az ehhez az előkészítési technikához szükséges magas vákuumfeltételek és festési folyamatok miatt (Ruozi et al., 2011). SEM ma már nem általánosan használt elemzésére liposzómák, mert megköveteli a mintát kell szárítani vagy rögzített képalkotás előtt (Ruozi et al., 2011). A SEM azonban általános információkat nyújthat a különböző lipidrétegek koncentrikus szerkezetéről, valamint részletesen ismertetheti a készítmény méretét és gömb alakú morfológiáját (Nirale et al., 2009).
transzmissziós elektronmikroszkópia (TEM)
transzmissziós elektronmikroszkópia (TEM) a leggyakrabban használt képalkotó módszer a nanorészecskék szerkezetének értékelésére (Henry, 2005; Kuntsche et al., 2011). Ez magában foglalja egy vékony minta (<100 nm vastag) elkészítését, amelyet vákuumkamrába helyeznek. Az elektronsugár keresztezi a mintát, ahol az objektív lencse fókuszálja a képet. A TEM könnyen képezhet lágyanyag-mintákat térbeli felbontással, jóval 1 nm-es méret alatt (Henry, 2005; Kuntsche et al., 2011; Ruozi et al., 2011). Ez a technika tovább kategorizálható az alkalmazott mintaelőkészítési módszer alapján – különösen negatív festés, fagyasztás-törés és kriogén TEM. Információt nyújt a nanorészecskék felületi módosításairól, mivel jobb kontrasztot és kontúrt biztosít a képek számára, mint más mikroszkópos technikák. Például a transzferrinnek a dspc/koleszterin liposzómák felületére történő konjugációja negatív foltos TEM-vel rendelkező részecske felületi bevonatot mutatott, amely hiányzott a nem konjugált liposzómakészítményekben (Anabousi et al., 2005). Egy külön kísérletben a negatív foltos eljárás előtt specifikus antitesteket adtak a humán transzferrin ellen, hogy megerősítsék a részecske felületi bevonat azonosságát (Anabousi et al., 2005). Ezért a TEM lehetővé teszi, hogy sokkal jobb felbontást érjen el a ligandumok liposzómák felületére való konjugációjának értékelésekor.
negatív festési technika
negatív foltos TEM esetén a minta előkészítése során kis mennyiségű hidratált mintát helyeznek a rácsra. Mivel a hólyagok közvetlenül érintkeznek a hálózattal, orientációjuk és morfológiájuk is befolyásolható, ezért ezt figyelembe kell venni (Bibi et al., 2011). A liposzómákat megfelelő elektronsűrű anyagba (pl., nehézfémsók, mint az uranil-acetát vagy a foszfotungsztinsav), amely nagy kontrasztot biztosít, így a vezikulumok sötét színű háttérrel nézhetők meg (Ruozi et al., 2011). A negatív festési technika viszonylag gyors és egyszerű; azonban kimutatták, hogy megváltoztatja az eredeti liposzómaszerkezetet, és olyan világos és sötét rojtok kialakulásához vezethet, amelyek összetéveszthetők a lamellás szerkezetekkel (Bibi et al., 2011; Ruozi et al., 2011). Ezenkívül a minta vákuum alá helyezése a minta további kiszáradását okozhatja, ami ismét megváltoztathatja a hólyagok szerkezetét (Bibi et al., 2011). Míg a negatív foltos TEM technika sokkal nagyobb nagyítást biztosít a nanorészecskék képalkotásához, a liposzómaszerkezet károsodása megnehezíti a minta morfológiai jellemzőinek pontos értékelését. Ezért általában más képalkotó technikákra van szükség az eredmények megerősítéséhez.
Freeze-Fracture Technique
a freeze-fracture technika nem igényel szárítási folyamatot, és további információkat nyújthat a nanorészecskék belső szerkezetéről (kuntsche et al., 2011). Ez a módszer magában foglalja a minta elhelyezését egy TEM rácsra, amelyet két réz vagy arany tartó közé helyeznek (Severs, 2007). A mintát gyors fagyasztással üvegezik, jellemzően folyékony propánnal vagy folyékony nitrogénnel, mielőtt a minta Gyenge molekuláris kölcsönhatásokkal rendelkező területei mentén törnének. Ez a törés felület további vésett, s a nyomában egy vékony platina vagy szén réteg nyújt egy “negatív” mása a törés minta gép (Elvágja, 2007; Kuntsche et al., 2011). A replikát ezután szerves oldószerrel tisztítják, hogy eltávolítsák az összes maradékot a TEM mikroszkóp alatt történő megjelenítés előtt. Mivel ezek a másolatok annyira stabilak, hogy később is tárolhatók és megtekinthetők (Kuntsche et al., 2011). Ennek a technikának az a legnagyobb előnye, hogy a másolatok szorosan tükrözik a minta natív állapotát, és részletes információkat szolgáltathatnak a hólyagok és a kétrétegű szervezet (Bibi et al., 2011; Kuntsche et al., 2011). Ez az információ magában foglalja a többrétegű szerkezetet és a többrétegű hólyagok kétrétegű csomagolását. Ez a technika az aggregátum méretét is felmérheti, és különösen hasznos lehet a kationos liposzómák DNS-sel való kölcsönhatásának vizsgálatára (Bibi et al., 2011). Az előkészítés során azonban a mintában továbbra is előfordulhatnak leletek az elégtelen fagyasztási sebesség, az oldószermolekulák újbóli lerakódása és/vagy mechanikai feszültség miatt (Severs, 2007; Kuntsche et al., 2011). Például “hullámzó hatás” fordulhat elő a mintában lévő SUV-kon (Bibi et al., 2011). Ez egy gyakori kétrétegű deformáció, amely a fagyasztás előtt az acil láncok átmeneteinek rendellenessége miatt következik be. Az átmenet előtti és a tényleges átmeneti hőmérséklet közötti hólyagok inkubálása hullámokat is okozhat (Bibi et al., 2011). Érdekes, hogy ezt fel lehet használni, hogy információt nyújtson a lipid fázisátmenetekről, amelyek a liposzomális készítményekhez használt lipidek változó természetével fordulnak elő (Bibi et al., 2011).
kriogén TEM
kriogén TEM (cryo-TEM) a TEM egy változata, ahol a képalkotás előtt vékony vizes hidratált filmeket használnak, amelyeket folyékony etán vitrifikálnak. Ez a technika lehetővé teszi, hogy az elemzés a liposzómák a legtöbb natív állapotban, és egy értékes eszköz, hogy meghatározza a méret, alak, belső szerkezet, lamellaritás liposzómák (Weisman et al., 2004; Bibi et al., 2011; Kuntsche et al., 2011). A gyorsan fagyasztható liposzómaminták fő előnye a jégkristályok képződésének minimalizálása, a fehérjék vagy más anyagok megőrzése (Bibi et al., 2011; Kuntsche et al., 2011). Ez akkor előnyös, ha a nanorészecskékben fehérjéket vagy DNS-t kapszuláztak (Weisman et al., 2004; Kuntsche et al., 2011). Cryo-TEM a leghasznosabb formája mikroszkópia jelenleg rendelkezésre álló tanulmány liposzómák, mivel elkerüli kérdések kémiai rögzítés, kiszáradás, vágás, festés – amelyek mindegyike hatással lehet A morfológiája hólyagok (Bibi et al., 2011). A felbontási tartomány ∼5-500 nm, a film vastagsága határozza meg (Almgren et al., 2000). Ezzel a technikával azonban számos korlátozást kell megjegyezni, beleértve azt a tényt is, hogy csak 2D képet kapunk 3D objektumokból (ami általában a többi mikroszkópos technikára is vonatkozik). Ennek a korlátozásnak a leküzdése érdekében a 3D formák rekonstrukciója elég nagy számú, véletlenszerűen orientált, nem gömb alakú részecskékből álló 2D képből lehetséges (Orlova et al., 1999), valamint a minta különböző dőlésszögben történő megtekintése a 3D alakra vonatkozó információk elérése érdekében (van Antwerpen and Gilkey, 1994). Kriogén elektrontomográfia (cryo-ET) is lehet használni, hanem elérni 3D képek (Le Bihan et al., 2009). A Cryo-TEM alacsonyabb dózisú elektronokat is használ, ami azt jelenti, hogy gyakran alacsonyabb felbontással rendelkezik más módszerekhez képest (Bibi et al., 2011; Kuntsche et al., 2011). A leletek még mindig lehetségesek az amorf jég vékony filmjének kialakulása és a filmképződés során nyíróerőket alkalmazó mintán történő blotting használata miatt (Almgren et al., 2000; Bibi et al., 2011).
környezeti pásztázó elektronmikroszkópia (ESEM)
környezeti pásztázó elektronmikroszkópia (ESEM) olyan képalkotó rendszer, amely nem igényli a vezikulumok rögzítését, festését vagy fagyasztását, és lehetővé teszi a nedves rendszerek dinamikus változásainak képalkotását korábbi mintaelőkészítés nélkül (Muscariello et al., 2005; Ruozi et al., 2011). Az ESEM fő jellemzője a vízgőz jelenléte a mikroszkóp kamrában. Az a képesség, hogy fenntartsák a víztartalmú légkör a minta körül, hogy részben vagy akár teljesen hidratált tette lehetővé a használata egy több rekeszű, fokozatos vákuum rendszer, amely lehetővé teszi a képalkotó kamra tartható nyomáson akár 55 hPa (Bibi et al., 2011; Ruozi et al., 2011). Az elsődleges elektronsugár másodlagos elektronokat generálhat, amelyek ezután gőzmolekulákkal találkoznak, ami a jel kaszkáderősítéséhez vezet, mielőtt elérné az érzékelőt. Emiatt az ESEM nem igényel minta előkészítést (Muscariello et al., 2005). Ez a technika lehetővé teszi a minta környezetének változását nyomás, hőmérséklet és gázkompozíciók sorozatán keresztül (Mohammed et al., 2004), amely hasznos annak meghatározásakor, hogy a környezeti változások hogyan befolyásolják a hólyagokat. Ez alkalmazható nanofarmakológiai formulációs és stabilitási vizsgálatokra (Bibi et al., 2011). Az ESEM-et a liposzómák kétrétegébe történő gyógyszerterhelés elemzésére is használták (Mohammed et al., 2004), valamint a hólyagok méretének és alakjának meghatározása. Az ESEM korlátozása az, hogy nem tud részletes információt szolgáltatni a nanoméretű szerkezetek lamellaritásáról és belső felépítéséről (Ruozi et al., 2011).
atomi Force Microscopy (AFM)
Atomic force microscopy (AFM), más néven scanning-force microscopy (SFM), egy olyan típusú szkennelés szonda mikroszkóp technika. Úgy működik, hogy egy konzolhoz és érzékelőhöz rögzített éles hegyet futtat a minta felületén, és megméri a szonda és a minta közötti felületi erőket (Sitterberg et al., 2010). Mivel a konzol a minta felületén fut, felfelé és lefelé mozog a felületi jellemzők miatt, és a konzolos ennek megfelelően elhajlik. Ezt az eltérést általában optikai érzékelővel számszerűsítik, a lézersugár a konzol hátulján tükröződik a fényérzékelőre (Sitterberg et al., 2010). Az AFM-nek nem kell vákuumban működnie, és környezeti levegőben vagy folyadék alatt működhet; ezért egyre inkább biológiai minták, valamint nanorészecskék (Liang et al., 2004a, b; Ruozi et al., 2005, 2009). AFM kiemelkedő felbontású a sorrendben frakciók egy nanométer, és tud nyújtani egy 3D kép liposzómák mellett részleteket morfológia, méreteloszlás, homogenitás ,és a stabilitás (Liang et al., 2004a, b; Ruozi et al., 2005, 2007, 2009). Fontos, hogy az AFM használható a liposzómák felületi módosításainak jellemzésére és a liposzómális membrán felületén konjugált ligandumok (pl. antitestek és polimerek) kimutatására (Bendas et al., 1999; Moutardier et al., 2003; Anabousi et al., 2005; Liang et al., 2005). Például Bendas et al. használt AFM magasztalja a liposzómás membrán határ, valamint képesek voltak kép trimeric struktúrák, körülbelül 8-10 nm átmérőjű, ami azt jelenti, hogy a tengelykapcsoló az IgG antitestek a liposome felület (Bendas et al., 1999). Az eredmények azt mutatták, hogy a hatékonysága a technika nagymértékben függ a ragozás használt módszer, a konjugált antitesteket közvetlenül a liposzómás felület látható a AFM (korlátozott fehérje mobilitás), összehasonlítva antitestek csatolt PEG láncok. Arra utaltak, hogy a PEG-láncok magas fehérjemobilitást okoztak, ezért nem voltak képesek beolvasni (Bendas et al., 1999). Ezzel szemben Anabousi et al kimutatta, hogy a pegilált lipidek beépítése a liposzómákba szterikus stabilizációt váltott ki a gömb alakú liposzómákkal (Anabousi et al., 2005). A nem konjugált liposzómák felületének AFM-képei simák voltak, nem lehetett struktúrákat megfigyelni, míg a Transzferrinnek a pegilált liposzómák felületére történő konjugációját kis gömbszerkezetekként (Anabousi et al., 2005). Hasonlóképpen, a Moutardier et al polimer magokkal (LSP) liposzómákat gyártott, amelyek polimer részecskékbe töltött gyógyszerekből álltak, amelyek a lipid vezikulumok magját képezték (Moutardier et al., 2003). Az AFM alkalmazásával készített képek egy polimer hálózat jelenlétét mutatták a külső felületen, amely azt sugallta, hogy a kollagén polimer mag sugárzott, és felületi réteget képezett az LSP-n (Moutardier et al., 2003). A felületi szerkezeti részletek mellett az AFM erőmérésekkel (Ruozi et al., 2007). Például Mao et al. ezt a technikát használta a liposzómák rugalmasságának és tapadási tulajdonságainak felmérésére (Mao et al., 2004). Az AFM egyik korlátozása annak szükségessége, hogy a nanorészecskéket a tartófelületekre, például csillámra vagy szilícium ostyákra adszorbeálják. A liposzómák szilárd szubsztrátumra történő adszorpciója képes módosítani a hólyagok méretét és alakját, ami laposabbá teszi őket. (Ruozi et al., 2007). Ezenkívül a szondacsúcs időszakos érintkezése húzhatja a liposzómákat, amikor a mintában lévő vezikulumokon mozog (Jass et al., 2000). Ennek ellenére az AFM még mindig hasznos eszköz a liposzómák értékelésében.
következtetés
a liposzómák morfológiájának értékelésére számos képalkotó technika áll rendelkezésre, mindegyiknek megvannak a maga előnyei és hátrányai. A fénymikroszkópia a nagyobb hólyagok méretére és alakjára, valamint a minta homogenitására vonatkozó általános adatokat viszonylag gyorsan képes megadni. Ezzel szemben a TEM a leggyakrabban használt technika a liposzómák morfológiájának sokkal részletesebb vizsgálatára; az eredmények értelmezésekor azonban figyelembe kell venni az egyes TEM altípusoknál a festés és/vagy a vákuumfeltételeknek való kitettség miatt bekövetkező szerkezeti változások lehetőségét. Az ESEM a leghasznosabb a liposzomális változások meghatározására a környezetre adott válaszként, míg az AFM hasznos módszerként jelenik meg a nanorészecskék morfológiai elemzésében, és maximális felbontást biztosít a liposzomális felületen. Mind az AFM, mind a TEM képesek a liposzómák felületére konjugált ligandumok képalkotására, és kiegészítő információkat szolgáltatnak a felületi módosításokról. Összességében a technika megválasztása attól függ, hogy milyen morfológiai jellemzőkre és részletességi fokokra van szükség. Ezenkívül fontos az egyes képalkotó technikák mintaelőkészítési módszerének lehetséges hatásainak megértése a kiválasztási folyamatban.
szerzői hozzájárulások
kézirat elkészítése: a-LR és SH. A cikk kritikai felülvizsgálata fontos szellemi tartalomért: SH, PD, JF, WP, AM, DS és AW.
összeférhetetlenségi nyilatkozat
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
Köszönetnyilvánítás
A szerzők köszönetet szeretnék mondani A Gyógyszertár Kutatási Bizalmát, Új-Dél-Wales, A Rebecca L. Cooper Orvosi Kutatási Alapítvány, a Gladys M. Brawn Ösztöndíj, ausEE Kutatási Alapítvány, valamint A University of Newcastle-a pénzügyi támogatást nyújt a kutatás.
Adler, K., and Schiemann, J. (1985). A liposzómák jellemzése elektronmikroszkópos vizsgálattal és a fagyás-törés technikával. Mikron Mikroszkóp. Acta 16, 109-113. doi: 10.1016/0739-6260(85)90039-5
CrossRef Full Text / Google Scholar
Almgren, M., Edwards, K., and Karlsson, G. (2000). A liposzómák és a kapcsolódó struktúrák krio transzmissziós elektronmikroszkópos vizsgálata. Colloids Surf. Egy Fizikus. Eng. Asp. 174, 3–21. doi: 10.1016 / S0927-7757 (00)00516-1
CrossRef teljes szöveg | Google Scholar
Anaboussi, S., Laue, M., Lehr, C. M., Bakowsky, U., és Ehrhardt, C. (2005). A liposzómák transzferrin-módosításának vizsgálata atomi erőmikroszkóppal és transzmissziós elektronmikroszkóppal. Eur. J. Pharm. Biopharm. 60, 295–303. doi: 10.1016 / j.ejpb.2004.12.009
P>PubMed Abstract | CrossRef teljes szöveg | Google Scholar
Bagatolli, L. A. (2009). Membránok és fluoreszcens mikroszkópia. Vélemények a fluoreszcencia 2007. New York, NY: Springer, 33-51. doi: 10.1007 / 978-0-387-88722-7_2
CrossRef teljes szöveg | Google Scholar
Bakker-Woudenberg, I. A., Storm, G., és Woodle, M. C. (1994). Liposzómák a fertőzések kezelésében. J. Drog Célpont. 2, 363–371. doi: 10.3109/10611869408996811 P>PubMed Abstract | CrossRef teljes szöveg/Google Scholar
Bendas, G. (2001). Immunoliposzómák: ígéretes megközelítés a rákterápia célzására. 15. perc: 215-224. doi: 10.2165 / 00063030-200115040-00002
CrossRef teljes szöveg / Google Scholar
Bendas, G., Krause, A., Bakowsky, U., Vogel, J., and Rothe, U. (1999). Az új immunoliposzómák célszerűsége, amelyet egy új antitest konjugációs technikával készítenek. Int. J. Pharm. 181, 79–93. doi: 10.1016/S0378-5173(99)00002-2
PubMed Abstract | CrossRef teljes szöveg | Google Scholar
Bibi, S., Kaur, R., Henriksen-Lacey, M., McNeil, S. E., Wilkhu, J., Lattmann, E., et al. (2011). A liposzómák mikroszkópos képalkotása: a burkolatoktól a környezeti SEMIG. Int. J. Pharm. 417, 138–150. doi: 10.1016 / j. ipharm.2010.12.021
P > PubMed Abstract / CrossRef Full Text / Google Scholar
Bouvrais, H., Pott, T., Bagatolli, L. A., Ipsen, J. H., and Meleard, P. (2010). A membránhoz rögzített fluoreszkáló szondák hatása a lipid bilayerek mechanikai tulajdonságaira. Biochim. Biofizika. Acta 1798, 1333-1337. doi: 10.1016 / j. bbamem.2010.03.026
P>PubMed Abstract | CrossRef Full Text | Google Scholar
Cullis, P. R., Chonn, A., and Semple, S. C. (1998). Liposzómák és lipid alapú hordozórendszerek kölcsönhatása vérfehérjékkel: az in vivo clearance viselkedéshez való viszony. ADV. Gyógyszer Deliv. 32. perc: 3-17. doi: 10.1016/S0169-409x(97)00128-2
PubMed Abstract | CrossRef teljes szöveg | Google Scholar
Ding, B. S., Dziubla, T., Shuvaev, V. V. V., Muro, S., és Muzykantov, V.R. (2006). Fejlett gyógyszeradagoló rendszerek, amelyek az érrendszeri endotheliumot célozzák meg. Mol. Interv. 6, 98–112. doi: 10.1124 / mi.6.2.7
P > PubMed Abstract / CrossRef teljes szöveg | Google Scholar
Henry, C. R. (2005). A támogatott nanorészecskék morfológiája. Prog. Szörfözni. Sci. 80, 92–116. doi: 10.1016 / j. progsurf.2005.09.004
CrossRef teljes szöveg | Google Scholar
Hua, S. (2013). A gyulladás célpontjai: intercelluláris adhéziós molekula-1, mint az új gyulladásos terápiák célpontja. Elöl. Farmakol. 4:127. doi: 10.3389 / ffar.2013.00127
P>PubMed Abstract | CrossRef Full Text | Google Scholar
Hua, S., Marks, E., Schneider, J. J., and Keely, S. (2015). Az orális nano-szállítási rendszerek fejlődése a vastagbél célzott gyógyszeradagolásában gyulladásos bélbetegségben: szelektív célzás a beteghez az egészséges szövethez képest. Nanomedicin 11, 1117-1132. doi: 10.1016 / j.nano.2015.02.018
P>PubMed Abstract | CrossRef teljes szöveg | Google Scholar
Hua, S., and Wu, S. Y. (2013). Lipid alapú nanokarrierek alkalmazása célzott fájdalomterápiákhoz. Elöl. Farmakol. 4:143. doi: 10.3389 / ffar.2013.00143
P>PubMed Abstract / CrossRef teljes szöveg / Google Scholar
Ishida, T., Harashima, H., and Kiwada, H. (2001). Liposzómák kölcsönhatása in vitro és in vivo sejtekkel: opsonins and receptors. Curr. Drug Metab. 2, 397–409. doi: 10.2174/1389200013338306
PubMed Abstract | CrossRef Full Text | Google Scholar
Jass, J., Tjarnhage, T., and Puu, G. (2000). From liposomes to supported, planar bilayer structures on hydrophilic and hydrophobic surfaces: an atomic force microscopy study. Biophys. J. 79, 3153–3163. doi: 10.1016/S0006-3495(00)76549-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Klymchenko, A. S., Oncul, S., Didier, P., Schaub, E., Bagatolli, L., Duportail, G., et al. (2009). A lipiddomének vizualizálása óriás unilamelláris vezikulákban egy 3-hidroxiflavon alapú környezetérzékeny membránszondával. Biochim. Biofizika. Acta 1788, 495-499. doi: 10.1016 / j. bbamem.2008.10.019
P>PubMed Abstract | CrossRef Full Text | Google Scholar
Kuntsche, J., Horst, J. C., and Bunjes, H. (2011). Kriogén transzmissziós elektronmikroszkópia (cryo-TEM) a kolloid gyógyszeradagoló rendszerek morfológiájának tanulmányozására. Int. J. Pharm. 417, 120–137. doi: 10.1016 / j. ipharm.2011.02.001
PubMed Abstract / CrossRef teljes szöveg / Google Scholar
Le Bihan, O., Bonnafous, P., Marak, L., Bickel, T., Trepout, S., Mornet, S., et al. (2009). A nanorészecske transzmigrációjának krioelektron tomográfiája liposzómává. J. Struct. Biol. 168, 419–425. doi: 10.1016 / j. jsb.2009.07.006
P>PubMed Abstract / CrossRef teljes szöveg / Google Scholar
Liang, X., Mao, G., and Ng, K. Y. (2004a). A koleszterin tartalmú liposzóma mechanikai tulajdonságai és stabilitása csillámon atomi erőmikroszkóppal. J. Kolloid Interfész Sci. 278, 53–62.
PubMed Abstract / Google Scholar
Liang, X., Mao, G., and Ng, K. Y. (2005). A PEO-PPO-PEO lánchosszának hatása a kis unilamelláris liposzóma morfológiájára és stabilitására: AFM vizsgálat. J. Kolloid Interfész Sci. 285, 360–372. doi: 10.1016 / j. jcis.2004.11.042
P>PubMed Abstract | CrossRef Full Text | Google Scholar
Liang, X., Mao, G., and Simon Ng, K. Y. (2004b). Kis unilamelláris EggPC hólyagok vizsgálata a csillám felszínén atomi erő mikroszkóppal. Colloids Surf. Balmazújváros 34, 41-51.
PubMed Abstract / Google Scholar
Mao, G., Liang, X., and Ng, K. Y. S. (2004). Encyclopedia of Nanoscience and Nanotechnology. New York, NY: Marcel Dekker.
Google Scholar
Mastrobattista, E., Koning, G. A., And Storm, G. (1999). Immunoliposzómák a tumorellenes gyógyszerek célzott szállítására. ADV. Gyógyszer Deliv. Rev.40, 103-127. doi: 10.1016 / S0169-409x(99) 00043-5
CrossRef teljes szöveg / Google Scholar
Mertins, O., és Dimova, R. (2013). Betekintés a kitozán foszfolipid vezikulákkal való kölcsönhatásaira. II. rész: membránmerevedés és pórusképződés. Langmuir 29, 14552-14559. doi: 10.1021/la4032199 P>PubMed Abstract | CrossRef teljes szöveg/Google Scholar
Metselaar, J. M., and Storm, G. (2005). Liposzómák gyulladásos rendellenességek kezelésében. Szakértő Opin. Drug Deliv. 2, 465–476. doi: 10.1517/17425247.2.3.465
PubMed Abstract / CrossRef teljes szöveg / Google Scholar
Mohammed, A. R., Weston, N., Coombes, A. G., Fitzgerald, M., and Perrie, Y. (2004). A rosszul vízben oldódó gyógyszerek liposzómás összetétele: a gyógyszerterhelés optimalizálása és a stabilitás ESEM elemzése. Int. J. Pharm. 285, 23–34. doi: 10.1016 / j. ipharm.2004.07.010
P>PubMed Abstract / CrossRef Full Text / Google Scholar
Moutardier, V., Tosini, F., Vlieghe, P., Cara, L., Delpero, J. R., and Clerc, T. (2003). Kolloid rákellenes gyógyszerek biohasznosulhatóságok orális adagolási modellekben. Int. J. Pharm. 260, 23–38. doi: 10.1016 / s0378-5173(03)00231-X
P> PubMed Abstract | CrossRef teljes szöveg | Google Scholar
Murphy, D. B., and Davidson, M. W. (2012a). Konfokális Lézerszkennelő Mikroszkópia. A Fénymikroszkópia és az elektronikus képalkotás alapjai, 2. Edn. Hoboken, NJ: John Wiley & Sons, 265-305. doi: 10.1002 / 9781118382905.ch13
CrossRef teljes szöveg | Google Scholar
Murphy, D. B., and Davidson, M. W. (2012b). Fluoreszcens Mikroszkópia. A Fénymikroszkópia és az elektronikus képalkotás alapjai. Weinheim: John Wiley & Sons, 199-231. doi: 10.1002 / 9781118382905. ch11
CrossRef teljes szöveg | Google Scholar
Murphy, D. B., and Davidson, M. W. (2012c). A Fénymikroszkópia és az elektronikus képalkotás alapjai. Hoboken, NJ: John Wiley & Sons, 1-19. doi: 10.1002/9781118382905
CrossRef teljes szöveg | Google Scholar
Murphy, D. B., and Davidson, M. W. (2012d). Polarizációs Mikroszkópia. A Fénymikroszkópia és az elektronikus képalkotás alapjai. Hoboken, NJ: John Wiley & Sons, 153-171. doi: 10.1002 / 9781118382905. ch9
CrossRef teljes szöveg | Google Scholar
Muscariello, L., Rosso, F., Marino, G., Giordano, A., Barbarisi, M., Cafiero, G., et al. (2005). Kritikus áttekintés az ESEM alkalmazásokról a biológiai területen. J. Cell. Physiol. 205, 328–334. doi: 10.1002 / jcp.20444
P > PubMed Abstract / CrossRef teljes szöveg / Google Scholar
Nallamothu, R., Wood, G. C., Pattillo, C. B., Scott, R. C., Kiani, M. F., Moore, B. M., et al. (2006). A tumor vasculature célzott liposzóma szállítási rendszer combretastatin A4: tervezés, jellemzése, in vitro értékelés. AAPS PharmSciTech 7: E32. doi: 10.1208/pt070232 P>PubMed Abstract | CrossRef teljes szöveg/Google Scholar
Nirale, N. M., Vidhate, R. D., and Nagarsenker, M. S. (2009). Flutikazon-propionát liposzómák a pulmonalis szállításhoz. Indiai J. Pharm. Sci. 71, 709–711.
Google Scholar
Orlova, E. V., Sherman, M. B., Chiu, W., Mowri, H., Smith, L. C., and Gotto, A. M. Jr. (1999). Three-dimensional structure of low density lipoproteins by electron cryomicroscopy. Proc. Natl. Acad. Sci. U.S.A. 96, 8420–8425. doi: 10.1073/pnas.96.15.8420
CrossRef Full Text | Google Scholar
Ruozi, B., Belletti, D., Tombesi, A., Tosi, G., Bondioli, L., Forni, F., et al. (2011). AFM, ESEM, TEM, and CLSM in liposomal characterization: a comparative study. Int. J. Nanomedicine 6, 557–563. doi: 10.2147/IJN.S14615
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruozi, B., Tosi, G., Forni, F., Fresta, M. és Vandelli, M. A. (2005). Atomi erő mikroszkópia és foton korrelációs spektroszkópia: két technika a liposzómák gyors jellemzésére. Eur. J. Pharm. Sci. 25, 81–89. doi: 10.1016 / j. ejps.2005.01.020
P>PubMed Abstract | CrossRef Full Text | Google Scholar
Ruozi, B., Tosi, G., Leo, E., and Vandelli, M. A. (2007). Atomi erőmikroszkópia alkalmazása a liposzómák gyógyszerként és génhordozóként történő jellemzésére. Talanta 73., 12-22. doi: 10.1016 / j.talanta.2007.03.031
PubMed Abstract / CrossRef teljes szöveg / Google Scholar
Ruozi, B., Tosi, G., Tonelli, M., Bondioli, L., Mucci, A., Forni, F., et al. (2009). AFM fázisú képalkotás lágy hidratált minták: sokoldalú eszköz a liposzómák kémiai-fizikai vizsgálatának befejezéséhez. J. Liposzóma Res. 19, 59-67. doi: 10.1080 / 08982100802584071
P > PubMed Abstract / CrossRef teljes szöveg / Google Scholar
Sawant, R. R., and Torchilin, V. P. (2012). Kihívások a célzott liposzomális terápia fejlesztésében. AAPS J. 14, 303-315. doi: 10.1208 / s12248-012-9330-0
PubMed Abstract / CrossRef Full Text / Google Scholar
Senior, J. H. (1987). A liposzómák sorsa és viselkedése in vivo: a kontrolling tényezők áttekintése. Crit. Rev. Ther. Drog Hordozó Syst. 3, 123–193.
PubMed Abstract / Google Scholar
Sercombe, L., Veerati, T., Moheimani, F., Wu, S. Y., Sood, A. K., and Hua, S. (2015). A liposzóma által támogatott gyógyszeradagolás előrehaladása és kihívásai. Elöl. Farmakol. 6:286. doi: 10.3389 / ffar.2015.00286
CrossRef Full Text | Google Scholar
Severs, N. J. (2007). Freeze-fracture electron microscopy. Nat. Protoc. 2, 547–576. doi: 10.1038/nprot.2007.55
PubMed Abstract | CrossRef Full Text | Google Scholar
Sitterberg, J., Ozcetin, A., Ehrhardt, C., and Bakowsky, U. (2010). Utilising atomic force microscopy for the characterisation of nanoscale drug delivery systems. Eur. J. Pharm. Biopharm. 74, 2–13. doi: 10.1016/j.ejpb.2009.09.005
PubMed Abstract / CrossRef teljes szöveg / Google Scholar
Torchilin, V. P. (1994). Immunoliposzómák és pegilált immunoliposzómák: képalkotó szerek célzott beadására alkalmazható. Immunomethods 4, 244-258. doi: 10.1006 / immu.1994.1027
P> PubMed Abstract | CrossRef teljes szöveg | Google Scholar
van Antwerpen, R., and Gilkey, J. C. (1994). A krioelektron-mikroszkópia emberi kis sűrűségű lipoprotein szubsztrátumot tár fel. J. Lipid Res. 35, 2223-2231.
PubMed Abstract | Google Scholar
Wang, X., Song, Y., Su, Y., Tian, Q., Li, B., Quan, J., et al. (2015). Are PEGylated liposomes better than conventional liposomes? A special case for vincristine. Drug Deliv. 29, 1–9. doi: 10.3109/10717544.2015.1027015
PubMed Abstract | CrossRef Full Text | Google Scholar
Weisman, S., Hirsch-Lerner, D., Barenholz, Y., and Talmon, Y. (2004). Nanostructure of cationic lipid-oligonucleotide complexes. Biophys. J. 87, 609–614. doi: 10.1529/biophysj.103.033480
P > PubMed Abstract / CrossRef Full Text / Google Scholar
Willis, M., and Forssen, E. (1998). Ligand-célzott liposzómák. ADV. Gyógyszer Deliv. Rev.29, 249-271. doi: 10.1016 / S0169-409x(97)00083-5
CrossRef teljes szöveg | Google Scholar
Zununi Vahed, S., Salehi, R., Davaran, S., and Sharifi, S. (2017). Liposzómaalapú gyógyszeradagoló rendszerek a rákos sejtekben. Mater. Sci. Eng. C Mater. Biol. Appl. 71, 1327–1341. doi: 10.1016 / j. msec.2016.11.073
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply