Határok Onkológiai
Bevezető
25% – a korai emlőrák betegek még mindig élmény helyi kiújulás fejleszteni távoli áttétek után aktív kezelés (1), majd közel 10% – a betegek vagy a IV-es stádiumban a betegség a kezdeti diagnózis a fejlett világban, ami a továbbiakban, de novo áttétes emlőrák (MBC) (2). A kezelés előrehaladása ellenére az MBC gyógyíthatatlan marad, az MBC-betegek 70-80% – a 5 éven belül meghal a rákban (2). Az MBC heterogenitása következtében prognosztikai tényezőkön vagy pontszámokon alapuló több prognosztikai modellt fejlesztettek ki klinikai eredményeik és közvetlen klinikusaik előrejelzésére a megfelelő terápiás döntések meghozatalához (3-5). Ezenkívül számos prognosztikai modell létezik az agymetasztázisos emlőrákra (bcbm) a klinikusok számára, hogy pontosan megjósolják a túlélést ezekben a betegekben (6, 7).
Mell rák áttétet bárhol a szervezetben, de elsősorban áttétet, hogy a tüdő, csont, máj, nem hónalji nyirokcsomók, valamint agy (8). Nevezetesen, a májmetasztázis (lm) nemcsak gyakori metasztatikus hely, hanem az agyi metasztázishoz hasonló jelentősen megnövekedett halálozási kockázattal is jár, ami aránytalanul magasabb mortalitást jelent a tüdő-vagy csontmetasztázisokhoz képest (5, 8). Mivel a bcbm-ben szenvedő betegeknél széles körben elfogadott a fokozatos prognosztikai értékelés (GPA), a fent említett prognosztikai modellek arra ösztönöznek bennünket, hogy gyakorlati modellt javasoljunk a BCLM számára (3-7). Célunk az volt, hogy megbízható és felhasználóbarát prognosztikai modellt hozzunk létre a BCLM számára, valamint hogy értékeljük annak konkordanciáját és pontosságát mind belsőleg, mind külsőleg validálva. A prognosztikai modell segíthet a klinikusoknak megbecsülni a BCLM-ben szenvedő betegek halálozási kockázatát, és kiválasztani az optimális kezelést.
betegek és módszerek
betegek kiválasztása
ezt a vizsgálatot a FUSCC független etikai bizottságai hagyták jóvá. A FUSCC-ben 2007 januárjától 2018 decemberéig diagnosztizált egymást követő MBC-betegeket azonosítottak (n = 9062). A támogathatósági kritériumok a következők voltak: (1) szövettanilag igazolt mellrák, (2) női betegek, (3) a máj, mint a metasztatikus betegség első helye a de novo metasztatikus vagy visszatérő emlőrákban, és (4) teljes és részletes feljegyzések. A kétoldali emlőrákban, egyéb invazív daganatokban vagy ismeretlen nyomon követésben szenvedő betegeket kizárták. Végül 1022 jogosult beteget választottak ki további elemzésre. A kiválasztás teljes lépéseit az S1 ábra mutatja.
változók tanulmányozása és a vágási értékek kiválasztása
információkat gyűjtöttek a következő klinikai kórszövettani változókról: életkor, molekuláris altípusok, előzetes kezelési információk (műtét és szisztémás kemoterápia), MPI, extrahepatikus metasztázisok (agy, tüdő, csont és nyirokcsomók), májmetasztázisok jellemzői (Eloszlás, szám, maximális átmérő), hemoglobin (HB), májfunkciós vizsgálatok és túlélési idő. A molekuláris altípusok közé tartozott a hormonreceptor (HR) és a humán epidermális növekedési faktor receptor 2 (HER2) státusz. Az MPI-t az elsődleges emlőrák diagnózisának időpontja és az első távoli metasztázis időpontja közötti intervallumként határoztuk meg. Az ebben a vizsgálatban alkalmazott MPI vágási pontjai 3 és 24 hónap voltak a referenciaérték szerint (9). Ezért a betegek három csoportra oszthatók: de novo MBC-ben szenvedő betegek (MPI < 3 hónap), rövid MPI-ben szenvedő betegek (≤ 24 hónap), és hosszú mpi-vel rendelkező betegek > 24 hónap. A távoli nyirokcsomó-metasztázist az ipsilaterális axilláris, supraclavicularis, infraclavicularis vagy belső emlőcsomók metasztázisaként határozták meg. Az LM diagnózisa radiográfiai képalkotáson vagy kóros bizonyítékokon alapult. A májmetasztázis jellemzőit hasi számítógépes tomográfia( CT), mágneses rezonancia képalkotás (MRI) vagy sebészeti reszekciós minták segítségével értékelték. A májfunkciós vizsgálatokat is elemezte a jelen tanulmány, beleértve az összes bilirubin, az alanin-aminotranszferáz (ALT), aszpartát-aminotranszferáz (AST), alkalikus foszfatáz (ALP), a laktát-dehidrogenáz (LDH), valamint a γ-glutamil-transzferáz, hogy albumin arány (GAR). A laboratóriumi vizsgálatokhoz vérmintákat vettek az LM diagnózisát követő 1 héten belül. A májmetasztázisok és az LDH eloszlásának, számának vagy maximális átmérőjének osztályozása más vizsgálatokon (10-13) alapult. A HB, az összbilirubin, az ALT, az AST és az ALP határértékeit a nemkívánatos események közös terminológiai kritériumai (CTCAE) szerint határozták meg, mivel a hemoglobinszint vagy a májfunkció mérsékelt vagy II.fokú rendellenességei befolyásolhatják a terápiás választásokat (14). A GAR értékét a szerumin-glutamil transzferáz (GGT, U/L) és a szérum albumin (ALB g/L) szint közötti egyszerű arányként határozták meg. A metasztázis időpontjától kezdve az LM diagnózisától a halálig bármilyen okból mértük. Az utolsó nyomon követési időszak 2019 novemberében volt, medián követési ideje 18, 63 hónap volt. Ha a betegek elvesztették a nyomon követést, akkor a nyomon követés utolsó napján cenzúrázták.
Statisztikai analízis
a betegeket a 7:3 arányban beállított képzésre (2007-2016, n = 715) és validációra (2016-2018, n = 307) osztották. A gar optimális vágási értékét a Youden index és a vevő működési jellemző görbe (ROC) analízisének (S2 ábra) számításával választottuk ki. Pearson chi-négyzet teszt vagy Fisher pontos teszt használtuk, hogy egy összehasonlítás között kategorikus változók. A Cox arányos veszélyek regressziós modelljeit a visszamenőleges szelekciós módszerrel többváltozós elemzésre és a relatív hazárd kiszámítására használták. A regressziós együtthatókat többváltozós regressziós analízissel számítottuk ki, majd megszoroztuk 10-gyel, és kerekítettük, hogy a végső prognosztikai pontszámokat reprezentáljuk. Bootstrapping használták a belső érvényesítés. Ezután időfüggő ROC-görbéket és kalibrációs parcellákat használtunk a prognosztikai modell megkülönböztetésének és kalibrálásának értékelésére az érvényesítési készletben. A kockázati csoportok vágási értékeit X-csempe parcellák határozták meg (15). A túlélési analízist Kaplan-Meier túlélési görbékkel végezték, és log-rank teszteket alkalmaztak a túlélési görbék összehasonlítására. Minden p-érték kétoldalas volt, és a p < 0, 05 értékeket statisztikailag szignifikánsnak tekintették. A statisztikai elemzést SPSS szoftver (SPSS 20, Chicago, IL, USA) és R szoftver 4.0.1 verziójával végezték.
eredmények
jellemzők és összefüggés a kockázati rétegződéssel
összesen 1022, ebben a vizsgálatban kiválasztott beteget osztottak képzési (n = 715) és validációs (n = 307) csoportokra. A klinikai kórszövettani jellemzők leírását az 1.táblázat és az S1. táblázat tartalmazza. A képzési csoportban 126, de novo MBC-vel diagnosztizált beteg (17,6%) és 589, visszatérő MBC-vel rendelkező beteg (82,4%) volt, ebből 297 beteg (50,4%) rövid mpi-vel, 292 beteg (49,6%) pedig hosszú mpi-vel rendelkezett. Medián életkor a diagnózis lm volt 50 (tartomány 21-87) év 617 beteg (86.3%) 60 évnél fiatalabb. E betegek közül a HR-pozitív és a HER2-pozitív betegek aránya 62,2, illetve 38,0% volt. Az ismétlődő MBC-s betegek közül szinte minden beteg műtéten esett át az elsődleges daganaton (584, 99, 2%), és (neo)adjuváns kemoterápiát kapott (569, 96, 6%). Minták távoli áttét kimutatta, hogy a leggyakoribb helyszíne extrahepatikus áttét volt csont (42.7%), majd távoli nyirokcsomó (36.1%), tüdő (25.6%), valamint az agy (2.9%). A májmetasztázist diffúz Eloszlás és kis csomók jellemezték, melyek többsége többszörös volt (≥3 metasztázis, 77,3%), de kisebb csomók (≤3 cm, 59,4%), és jobb és bal lebenyeket érintett (74,4%). Az LM korai szakaszában a májfunkció különböző mértékben, de általában enyhe volt. A CTCAE szerint az LDH (36,1%) és a GAR (35,9%) emelkedése érzékeny májműködési zavar indikátoroknak tűnt, és a HB (2,9%), az összbilirubin (2,7%), az ALT (3,6%), az AST (9,5%) és az ALP (3,9%) szintek mérsékelt vagy magasabb eltérései nem voltak gyakoriak. Összehasonlítva az alacsony kockázatú csoport, a közepes, illetve magas kockázatú csoport bemutatott egy magasabb a HR HER2-negatív, rövid MPI, extrahepatikus áttét, máj áttét daganat terhelés, illetve kóros hemoglobin szint, vagy májfunkció (csak Ps ≤ 0.001), ami arra utal, hogy ezek a tényezők hatással lehet a prognózis BCLM.
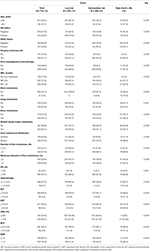
1.táblázat. Kiindulási jellemzők és összefüggése a képzési készlet kockázati rétegződésével.
Prognosztikai Modell Érvényesítési
a többváltozós Cox regressziós modell, molekuláris altípusok (HR HER2 státusz), MPI, helyszínek extrahepatikus áttét (agy, tüdő, csont metasztázis), illetve májfunkciós vizsgálatok (összes bilirubin, LDH, valamint GAR) társult OS (2.Táblázat). Pontosabban, a halál kockázata a HR negatív (HR 1.740, 95% CI 1.424–2.127, P < 0.001), valamint a HER2-negatív (HR 1.615, 95% CI 1.316–1.983, P < 0.001) betegek fokozott képest HR vagy HER2 pozitív társaik. A hossza MPI-k is jelentős hatást gyakorolt a túlélés BCLM betegek, ezért a túlélésre a betegek hosszú MPI-k (HR 1.612, 95% CI 1.195–2.174, P < 0.001) lerövidült képest betegek, de novo MBC, valamint a betegek egy rövid MPI-k (HR 2.563, 95% CI 1.904–3.449, P < 0.001) több mint kétszer annyi, mint a halál rokona őket. Ezenkívül az extrahepatikus metasztázis (agy, tüdő és csontmetasztázis) és a kóros májfunkció (összbilirubin, LDH és GAR) jelenléte mind korrelált az OS-re gyakorolt kedvezőtlen prognosztikai hatással. Ez a prognosztikai modell az időfüggő ROC görbe alatti területe (AUC) volt 1 éves operációs rendszernél, a képzési készletben 0,78, az érvényesítési készletben pedig 0,80 volt, jelezve, hogy ez a modell jó megkülönböztetést mutatott (1.ábra). A bootstrapping módszert alkalmazták a prognosztikai modell stabilitásának megerősítésére a képzési készletben, a végeredmény pedig meglehetősen robusztus volt (S2 táblázat). A prognosztikai modell kalibrációs görbéi 1 évre és 3 évre a képzési készletben, valamint az 1 éves operációs rendszer az érvényesítési készletben jó összhangot mutattak (2.ábra).

2.táblázat. Többváltozós Cox regressziós modell (képzési készlet).
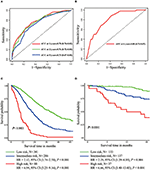
1.ábra. A prognosztikai modell időfüggő ROC görbéi a képzési készletben (a) és a validációs készletben (B). A training (C) és validation set (D) három prognosztikai csoport metasztázisából származó teljes túlélés.
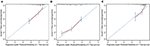
2.ábra. A betegek túlélésének előrejelzésére szolgáló kalibrációs görbe 1 év a) és 3 év B) pontnál a képzési készletben és 1 év C) pontnál az érvényesítési készletben.
kockázati rétegződés és túlélés

3. táblázat. A prognosztikai csoportok pontszámának és vágási pontjainak kiszámítása.
a Vita
a jelen elemzés 1,022 kezelt betegek az intézmény 2007-től 2018-ig, megmutattuk, hogy molekuláris altípusok (HR HER2 státusz), MPI, helyszínek extrahepatikus áttét (agy, tüdő, csont metasztázis), a májfunkciós vizsgálatok (összes bilirubin, LDH, valamint GAR) független prognosztikai tényezők a BCLM betegek. Ezért prognosztikai modellt készítettek a BCLM-es betegek számára prognosztikai tényezők alkalmazásával.
a molekuláris altípusok tekintetében a HR-pozitív azt jelezheti, hogy az emlőrák növekedését és proliferációját még mindig hormonok szabályozzák, úgynevezett hormonfüggő tumorok. Ugyanakkor az endokrin terápia számos előnnyel jár, köztük kevés mellékhatással és tartós hatással, amelyek gyakran hosszú távú túlélési előnyökkel járhatnak a HR-pozitív betegek számára. Ezért a HR-pozitívot jelentős tényezőnek tekintették, amely kedvező prognózist javasol a korai és metasztatikus emlőrákban (1, 3-5, 8-10, 16). Bár a HER2 amplifikáció, valamint fokozott tekinthető előrejelzője a kockázatot, a távoli áttét, valamint a mellrák kapcsolatos halál, ezt követően kifejlesztett anti-HER2 ügynökök méltóan javította a túlélés a HER2-pozitív emlőrákos betegek (2, 9, 17). A célzott terápia korában egy délkelet-hollandiai tanulmány megállapította, hogy a HER2-negatív betegek halálozási kockázata 44%–kal nőtt (95% CI 1, 13-1, 83, P = 0, 003) a HER2 pozitív betegekhez képest (9). Tanulmányunkban a HR-negatív és HER2-negatív betegek halálozási kockázata a HR-vagy HER2-pozitív társaikhoz képest nőtt, összhangban ezekkel a megfigyelésekkel. Azoknál a betegeknél, akiknek rövid MPI-je volt, általában ≤24 hónap, rosszabb prognózissal rendelkeztek (3, 5, 9). Továbbá úgy tűnt, hogy a De novo MBC-s betegek prognózisa szignifikánsan jobb a visszatérő MBC-s betegekhez képest, bár ez a különbség fokozatosan csökkent a betegségmentes intervallum (DFI) vagy az MPI (9, 18, 19) kiterjesztésével. Lobbezoo et al. megállapították, hogy a ≤24 hónapos MPI-ben szenvedő betegeknél szignifikánsan rövidebb volt a túlélési idő (9, 1 vs.29.4 hónapos, P < 0.001), mint a de novo színpadon IV betegségek, de a betegek egy hosszabb MPI-k (>24 hónap) volt egy hasonló prognózis (27.9 vs 29.4 hónap, P = 0.73) (9). A lehetséges ok, amiért ez a jelenség, hogy a betegek a kezelés után MBC korábban átesett rendszeres kezelés lehet, hogy jobban ellenáll a kemoterápia mint terápia-naiv betegek, de novo MBC, de további vizsgálat indokolt (9, 18, 19). Ez a vizsgálat megerősítette, hogy a hosszú MPI-ben szenvedő betegek túlélési ideje lerövidült a de novo MBC-hez képest olyan betegeknél, akiknek rövid MPI-je szignifikánsan rosszabb eredményt eredményezett.
MBC túlélés jelentősen különbözött szerint áttétes oldalak betegek zsigeri áttét volt kapcsolódó fokozott halálozási képest, akik nem zsigeri áttét (3-5, 9, 18). Ezenkívül az agyi metasztázis jelenléte nagyobb hatással volt a túlélésre, mint bármely más metasztatikus hely (3, 5, 9, 18). Nem meglepő, hogy a többszörös metasztázisok kedvezőtlenebb hatással voltak a prognózisra (3, 5, 9, 17, 18). Ebben az elemzésben az extrahepatikus metasztázis, kivéve a távoli nyirokcsomók metasztázisát, rövidített túléléshez vezethet, valószínűleg azért, mert a májmetasztázis kritikus életveszélyes tényező volt a nyirokcsomó metasztázishoz képest.
meg kell jegyezni, hogy a magasabb bilirubinszinttel rendelkező betegeknél több betegség kockázata is jóval alacsonyabb volt, részben antioxidáns és gyulladásgátló tulajdonságai révén (20). Egy nemrégiben készült tanulmány arról is beszámolt, hogy a halálozási kockázat közel 40% – kal csökkent a korai emlőrákos betegek körében, akiknél magasabb az összbilirubinszint (21). A hiperbilirubinémia azonban a BCLM betegek rossz prognózisával társult (22). Lehetséges, hogy, ellentétben viszonylag magasabb összbilirubin között nem metasztatikus emlőrákban szenvedő betegek, emelkedett bilirubin 1,5-szer nagyobb, mint a normál felső határ (NFH) között BCLM betegek lehet megjósolni, súlyos májkárosodás, így hozzájárul a gyógyszer abbahagyása vagy hepatikus encephalopathia.
A Warburg hatás vezet rákos sejtek függ aerob glikolízis még akkor is, amikor az oxigén kínálat elegendő, ami a hallmark a rák anyagcserét, ezzel szemben a normális szövetek (23). Az LDH nélkülözhetetlen szerepet játszik a glikolízisben, mivel képes a piruvátot laktátvá alakítani anaerob körülmények között (24). Az LDH deregulált szintje magasabb tumorterhelést, rosszabb kezelési választ és prognózist tükrözhet, amelyet korábban több daganatban jelentettek (21, 24-26). Az LDH prognosztikai hatásának meta-analízise emlőrákos betegeknél azt mutatta, hogy a magasabb LDH-szint nem kielégítő OS-t és progressziómentes túlélést eredményezett, amely 11, 6102 beteg bevonásával végzett vizsgálatot tartalmazott (27).
GGT, a fő endogén antioxidáns, a prekurzor aminosavakat asszimilálja, és részt vesz a glutation szintézisben (28). GGT a daganatok lehetővé teszi a sejtek gyorsan feltölti glutation, miután megkapta a pro-oxidáns daganatellenes terápia, tehát összefügg a gyógyszer-rezisztencia, illetve a szegény túlélés (29). Érdekes módon, Fentiman et al. beszámoltak arról, hogy szignifikánsan pozitív összefüggést állapítottak meg az emelkedett GGT és az emlőrák kockázata között (30). A máj által szintetizált ALB antioxidánsként, tápanyagok transzportereként működik, és egyedülálló szerkezeti tulajdonságai miatt részt vesz a jelutakban (31). A hypoalbuminaemia általában előrehaladott daganatos betegeknél fordul elő, és különböző mechanizmusoknak tulajdonítható, beleértve a károsodott májszintézist, a megnövekedett katabolizmust és a cachexiát (21, 31). A hipoalbuminémia független mutatója a különböző daganatok rossz prognózisának (21, 22, 32, 33). A szérum albuminszint csökkenésével ellentétben a szérum GGT-szint általában emelkedik, ha a májfunkció károsodott. Ezért GAR alapján a fenti két paraméter lehet az előnye, hogy tükrözze a máj tartalék képességét, és megjósolni a prognózist (32, 33). A jelenlegi vizsgálatban az abnormális májfunkció (összbilirubin, LDH és GAR) mind összefüggésbe hozható az OS-re gyakorolt kedvezőtlen prognosztikai hatással.
123 BCLM beteg prognózisának elemzése után, Duan et al. megállapították, hogy a három vagy több májmetasztázisban szenvedő betegek 2-et hordoztak.26-szor nagyobb a halálozás kockázata a <3 májmetasztázissal rendelkező betegekhez képest többváltozós analízisben (10). A májmetasztázis jellemzői azonban ebben a vizsgálatban nem mutattak különbséget. Ennek az eltérésnek két lehetséges oka van. Először is, a májmetasztázisok eloszlása, száma és maximális átmérője szignifikánsan különbözött a három kockázati csoportban, jelezve, hogy a mortalitás kockázata nőtt a májmetasztázis kiterjesztésével univariate analízisben. Ezt követően a kóros májfunkció szorosan összefüggött a májmetasztázis tumorterhelésével, ezen tényezők többváltozós elemzésben betöltött szerepének beállításával.
számos tanulmány készült prognosztikai tényezőkről a BCLM beállításában. Egy 145 BCLM-es betegen végzett elemzés kimutatta, hogy a hypoalbuminemia, az idősebb kor és az ER negativitás független előrejelzői voltak a rossz túlélésnek (22). Egy görög nyilvántartási elemzés hasonló eredményeket ért el, amelyben a HR pozitivitás, az alacsony szövettani fokozat, az extrahepatikus metasztázis hiánya és a jó teljesítmény státusz jelentős prognosztikai tényezők voltak az univariate analízis kedvező prognózisához (34). Egy, a közelmúltban népesség-alapú tanulmány, amely több mint 4000 betegek, de novo BCLM azonosította demográfiai, társadalmi-gazdasági tényezők, patológiai osztály, teljes száma extrahepatikus áttét, bánásmód, valamint a molekuláris altípus, mint befolyásoló paraméterek teljes túlélés jelentősen (17). Regierer et al. kifejlesztett egy prognosztikai pontszám MBC alapján HR állapota, MPI oldalak áttétek, hogy megjósolja a prognózis, illetve egyénileg optimális kezelés, amely hitelesített belsőleg, mind külsőleg (5). Sajnos a HER2 státusz nem szerepelt a prognosztikai pontszámban, ezért korlátozta annak alkalmazhatóságát. A négy egyszerű klinikai paramétert integráló bcbm-es betegek módosított mell-GPA-ja azonnali szerepet játszott túlélésük előrejelzésében, de nem volt alkalmazható BCLM-es betegek esetében (7). Tudomásunk szerint nincs olyan prognosztikai modell, amely integrálná ezeket a prognosztikai tényezőket a BCLM betegek számára, így modellünk pragmatikus értelme van.
ebben a kutatásban is voltak korlátozások. Először is, az egyközpontú és retrospektív vizsgálat elkerülhetetlenül szelekciós torzítást eredményezett, bár prognosztikai modellünket belsőleg és külsőleg validálták. Másodszor, azokat a betegeket, akiknél a betegség során később májmetasztázis alakult ki, kizárták, így nem tudtuk értékelni ezeket a betegeket. Harmadszor, a teljesítmény állapotára és a kezelésre vonatkozó részletes információk nem álltak rendelkezésre ebben a vizsgálatban.
következtetések
e korlátozások ellenére ez a kutatás egyszerű és megbízható prognosztikai modellt biztosít. Tanulmányunk fő előnye a klinikai gyakorlatban könnyen hozzáférhető paraméterek beépítése a BCLM betegek nagy mintája alapján. A tumorok következő generációs szekvenálási módszerek szerinti finom osztályozása mellett modellünk segíthet a különböző prognózisú alcsoportok azonosításában, valamint a későbbi terápia irányításában.
data Availability Statement
a tanulmányban bemutatott eredeti hozzájárulások szerepelnek a cikkben/kiegészítő anyagban, a további vizsgálatok a megfelelő szerzőhöz / S-hez irányíthatók.
etikai nyilatkozat
ezt a tanulmányt a FUSCC független etikai bizottságai hagyták jóvá. A betegek / résztvevők írásban tájékozott beleegyezésüket adták a vizsgálatban való részvételhez.
szerzői hozzájárulások
LJ javasolta a tanulmányt. Az adatokat az XZ és az YG gyűjtötte. LJ és LF elemezte az adatokat és megírta az első tervezetet. ZW kritikusan áttekintette a kéziratot. Minden szerző hozzájárult a cikkhez, és jóváhagyta a benyújtott verziót.
összeférhetetlenség
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
köszönetnyilvánítások
tudomásul vesszük a Lei Cheng-et az adatelemzés elvégzéséhez.
Kiegészítő anyag
rövidítések
BCLM, májmetasztázisos mellrák; FUSCC, Fudan University Shanghai Cancer Center; ROC, vevő működési jellemző görbe; MPI, metasztatikus-ingyenes intervallum; HR, kockázati arány; CI, konfidencia intervallum; OS, a teljes túlélés; MBC, az áttétes emlőrák; BCBM, mellrák az agyi metasztázis; LM, máj áttét; GPA, osztályozott prognosztikai értékelése; HB, hemoglobin; HR, hormon receptor; HER2, humán epidermális növekedési faktor receptor 2; CT, számítógépes tomográfia; MRI mágneses rezonancia; ALT, az alanin-aminotranszferáz; AST, aszpartát-aminotranszferáz; ALPOK, az alkalikus foszfatáz LDH, a laktát-dehidrogenáz; GAR -, γ-glutamil-transzferáz, hogy albumin arány; GGT, γ-glutamil transzferáz; ALB, albumin; CTCAE, a nemkívánatos események közös terminológiai kritériumai;ULN, a normál felső határ.
4. Puente J, Lopez-Tarruella S, Ruiz A, Lluch A, Pastor M, Alba E, et al. Gyakorlati prognosztikai index metasztatikus visszatérő emlőrákban szenvedő betegek esetében: a GEICAM spanyol El Alamo regiszter 2322 betegének retrospektív elemzése. Mellrák Res Kezelésére. (2010) 122:591–600. doi: 10.1007/s10549–009-0687–4
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Regierer AC, Wolters R, Ufen MP, Weigel A, Novopashenny I, Kohne CH, et al. An internally and externally validated prognostic score for metastatic breast cancer: analysis of 2269 patients. Ann Oncol. (2014) 25:633–8. doi: 10.1093/annonc/mdt539
PubMed Abstract | CrossRef Full Text
6. Marko NF, Xu Z, Gao T, Kattan MW, Weil RJ. A mellrákos és agyi metasztázisban szenvedő nők túlélésének előrejelzése: a nomogram felülmúlja a jelenlegi túlélési előrejelzési modelleket. Rák. (2012) 118:3749–57. doi: 10.1002 / cncr.26716
PubMed Abstract | CrossRef teljes szöveg | Google Scholar
7. Subbiah IM, Lei X, Weinberg JS, Sulman EP, Chavez-MacGregor M, Tripathy D, et al. Mellrákos és agyi áttétes betegek túlélésének eszközeként módosított, mellre Osztályozott prognosztikai értékelés validálása és kifejlesztése. J-Klin-Onkol. (2015) 33:2239–45. doi: 10.1200 / JCO.2014.58.8517
PubMed Abstract | CrossRef teljes szöveg | Google Scholar
9. Lobbezoo DJ, van Kampen RJ, Voogd AC, Dercksen MW, van den Berkmortel F, Smilde TJ, et al. Metasztatikus emlőrák prognózisa: vannak-e különbségek a de novo-ban szenvedő és a visszatérő metasztatikus emlőrákban szenvedő betegek között? Br J Cancer. (2015) 112:1445–51. doi: 10.1038/bjc.2015.127
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Duan XF, Dong NN, Zhang T, Li Q. The prognostic analysis of clinical breast cancer subtypes among patients with liver metastases from breast cancer. Int J Clin Oncol. (2013) 18:26–32. doi: 10.1007/s10147–011-0336-x
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dueck AC, Mendoza TR, Mitchell SA, Reeve BB, Castro KM, Rogak LJ, et al. Az Egyesült Államok Nemzeti Rákkutató Intézetének a nemkívánatos eseményekre vonatkozó közös terminológiai kritériumok (PRO-CTCAE) betegek által jelentett eredményeinek érvényessége és megbízhatósága. JAMA Oncol. (2015) 1:1051–9. doi: 10.1001 / jamaoncol.2015.2639
PubMed Abstract | CrossRef teljes szöveg / Google Scholar
17. Xie J, Xu Z. az újonnan diagnosztizált emlőrákban szenvedő nők Májáttéteiről szóló populáció-alapú vizsgálat. Rák Epidemiol Biomarkerek Előző. (2019) 28:283–92. doi: 10.1158/1055–9965.EPI-18–0591
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Dawood S, Broglio K, Ensor J, Hortobagyi GN, Giordano SH. Survival differences among women with de novo stage IV and relapsed breast cancer. Ann Oncol. (2010) 21:2169–74. doi: 10.1093/annonc/mdq220
PubMed Abstract | CrossRef Full Text
19. den Brok WD, Speers CH, Gondara L, Baxter E, Tyldesley SK, Lohrisch ca. Túlélés metasztatikus emlőrákban a kezdeti prezentáció alapján, de novo versus relapszus. Mellrák Res Kezelésére. (2017) 161:549–56. doi: 10.1007 / s10549–016-4080–9
PubMed Abstract | CrossRef teljes szöveg | Google Scholar
20. Fujiwara R, Haag M, Schaeffeler E, Nies AT, Zanger UM, Schwab M. a bilirubin homeosztázis szisztémás szabályozása: a hiperbilirubinémia potenciális előnyei. Hepatológia. (2018) 67:1609–19. doi: 10.1002/hep.29599
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Liu X, Meng QH, Ye Y, Hildebrandt MAT, Gu J, Wu X. Prognostic significance of pretreatment serum levels of albumin, LDH and total bilirubin in patients with non-metastatic breast cancer. Carcinogenesis. (2015) 36:243–8. doi: 10.1093/carcin/bgu247
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Vander Heiden MG, Cantley LC, Thompson CB. A Warburg-hatás megértése: a sejtproliferáció metabolikus követelményei. Tudomány. (2009) 324:1029–33. doi: 10.1126 / tudomány.1160809
PubMed Abstract | CrossRef teljes szöveg | Google Scholar
24. Mishra D, Banerjee D. Laktát-dehidrogenázok, mint a tumor mikrokörnyezetében a tumor és a stroma közötti metabolikus kapcsolatok. Rákok. (2019) 11:750. doi: 10.3390/cancers11060750
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Pelizzari G, Basile D, Zago S, Lisanti C, Bartoletti M, Bortot L, et al. Lactate dehydrogenase (ldh) response to first-line treatment predicts survival in metastatic breast cancer: first clues for a cost-effective and dynamic biomarker. Cancers. (2019) 11:1243. doi: 10.3390/cancers11091243
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Hopkins AM, Rowland A, McKinnon RA, Sorich MJ. Predictors of long-term disease control and survival for HER2-positive advanced breast cancer patients treated with pertuzumab, trastuzumab, and docetaxel. Front Oncol. (2019) 9:789. doi: 10.3389/fonc.2019.00789
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Pentheroudakis G, Fountzilas G, Bafaloukos D, Koutsoukou V, Pectasides D, Skarlos D, et al. Metasztatikus emlőrák májmetasztázisokkal: 500 nő klinikopatológiai, kezelési és eredményjellemzőinek nyilvántartási elemzése. Mellrák Res Kezelésére. (2006) 97:237–44. doi: 10.1007 / s10549–005-9117–4
PubMed Abstract | CrossRef teljes szöveg / Google Scholar
Leave a Reply