7.2: Chimotripsina
Introduzione
La chimotripsina è uno degli enzimi più studiati grazie alla sua cinetica a due fasi: pre-steady-state e steady state. Lo studio di questi due stati cinetici dà evidenza del meccanismo “Ping-Pong”, della formazione di complessi covalenti che portano a reazioni di idrolisi covalente e della velocità delle reazioni catalizzate. La sintesi della chimotripsina si verifica principalmente nel pancreas. Invece della forma attiva, tuttavia, è prodotto come zymogen inattivo chiamato chymotrypsinogen per impedire la sua attività della proteasi digerire il pancreas. Dopo la secrezione nel lume dell’intestino tenue, viene convertito nella sua forma attiva da un altro enzima chiamato tripsina. Questa dipendenza di un enzima diverso per l’attivazione di una proteasi è un modo comune per il corpo di prevenire la digestione di organi e altri effetti collaterali enzimatici dannosi.
La chimotripsina opera attraverso un meccanismo generale noto come meccanismo di ping-pong (Figura \(\PageIndex{1}\)) in cui l’enzima reagisce con un substrato per formare un intermedio enzimatico. Questo intermedio ha proprietà diverse rispetto all’enzima iniziale, quindi per rigenerare l’attività enzimatica iniziale, deve reagire con un substrato secondario. Questo processo è illustrato di seguito:

Più specificamente, la chimotripsina opera attraverso un particolare tipo di meccanismo di ping-pong chiamato idrolisi covalente. Ciò significa che l’enzima prima forma un legame covalente con il substrato bersaglio, spostando la porzione più stabile in soluzione. Questo complesso enzima-substrato è chiamato intermedio enzimatico. L’intermedio reagisce quindi con l’acqua, che sposta la parte rimanente del substrato iniziale e riforma l’enzima iniziale.
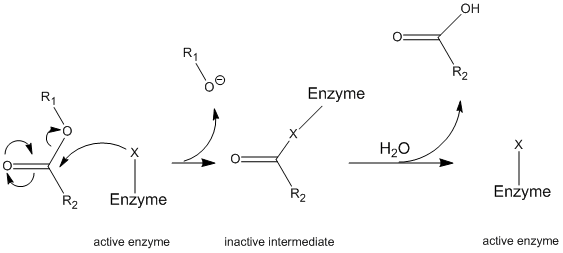
La chimotripsina, come la maggior parte degli enzimi, è specifica nei tipi di substrati con cui reagisce. Come proteasi, scinde i polipeptidi e la sua specificità intrinseca gli consente di agire solo sul carbossi-terminale dei residui aromatici. Si tratta di un meccanismo un po ‘ complicato, ed è meglio spiegato in una serie di passaggi.
1. Il bersaglio entra nel sito attivo della chimotripsina e viene trattenuto da interazioni idrofobiche tra gruppi non polari esposti di residui enzimatici e la catena laterale aromatica non polare del substrato. È importante notare il legame idrogeno tra l’azoto Schiff su istidina-57 e la catena laterale dell’ossigeno di serina-195.
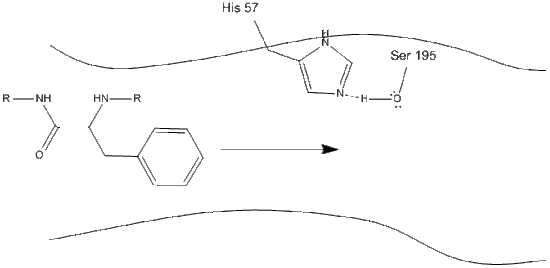
2. Aiutato dal legame idrogeno istidina-serina, il gruppo idrossile su serina-195 esegue un attacco nucleofilo sul carbonio carbonilico di un amminoacido aromatico trasferendo contemporaneamente l’idrogeno idrossile all’azoto Schiff dell’istidina. Questo attacco spinge gli elettroni del carbonile pi sull’ossigeno carbonilico, formando un intermedio di breve durata costituito da un carbonio c-terminale con quattro singoli legami: un anione di ossigeno, il beta-carbonio dell’amminoacido aromatico, l’n-terminale del successivo amminoacido della proteina del substrato e l’ossigeno a catena laterale serina-195.
.gif?revision=1&size=bestfit&width=720&height=192)
3. Questo intermedio è di breve durata, poiché gli elettroni dell’ossianione riformano il legame pi con il c-terminale dell’amminoacido aromatico. Il legame tra il carbossi-terminale dell’amminoacido aromatico e l’n-terminale del residuo successivo viene scisso e i suoi elettroni vengono utilizzati per estrarre l’idrogeno dell’azoto Schiff protonato su istidina-57. I legami tra il carbonio carbonilico e l’ossigeno serina-195 rimangono in una configurazione estere. Questo è chiamato l’intermedio acil-enzima. Il lato c-terminale del polipeptide è ora libero di dissociarsi dal sito attivo dell’enzima.

4. Le molecole d’acqua sono ora in grado di entrare e legarsi al sito attivo attraverso il legame di idrogeno tra gli atomi di idrogeno dell’acqua e l’istidina-57 Schiff azoto.

5. L’ossigeno dell’acqua ora fa un attacco nucleofilo sul carbonio carbonilico dell’intermedio acil-enzima, spingendo gli elettroni pi del carbonile sul carbonio carbonilico mentre l’istidina-57 estrae un protone dall’acqua. Questo forma un altro carbonio quaternario legato covalentemente con serina, un idrossile, un ossianione e l’amminoacido aromatico. Il protone sull’istidina-57 recentemente protonata è ora in grado di creare un legame idrogeno con l’ossigeno della serina.

6. Gli elettroni ossianion riformano il legame carbonilico pi, scindendo il legame tra il carbonio carbonilico e l’idrossile serinico. Gli elettroni in questo legame sono usati dall’ossigeno della serina per deprotonare l’azoto Schiff dell’istidina e riformare l’enzima originale. Il substrato non ha più affinità per il sito attivo e presto si dissocia dal complesso.

Leave a Reply