Chimica organica II

Sperimentalmente, tuttavia, si osserva che esiste una barriera significativa alla rotazione attorno al legame C2-C3 e che l’intera molecola è planare. Inoltre, il legame C2-C3 è lungo 148 pm, più corto di un tipico legame singolo carbonio-carbonio (circa 154 pm), anche se più lungo di un tipico doppio legame (circa 134 pm).
La teoria degli orbitali molecolari spiega queste osservazioni con il concetto di legami pi delocalizzati. In questa immagine, i quattro orbitali atomici 2p si combinano matematicamente per formare quattro orbitali molecolari pi di energia crescente. Due di questi-gli orbitali di legame pi-sono più bassi in energia rispetto agli orbitali atomici p da cui sono formati, mentre due – gli orbitali antibonding pi* – sono più alti in energia.

L’orbitale molecolare a energia più bassa, pi1, ha solo interazione costruttiva e zero nodi. Più alto in energia, ma ancora inferiore agli orbitali p isolati, l’orbitale pi2 ha un nodo ma due interazioni costruttive – quindi è ancora un orbitale di legame nel complesso. Guardando i due orbitali antibonding, pi3 * ha due nodi e un’interazione costruttiva, mentre pi4* ha tre nodi e zero interazioni costruttive.
Con il principio di aufbau, i quattro elettroni degli orbitali atomici 2pz isolati sono collocati nel legame pi1 e pi2 MO. Poiché pi1 include l’interazione costruttiva tra C2 e C3, c’è un grado, nella molecola 1,3-butadiene, di interazione di legame pi tra questi due carboni, che rappresenta la sua lunghezza più breve e la barriera alla rotazione. L’immagine del legame di valenza di 1,3-butadiene mostra i due legami pi come isolati l’uno dall’altro, con ogni coppia di elettroni pi ‘bloccati’ nel proprio legame pi. Tuttavia, la teoria degli orbitali molecolari predice (accuratamente) che i quattro elettroni pi sono in una certa misura delocalizzati, o “sparsi”, sull’intero sistema pi.

1,3-butadiene è l’esempio più semplice di un sistema di legami pi coniugati. Per essere considerati coniugati, due o più legami pi devono essere separati da un solo legame – in altre parole, non ci può essere un carbonio ibridato sp3 intermedio, perché questo romperebbe il sistema di sovrapposizione di orbitali p paralleli. Nel composto sottostante, ad esempio, i doppi legami C1-C2 e C3-C4 sono coniugati, mentre il doppio legame C6-C7 è isolato dagli altri due legami pi da C5 ibridato sp3.

Un concetto molto importante da tenere a mente è che esiste una stabilità termodinamica intrinseca associata alla coniugazione. Questa stabilità può essere misurata sperimentalmente confrontando il calore di idrogenazione di due dieni diversi. (L’idrogenazione è un tipo di reazione che impareremo molto di più nel capitolo 15: essenzialmente, è il processo di aggiunta di una molecola di idrogeno – due protoni e due elettroni – a un legame p). Quando i due doppi legami coniugati di 1,3-pentadiene sono “idrogenati” per produrre pentano, circa 225 kJ viene rilasciato per mole di pentano formato. Confrontalo con i circa 250 kJ / mol rilasciati quando i due doppi legami isolati in 1,4-pentadiene sono idrogenati, formando anche pentano.
La formazione di polimeri sintetici da dieni come 1,3-butadiene e isoprene è discussa nella Sezione 18.5. I polimeri sintetici sono grandi molecole costituite da unità ripetitive più piccole. Probabilmente hai una certa familiarità con un certo numero di questi polimeri; ad esempio, polietilene, polipropilene, polistirene e poli(cloruro di vinile).

Figura 13.6: Diagramma energetico per l’idrogenazione di 1,3-butadiene (non in scala).
Poiché l’idrogenazione di 1,3-butadiene rilascia meno della quantità di energia prevista, il contenuto energetico di 1,3-butadiene deve essere inferiore a quello che ci saremmo aspettati. In altre parole, 1,3-butadiene è più stabile di quanto suggerisca la sua formula.
Il diene coniugato è più basso in energia: in altre parole, è più stabile. In generale, i legami pi coniugati sono più stabili dei legami pi isolati.
Ecco un diagramma di energia che confronta diversi tipi di legami con i loro riscaldamenti di idrogenazione (per mole) per mostrare la stabilità relativa di ciascuna molecola (1 kcal = 4,18 kJ). (Più basso è il calore di idrogenazione (per legame pi), più stabile è la struttura.)
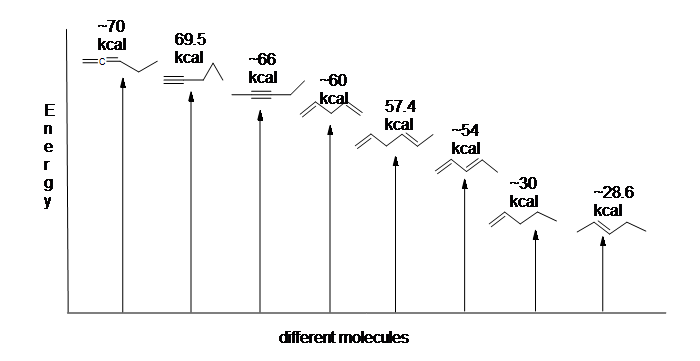
La stabilizzazione dei dieni per coniugazione è meno drammatica della stabilizzazione aromatica del benzene. Tuttavia, la risonanza simile e le descrizioni orbitali molecolari della coniugazione possono essere scritte.
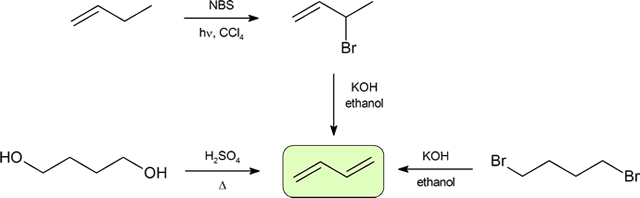
Sintesi di dieni
I due modi più frequenti per sintetizzare i dieni coniugati sono la disidratazione degli alcoli e la deidroalogenazione degli organoalidi, che sono stati introdotti nella preparazione degli alcheni (Sezione 9.9). Il seguente schema illustra alcuni dei percorsi per preparare un diene coniugato.
I sistemi pi coniugati possono coinvolgere atomi di ossigeno e azoto e carbonio. Nel metabolismo delle molecole di grasso, alcune delle reazioni chiave coinvolgono alcheni coniugati a gruppi carbonilici.

La teoria MO è molto utile per spiegare perché le molecole organiche che contengono sistemi estesi di legami pi coniugati hanno spesso colori distintivi. il beta-carotene, il composto responsabile del colore arancione delle carote, ha un sistema esteso di 11 legami pi coniugati.

Esercizi
Esercizio 2.9: Identificare tutti i doppi legami coniugati e isolati nelle strutture sottostanti. Per ogni sistema pi coniugato, specificare il numero di orbitali p sovrapposti e quanti elettroni pi sono condivisi tra di loro.

Esercizio 2.10: Identificare tutti i legami pi isolati e coniugati nel licopene, il composto di colore rosso nei pomodori. Quanti elettroni pi sono contenuti nel sistema pi coniugato?
Leave a Reply