Cosa influenza la dimensione dei gruppi in cui i primati scelgono di vivere?

Uno dei principali contributi teorici fatti studiando i primati è la comprensione di ciò che influenza la natura della variazione complessa nella struttura sociale e nelle organizzazioni. Alla base di questo è un insieme di sviluppi teorici che esaminano perché gli animali vivono in gruppi in primo luogo e perché i gruppi sono di una particolare dimensione. Qui, ci concentriamo sulla domanda di ” cosa influenza la dimensione dei gruppi in cui i primati scelgono di vivere?”
I primati sono taxa particolarmente utili per affrontare questa domanda perché le loro dimensioni del gruppo sono altamente variabili, non solo all’interno, ma anche tra le specie. La dimensione del gruppo intraspecifico per il colobo rosso (Procolobus rufomitratus), ad esempio, varia tra 12 e 150 membri (Chapman & Chapman 2000a). La variazione interspecifica varia da un singolo individuo, come visto negli oranghi (Pongo sp.) (van Schaik 1999), a oltre 800 membri in mandrills (Mandrillus sphinx) (Abernethy et al. 2002). Inoltre, all’interno di alcune specie, i gruppi sociali si dividono e si riuniscono ripetutamente in sottogruppi di diverse dimensioni e combinazioni nel tempo (ad esempio, organizzazione sociale di fusione-fissione delle scimmie ragno (Ateles sp.) e scimpanzé (Pan troglodytes), o l’organizzazione multi-livello di gelada (Theropithecus gelada) e Hamadryas babbuini (Papio hamadryas, Aureli et al. 2008). Questa variazione fornisce le basi per i ricercatori per sviluppare modelli per indagare sia i driver ecologici che sociali della dimensione del gruppo.
Il raggruppamento è vantaggioso in diversi modi. Si pensa che gli individui in gruppi più grandi abbiano un ridotto rischio di predazione (Hamilton 1971), possano essere meglio in grado di trovare e difendere le risorse alimentari (Cody 1971, Wrangham 1980) e possono essere protetti contro la minaccia conspecifica, come l’infanticidio da parte di maschi extra-gruppo (Wrangham 1979). Vari ricercatori hanno suggerito che il raggruppamento conferisce tali benefici prevedibili (Alexander 1974, van Schaik 1983) che le differenze nella dimensione del gruppo possono essere spiegate dagli svantaggi (Wrangham et al. 1993). Si ritiene che il costo potenziale più ampiamente accettato del raggruppamento sia una riduzione dell’efficienza del foraggiamento. Stare con altri individui con le stesse esigenze dietetiche significa che gli animali combattono per il cibo (competizione contest), o un animale in un gruppo batte un altro per il cibo, quindi quando il secondo animale arriva in un’area semplicemente non c’è più cibo (scramble competition, Janson & van Schaik 1988). In entrambe queste situazioni si pensa che la competizione sul cibo porti gli animali a viaggiare più lontano. La logica alla base di questo argomento è relativamente semplice. Gli animali devono foraggiare su un’area in grado di soddisfare le loro esigenze energetiche e nutrizionali. Ne consegue che un aumento delle dimensioni del gruppo aumenterà l’area che deve essere coperta per trovare scorte alimentari adeguate. Così gli individui devono viaggiare ulteriormente e spendere più energia se sono in un grande gruppo, che se si foraggiano in un gruppo più piccolo. Con un aumento del tempo trascorso in viaggio, si avvicina un punto in cui l’energia spesa in viaggio è troppo costosa e gruppi più piccoli diventano vantaggiosi. In questo modo i fattori ecologici possono influenzare i modelli di movimento e l’efficienza del foraggiamento, limitando così la dimensione dei gruppi che possono sfruttare in modo efficiente le risorse alimentari disponibili. Queste idee sono state formalizzate in quello che è diventato noto come i limiti Ecologici del Modello (Chapman & Chapman 2000b, Ganas & Robbins 2005, Snaith & Chapman 2007, Teichroeb & Sicotte 2009).
La componente essenziale del modello di vincoli ecologici è che un aumento delle dimensioni del gruppo deve portare ad un aumento della competizione alimentare all’interno del gruppo. È concepibile che questo operi in modo leggermente diverso a seconda della natura delle risorse utilizzate da specie particolari. Con frugivori, e forse molti primati folivori, che si nutrono in zone discrete-in genere alberi che portano cibo o ciuffi di alberi-altri membri del gruppo possono esaurire le zone più velocemente e portare ad un aumento degli intervalli di giorni (Chapman 1988, Snaith & Chapman 2005). Per le specie più insettivore, le cui risorse potrebbero non verificarsi in macchie discrete, il viaggio continuo attraverso la chioma alla ricerca di insetti con membri del gruppo aggiuntivi può portare ad un aumento della sovrapposizione dei singoli campi di ricerca, riducendo i tassi di incontro pro capite con il cibo e aumentando così l’area che deve essere cercata (van Schaik et al. 1983).
Quindi il modello dei vincoli ecologici suggerisce che i fattori che influenzano la distanza percorsa dagli animali dovrebbero influenzare anche le dimensioni del gruppo. Per quegli animali che in genere si nutrono di frutta o foglie che possono essere esaurite, la dimensione del cerotto determinerebbe per quanto tempo un gruppo di una determinata dimensione potrebbe rimanere e nutrirsi. Un grande gruppo trascorrerebbe meno tempo in una patch di una data dimensione rispetto a un gruppo più piccolo, perché esaurisce la patch più velocemente — un grande gruppo ha semplicemente più bocche da sfamare. Se gli animali viaggiano tra le patch una volta che le hanno esaurite, la densità e la distribuzione delle patch determineranno i costi di viaggio sostenuti. Quando le patch di risorse sono ad alta densità o in una distribuzione raggruppata, la distanza dalla patch successiva è piccola, i costi di viaggio sono bassi e gli animali possono quindi formare grandi gruppi. In tali momenti, qualsiasi costo aggiuntivo associato all’essere un membro di un grande gruppo, come la necessità di visitare molte patch, può essere facilmente recuperato. Al contrario, quando le patch di risorse si verificano a basse densità, la distanza dalla patch successiva è in genere grande, i costi di viaggio sono elevati e gli animali non possono permettersi di esaurire rapidamente le patch e quindi gli animali formano piccoli gruppi.
L’organizzazione sociale di fissione-fusione di scimmie ragno, scimpanzé e pochi altri primati (Figura 1) offre test utili del modello dei vincoli ecologici perché si può tentare di prevedere cambiamenti temporali nella dimensione del sottogruppo da misure dirette della dimensione, della densità e della distribuzione delle risorse alimentari (Chapman 1990, Chapman et al. 1995). Per le scimmie ragno e gli scimpanzé, è stato sviluppato un modello di regressione multipla per dimostrare che la dimensione, la densità e la distribuzione dei cerotti alimentari misurati ogni mese erano un buon predittore della dimensione del sottogruppo. È difficile rappresentare visivamente una regressione multipla, ma i metodi utilizzati per le scimmie ragno sono ritratti in Figura 2. Le scimmie ragno hanno un tipo di fissione-fusione molto flessibile di organizzazione sociale, e nel Parco Nazionale di Santa Rosa, in Costa Rica, le dimensioni del sottogruppo possono variare da 1 a 35 individui, ma in media si trovano circa 5 individui che viaggiano insieme. Per questa popolazione, il 50% della varianza nella dimensione media mensile del sottogruppo può essere previsto da misure relativamente grezze della dimensione, della densità e della distribuzione dei cerotti alimentari (Chapman 1990).

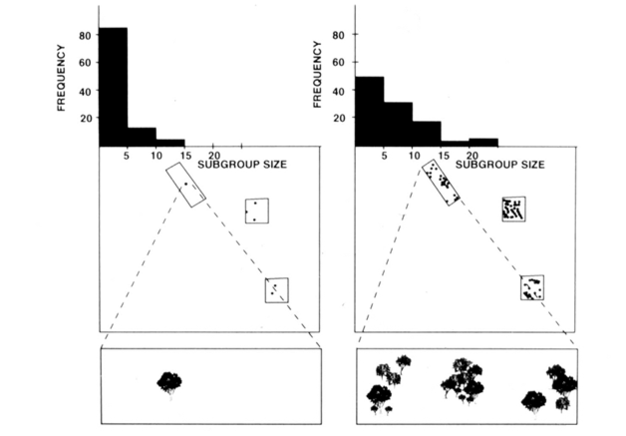
oltre alle specie di cui sopra, l’applicabilità dei limiti ecologici modello è stato generalmente sostenuto con la ricerca di una varietà di specie (Snaith & Chapman 2005) e situazioni (ad esempio, modelli generali, Wrangham et al. 1993, e associazioni di specie miste, Chapman & Chapman 2000c). Riteniamo che, dato l’ampio sostegno che questo modello ha ricevuto, sia giunto il momento che sia ragionevole suggerire che le specie dovrebbero tipicamente conformarsi alle aspettative del modello dei vincoli ecologici. Ciò non significa che tutte le specie si conformeranno, e quindi diventa un momento emozionante per la ricerca in questo campo perché gli investigatori possono cercare eccezioni al modello. Sospettiamo che le specie che non sono conformi lo faranno perché hanno adottato strategie sociali che vanno contro le aspettative ecologiche. Ciò fornisce un “metro” per valutare l’importanza potenziale delle varie strategie sociali (cioè, più si discosta dalle aspettative del modello ecologico, più importanti sono le pressioni selettive sociali).
Forniamo brevemente due esempi della nostra precedente ricerca. Gli scimpanzé femminili erano più solitari delle scimmie ragno femmine, eppure entrambi hanno organizzazioni sociali simili a fissione-fusione. Inoltre, mentre potevamo prevedere con precisione il numero di maschi e scimpanzé subadulti in un sottogruppo in base alle condizioni ecologiche, non siamo stati in grado di prevedere il numero di scimpanzé femminili in questi sottogruppi (Chapman et al. 1995). Anche quando le risorse erano estremamente abbondanti e quasi tutti i maschi erano in un grande sottogruppo, le femmine raramente entravano in gruppi, suggerendo che il costo di essere in un sottogruppo più grande superava i benefici, come l’evitamento dei predatori. Questo è inaspettato dal punto di vista che i bambini di queste femmine sarebbero la classe di età/sesso più minacciata dalla predazione. Un’ipotesi verificabile per spiegare queste osservazioni è che la natura delle coalizioni in queste due specie può influenzare i benefici dell’appartenenza al gruppo. Le prove suggeriscono che, a differenza degli scimpanzé, le femmine di scimmia ragno formano coalizioni che spesso operano per consentire ai membri della coalizione l’accesso esclusivo al cibo. Quindi le scimmie ragno, quando si uniscono a individui particolari, possono aumentare il loro accesso al cibo escludendo gli altri, ma per le femmine di scimpanzé questo non è il caso (Chapman et al. 1995).
Abbiamo identificato un’altra deviazione interessante, potenzialmente causata da fattori sociali che influenzano i costi e i benefici dell’essere in un gruppo, e questo riguarda il colobo rosso e le scimmie colobo in bianco e nero (aka. guerezas, Colobus guereza) presso il Parco Nazionale di Kibale, Uganda. I colobi rossi formano grandi gruppi con una media di 65 individui (25-127 individui, Snaith et al. 2008), mentre i guerezas vivono in piccoli gruppi con una media di 6,5 individui (4-11 individui, Harris & Chapman 2007). Nonostante questa differenza, c’è una grande somiglianza nelle piante mangiate dalle due specie. Se le condizioni ecologiche fossero responsabili della differenza di dimensioni del gruppo tra le due specie di colobine, ci si aspetterebbe che le loro diete differissero e la densità degli alberi alimentari sarebbe più bassa negli intervalli di casa dei guerezas, dal momento che hanno le dimensioni del gruppo più piccole. Tuttavia, le loro diete sono molto simili; la sovrapposizione dietetica tra un colobo rosso e un gruppo di guereza che aveva la sua gamma domestica interamente all’interno della gamma domestica del gruppo di colobo rosso era 43.2%, mentre per i due gruppi vicini di colobo rosso, la dieta si è sovrapposta solo del 37,3% (Chapman et al. 2002). Sembra che il successo riproduttivo della guereza femminile sia massimizzato in gruppi di piccole e medie dimensioni, sia perché gruppi più grandi sperimentano tassi più elevati di take-over e infanticidi o più competizione alimentare (vedi prove di competizione scramble nei folivori Trachypithecus phayrei e Semnopithecus sp. , ma una mancanza di prova di guerezas che esaurisce cerotti di cibo). Abbiamo assistito a una serie di acquisizioni di maschi e uccisioni di neonati nelle guerezas (Onderdonk 2000)-vedi Teichroeb & Sicotte (2008) per una valutazione della teoria riguardante l’infanticidio nei colobini. Ciò che non è chiaro è come il rischio di infanticidio limiterebbe le dimensioni dei gruppi di guereza, quando hanno accesso apparente ad un’alta densità di cibo che dovrebbe consentire la formazione di gruppi multi-maschili. In diverse specie, gruppi femminili più grandi sono più di un obiettivo per i maschi immigranti, e questa situazione può aumentare i tassi di infanticidio-per esempio, Semnopithecus sp. (Borries 1997), Theropithecus gelada (Dunbar 1984), Alouatta seniculus (Crockett & Janson 2000), Presbytis thomasi (Steenbeek & van Schaik 2001). Tuttavia, ci si aspetta che l’infanticidio sia meno frequente se un gruppo contiene più maschi riproduttivamente attivi, perché l’immigrazione maschile e la successiva presa violenta e l’infanticidio hanno meno probabilità di verificarsi quando il nuovo arrivato si trova di fronte a diversi possibili figli di futuri neonati (Janson & van Schaik 2000). I Guerezas sembrano avere ampie risorse alimentari per formare gruppi più grandi (Tombak et al. 2012), che ridurrebbe il rischio di infanticidio, ma non formano grandi gruppi. È possibile che la natura delle interazioni maschio-maschio in guerezas renda instabili i grandi gruppi. Questo sembra essere il caso di ursine colobus (Colobus vellerosus), dove gruppi multi-maschili attraggono immigrati maschi e hanno tassi di infanticidio più elevati rispetto ai gruppi con un maschio adulto forte nel fiore degli anni (Teichroeb, Wikberg, Badescu, & Sicotte, dati non pubblicati; Figura 3). Thus, even when ecological conditions would permit large groups to form, social conditions preclude their formation (Chapman & Pavelka 2005).

Se i limiti ecologici del modello è che delinea le pressioni che generalmente influenzano primate dimensione del gruppo e se le deviazioni da questo atteso dimensione del gruppo il risultato delle pressioni sociali, sarà un momento emozionante in questo settore di ricerca, perché solleva una serie di domande interessanti. Biru: Qual è la natura delle pressioni sociali sulla dimensione del gruppo? Perché questi vincoli sociali sono presenti in queste specie e non strettamente correlati? E quali sono le forze evoluzionarie che scelgono queste pressioni sociali? La dimensione del gruppo è un elemento critico che influenza il tipo di organizzazione sociale che le specie adottano, quindi l’esame di questi problemi porterà a interessanti perfezionamenti dei modelli socioecologici.
Leave a Reply