Fosfofruttochinasi (PFK)
Contenuto
- 1 Introduzione
- 2 Ruolo nella Glicolisi
- 3 Meccanismo e il Regolamento della Fosfofruttochinasi
- 4 Regolamento
- 5 Cambiamenti Conformazionali in un Dimerica Unità di PFK
- 6 I Principali Cambiamenti Conformazionali in una Subunità di PFK.
- 7 Mutagenesi Site-Directed
- 8 Malattia
- 9 Strutture 3D di PFK
Introduzione
La fosfofruttochinasi-1 (PFK-1) è un enzima glicolitico che catalizza il trasferimento di un gruppo fosforilico da a a cedere e . Vedi Enzimi della glicolisi. Mg2 + è anche importante in questa reazione (). La fosfofruttochinasi-2 (PFK-2) agisce sugli stessi substrati per produrre ADP e . . La reazione di PFK è fortemente esergonica (irreversibile) in condizioni fisiologiche e quindi è una delle fasi determinanti della via glicolitica. Nella maggior parte degli organismi/tessuti, PFK è il principale enzima di regolazione del flusso della via glicolitica; la sua attività è controllata dalle concentrazioni di un numero insolitamente elevato di metaboliti tra cui ATP, ADP, AMP, PEP e fruttosio-2,6-bisfosfato.
è un tetramero di subunità identiche a 320 residui. È un enzima allosterico descritto utilizzando il modello di simmetria dell’allosterismo per cui vi è una transizione concertata dal suo stato R ad alta attività al suo stato T a bassa attività. Sono state riportate le strutture a raggi X di entrambi gli stati R e T dell’enzima. Il legame di una molecola del suo substrato F6P, che si lega all’enzima dello stato R con alta affinità ma all’enzima dello stato T con bassa affinità, fa sì che PFK riprenda lo stato R, che a sua volta aumenta l’affinità di legame dell’enzima per F6P aggiuntivo (un effetto omotropico). Gli attivatori, come ADP e AMP si legano ai cosiddetti siti allosterici, siti di legame distinti dal sito attivo, dove facilitano allo stesso modo la formazione dello stato R e quindi attivano l’enzima (un effetto eterotropo; ADP, essendo un prodotto della reazione PFK, si lega anche al sito attivo dell’enzima). Allo stesso modo, gli inibitori come PEP si legano ai siti allosterici (che nel caso di PFK si sovrappongono al sito allosterico attivante) dove promuovono la formazione dello stato T, inibendo così l’enzima.
Due dei siti attivi dell’enzima si trovano all’interfaccia di con le interfacce del sito attivo in magenta con i substrati in ciano. Altri due siti attivi sono all’interfaccia delle subunità B (verde) e C (rosa). Un primo piano della di subunità D (giallo) mostra che gli amminoacidi da entrambe le subunità A (azzurro) e D (giallo) contribuiscono al legame di F6P. Due dei siti allosterici si trovano all’interfaccia di e due all’interfaccia delle subunità C e D. Ancora una volta le interfacce sono magenta con il ligando allosterico in ciano. Un primo piano della subunità A mostra i contributi di entrambe le subunità al legame di ADP. I cambiamenti conformazionali nell’andare tra gli stati R e T di PFK sono illustrati di seguito.
Le coordinate atomiche per lo stato R PFK sono state ottenute da 4pfk; quelle per lo stato T PFK sono state ottenute da Philip Evans, MRC Laboratory of Molecular Biology, Cambridge, U. K. ma sono ora disponibili come 6pfk.
Ruolo nella glicolisi
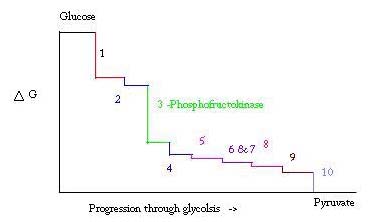
La glicolisi è il processo per preparare e abbattere il glucosio per produrre acido piruvico, che viene utilizzato nella respirazione anaerobica o come uno dei reagenti iniziali nel ciclo dell’acido citrico. Tre punti nel processo di glicolisi si verificano con una grande energia libera negativa e sono quindi irreversibili. Questi tre punti sono esochinasi, fosfofruttochinasi e piruvato chinasi; di questi tre PFK è considerato il principale punto regolatore per la glicolisi nel muscolo con un ΔG= -25.9 kJ / mol.
Meccanismo e regolazione della fosfofruttochinasi
La fosfofruttochinasi lega sia Mg2+-ATP che fruttosio-6-fosfato (F6P) per produrre fruttosio-1,6-bifosfato e Mg2+-ADP. Sebbene l’immagine con entrambi questi prodotti non sia stata determinata, legata all’enzima è stata. Ci sono tre siti di legame ligando per subunità. Due costituiscono il sito attivo, che lega F6P e ATP, mentre il terzo è un sito di legame allosterico. Alcuni residui proposti coinvolti nel sito attivo includono . PFK esistono in due stati conformazionali, entrambi e che sono in equilibrio. L’ATP lega entrambi i siti attivi e allosterici in entrambe le conformazioni. Mentre l’ATP lega ugualmente bene il sito attivo, lega preferenzialmente il sito allosterico dello stato T Questo legame preferenziale causa uno spostamento dall’equilibrio dei due stati, ad una maggiore quantità di stato T , che diminuisce l’affinità per F6P. si lega anche al sito allosterico per aumentare il rapporto tra la fosfofruttochinasi dello stato R. Insieme ad ADP, AMP e F2, 6P inibiscono il ruolo normativo dell’ATP. Il Km di PFK per ATP è .020 millimetri e .032mM.
Regolamento
La glicolisi è un processo metabolico essenziale per la sopravvivenza. Pertanto, nella sua attivazione e soppressione deve essere altamente regolato. Tre punti nel processo di glicolisi si verificano con una grande energia libera negativa e sono quindi irreversibili. Questi tre punti sono esochinasi, fosfofruttochinasi e piruvato chinasi. Queste tre reazioni sono candidate ad essere i principali punti di regolazione a causa delle loro alte energie libere negative. Dei tre, PFK è considerato il principale punto normativo per la glicolisi (#3 nella foto sotto) nel muscolo, con un ΔG= -25.9 kJ/mol, perché è un passo impegnato. Una volta che PFK converte F6P in F1, 6P, la reazione non sarà facilmente invertita a causa dell’elevata quantità di energia che deve essere superata per andare indietro. . Questa barriera energetica ha senso visto che la piruvato chinasi catalizza la reazione finale (#10) e l’esochinasi (#1) non è affatto coinvolta nella glicolisi quando il processo è iniziato dal glicogeno.
PFK è regolato da ATP, AMP e ADP. Mentre l’ATP si lega al sito attivo ugualmente bene in entrambi i R e T, si lega preferenzialmente il sito allosterico del T stato Questo legame preferenziale provoca uno spostamento dalla posizione di equilibrio dei due stati, per una maggiore quantità di T stato , che diminuisce l’affinità per F6P. Attivatore allosterico ADP si lega anche al sito allosterico per aumentare il rapporto di R stato fosfofruttochinasi. Come si può vedere dal grafico sottostante, le trame per l’attività di PFK sono sigmoidali. Ciò dimostra ulteriormente la natura cooperativa dell’enzima. Il legame iniziale del substrato all’enzima è difficile, ma una volta che è legato e costringe il cambiamento di stato da T -> R, gli altri substrati si legano molto più facilmente. Il grafico mostra anche che l’aggiunta di ATP sposta la trama a destra (cioè diminuisce l’affinità per F6P), mentre l’aggiunta di AMP la sposta a sinistra.
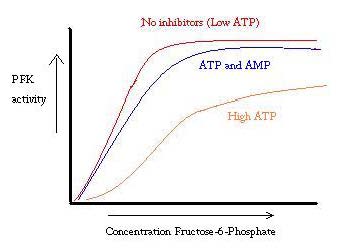
Il sistema di regolazione si abbina bene con la funzione di PFK. Quando PFK è attivo, l’ATP viene prodotto a valle da esso poiché ulteriori prodotti vengono suddivisi in modo più completo. Pertanto, quando i livelli di ATP sono bassi e occorre fare di più, l’attività di PFK sarà aumentata, perché l’ADP sarà in alta concentrazione. Vale anche il contrario, perché l’alta concentrazione di ATP inibisce l’attività proteica. Eppure, questa spiegazione non può spiegare completamente la regolazione del PFK, perché i livelli di ATP non variano abbastanza tra muscoli attivi e a riposo. Un altro mezzo di regolazione allosterica deve essere trovato.
Km di PFK per ATP è .020 millimetri e .032 mm.
Questo esercizio Kinemage consiste in due scene kinemage che illustrano alcuni dei cambiamenti conformazionali allostericamente indotti che si verificano in PFK da Bacillus stearothermophilus.
Cambiamenti conformazionali in un’unità dimerica di PFK
Questo kinemage mostra le due subunità del tetramero la cui interfaccia contiene due siti attivi. (KineMage attualmente non supportato) La prima vista, 1: PFK dimer, mostra le due subunità nella loro conformazione dello stato R come rappresentato dalle loro dorsali Ca con Subunità 1 in tinta rosa e Subunità 2 in rosa. Sono mostrate due catene laterali in ciascuna subunità, quelle di Glu 161 (rosso) e Arg 162 (ciano), che fanno parte del sito di legame F6P negli stati T e R, in modo specifico(vedi sotto). Un F6P (hotpink) e un ADP (verde; “ADP-active”) sono legati nel sito attivo di ciascuna subunità. Un ADP aggiuntivo (giallo; “ADP-allo”) è legato in un cosiddetto sito allosterico separato di ciascuna subunità. Gli ADP hanno ciascuno un Mg2 + associato, che è rappresentato qui da una palla dello stesso colore dell’ADP a cui si lega.
Fare clic sul pulsante “ANIMA” per passare il dimero tra i suoi stati R e T. Nel suo stato T, Subunità 1 è bluetint e subunità 2 è skyblue. Le catene laterali di Glu 161 e Arg 162 in entrambe le subunità sono rosse e ciano come prima (solo gli atomi Ca e Cb della catena laterale Arg 162 nella Subunità 1 sono osservati nella struttura a raggi X dello stato T; quelli della Subunità 2 sono tutti osservati). L’enzima dello stato T lega l’inibitore 2-fosfoglicolato (oro; “PGC”), un analogo non fisiologico del fosfoenolpiruvato intermedio glicolitico (PEP). Si noti che il sito di legame di PGC nello stato T si sovrappone al sito di legame allosterico di ADP nello stato R (“ADP-allo”) e quindi il loro legame si esclude a vicenda. I siti attivi dello stato T, che non contengono F6P, sono contrassegnati da F6Ps “fantasma”(grigio;” sito F6P”), che hanno le stesse posizioni di F6Ps nell’enzima dello stato R.
La seconda vista, 2: Allo/Act Sites, è un primo piano della parte superiore della prima vista che mostra sia il sito attivo che il sito allosterico in questa regione. Si noti che il sito attivo si trova all’interfaccia tra due subunità e che il sito allosterico interagisce direttamente con il sito attivo sulla subunità adiacente. Confronta le conformazioni dello stato R e dello stato T visualizzando entrambe contemporaneamente o facendo clic su”ANIMA”. È possibile identificare lo Mg Mg2 + associato a ciascuno degli ADP legati all’enzima nello stato R? Quali atomi ADP coordinano questi ioni Mg2+?
Il gruppo fosfato di PGC si lega al sito allosterico nello stato T quasi nella stessa posizione in cui il gruppo beta fosfato di “ADP-allo” si lega al sito allosterico dello stato R; entrambi i gruppi fosfato si legano alle catene laterali degli stessi tre residui (2 arg e 1 Lys; non mostrato).
Nello stato R ad alta attività, la catena laterale caricata positivamente di Arg 162 forma un ponte di sale legato all’idrogeno con il gruppo 6-fosfato caricato negativamente di F6P (linee tratteggiate bianche), un’interazione che presumibilmente stabilizza lo stato R rispetto allo stato T ed è quindi in parte responsabile dell’effetto omotropico di F6P.
I principali cambiamenti conformazionali in una subunità di PFK.
Questo KINEMAGE mostra quei segmenti vicino al sito allosterico (i residui 53-60 non sono mostrati qui). Come nel KINEMAGE 1, il polipeptide è rappresentato dalla sua catena Ca con subunità di stato R 1 e 2 in redtint e rosa e subunità di stato T 1 e 2 in bluetint e skyblue. (KineMage attualmente non supportato)KINEMAGE 2 viene visualizzato nella vista 1: Il sito allosterico, nello stato R che mostra il gruppo fosfato di F6P (hotpink) legato nel sito attivo dell’enzima in un ponte di sale legato all’idrogeno (linee bianche tratteggiate) con la catena laterale di Arg 162 (ciano). Un ADP (giallo; “ADP-allo”) occupa il sito allosterico adiacente. Fare clic una volta su “ANIMATE” per passare allo stato T. Questo sostituisce l’ADP nel sito allosterico dello stato R con l’inibitore e PEP analogico PGC (oro). F6P non occupa più il sito attivo ma la sua posizione nello stato R è indicata dal” fantasma ” F6P (grigio; visualizzato cliccando su “Sito F6P”).
Cosa succede al segmento elicoidale del polipeptide centrale (residui 149-164) nella transizione da R a T? Cosa fa questo alle posizioni relative del Glu 161 caricato negativamente e del Arg 162 caricato positivamente? Clicca su “Sito F6P”. Che influenza avrebbe l’assenza della carica positiva di Arg 162 sul legame di F6P? Questo spiega, almeno in parte, perché T state PFK ha una bassa affinità per F6P? Vai a Visualizza 2: Primo piano, per un primo piano delle interazioni F6P-sidechain. Centrare le molecole scegliendo ” pickcenter “dal menu” strumenti ” e cliccando su un atomo che desideri essere al centro. Far scorrere il cursore” zoom ” per ingrandire la vista.
Mutagenesi Site-Directed
Un tempo, si pensava che la carica negativa di Glu 161 avesse un effetto negativo sul legame F6P nello stato T. Questa idea non è stata supportata da esperimenti di mutagenesi diretti al sito. Sono stati prodotti diversi PFK mutanti, tra cui R162A, E161A e R162A/E161A. La mutazione R162A ha causato una diminuzione di 30 volte del legame F6P. La mutazione E161A, tuttavia, ha avuto scarso effetto sulla capacità del PEP di inibire il legame F6P.
Malattia
Eritrociti ereditari Il deficit di PFK è associato a miopatia ed emolisi (malattia di Tarui).
Strutture 3D di PFK
Strutture 3D di fosfofruttochinasi
Leave a Reply