Frontiere in farmacologia
Introduzione
I liposomi sono un tipo di nanocarrier che sono stati ampiamente studiati per scopi di somministrazione di farmaci. Sono composti da doppi strati fosfolipidici che racchiudono uno spazio acquoso distinto, consentendo così l’incapsulamento di composti sia idrofili che idrofobici (Metselaar e Storm, 2005). I liposomi sono in grado di stabilizzare i composti terapeutici e superare le barriere all’assorbimento cellulare e tissutale (Ding et al., 2006; Hua e Wu, 2013). Ciò consente loro di migliorare il targeting dei composti nei siti di malattia e di conseguenza ridurre l’accumulo negli organi non bersaglio (Bakker-Woudenberg et al., 1994; Mastrobattista et al., 1999; Hua, 2013; Hua et al., 2015; Sercombe et al., 2015; Zununi Vahed et al., 2017). Esistono quattro tipi principali di liposomi in base alle loro caratteristiche superficiali: liposomi convenzionali, liposomi pegilati, liposomi mirati al ligando e liposomi theranostici (Figura 1; Sercombe et al., 2015). Ligando-liposomi mirati a fornire il potenziale per site-specific di consegna di farmaci, alcuni tessuti o organi, che selettivamente express mirati ligando (Willis e Forssen, 1998; Bendas, 2001; Sawant e Torchilin, 2012), mentre liposomi Peghilato conferire sterico per migliorare la circolazione di half-life del sistema di consegna a seguito di somministrazione sistemica (Torchilin, 1994; Wang et al., 2015). I liposomi che incorporano una combinazione delle varie piattaforme di consegna possono ulteriormente migliorare la consegna dei composti incapsulati, secondo la via di amministrazione e il sito della malattia.
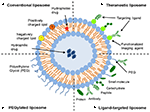
FIGURA 1. Rappresentazione schematica dei diversi tipi di sistemi di somministrazione di farmaci liposomiali-(A) liposoma convenzionale, (B) liposoma pegilato, (C) liposoma mirato al ligando e (D) liposoma theranostico (Sercombe et al., 2015).
Seguendo il processo di produzione, i liposomi sono caratterizzati per garantire l’omogeneità attraverso una serie di parametri, tra cui l’incapsulamento del farmaco, la coniugazione del ligando, la composizione lipidica, la carica superficiale e le proprietà morfologiche (ad esempio, dimensione, forma e numero di lamelle) (Kuntsche et al., 2011). Queste caratteristiche sono importanti in quanto possono avere un impatto importante sul comportamento dei liposomi sia in vitro che in vivo (Sawant e Torchilin, 2012; Sercombe et al., 2015). Il riconoscimento e la clearance dei liposomi da parte delle difese del corpo, incluso il sistema reticoloendoteliale (RES) e l’adsorbimento delle opsonine con successivo assorbimento da parte del sistema fagocitico mononucleare, sono i principali contributori alla clearance e alla degradazione dei liposomi (Senior, 1987; Cullis et al., 1998; Ishida et al., 2001). Pertanto, essere in grado di determinare le proprietà fisico-chimiche dei liposomi fabbricati è importante per ottimizzare una formulazione per un’ulteriore valutazione traslazionale.
Un aspetto importante nella valutazione fisico-chimica dei liposomi è la visualizzazione della morfologia delle nanoparticelle mediante microscopia. Ci sono un certo numero di tecniche disponibili per l’imaging liposomi e altre nanoparticelle che possono essere ampiamente classificati in luce, elettrone, o microscopia a forza atomica (Bibi et al., 2011). Ogni tecnica ha i suoi vantaggi e limiti, che dovrebbero essere considerati quando si valutano gli studi sui sistemi di somministrazione di farmaci basati su nanoparticelle (Tabella 1). Questa revisione valuterà ogni tecnica di imaging utilizzata per valutare le caratteristiche morfologiche dei liposomi.

TABELLA 1. Sintesi delle attuali tecniche di imaging per caratterizzare la morfologia dei liposomi.
Microscopia ottica
La microscopia ottica o leggera si riferisce a microscopi che utilizzano la luce visibile e una disposizione di lenti per ingrandire un campo visivo (Murphy e Davidson, 2012c). La microscopia ottica di base non è in grado di fornire informazioni complete sul doppio strato lipidico rispetto al dettaglio offerto da altre tecniche di microscopia. Tuttavia, può essere utilizzato per ottenere rapidamente un’immagine delle vescicole utilizzando attrezzature di laboratorio di base (Bibi et al., 2011). Questa tecnica può essere particolarmente utile quando si raccolgono informazioni generali sulla dimensione, la forma, l’omogeneità e il grado di aggregazione di un campione di liposomi (Nallamothu et al., 2006). I microscopi ottici hanno una risoluzione finale di ∼250 nm (governata dalla più piccola dimensione dello spot limitata alla diffrazione che può essere raggiunta dallo strumento) e, come tale, sono tipicamente incapaci di fornire informazioni dettagliate sulle strutture delle piccole vescicole unilamellari (SUV) e sulla lamellarità delle vescicole (Bibi et al., 2011). Generalmente, la microscopia ottica può fornire solo informazioni significative sulle vescicole unilamellari giganti (GUVS), che possono variare da singole a centinaia di micrometri di diametro (Bagatolli, 2009). L’incorporazione di sonde fluorescenti, le tecniche di polarizzazione e l’applicazione di microscopia confocale ad alta risoluzione possono fornire ulteriori informazioni sulla struttura 3D e sulla lamellarità delle vescicole (Bagatolli, 2009).
Microscopia di polarizzazione
Questo tipo di microscopia ottica utilizza la capacità unica della luce polarizzata di interagire con legami polarizzabili di molecole ordinate (Murphy e Davidson, 2012d). Maggiore assorbimento della luce si verifica quando dipoli molecolari nel campione sono allineati con il vettore di polarizzazione dell’onda di luce incidente; con conseguente differenze di fase tra i raggi di luce di campionamento, che a loro volta producono variazioni di ampiezza dipendenti dall’interferenza nel piano dell’immagine (Murphy e Davidson, 2012d). Il contrasto dell’immagine deriva quindi non solo dagli effetti dell’interferenza e della diffrazione, ma anche dalla presenza di disposizioni molecolari ordinate (Murphy e Davidson, 2012d). Può essere utilizzato per studiare la forma e la dinamica di molte strutture cellulari ordinate, compresi i doppi strati lipidici delle membrane plasmatiche (Bibi et al., 2011; Murphy e Davidson, 2012d). Le immagini possono essere ottenute in bianco e nero o a colori. Questa tecnica fornisce un metodo alternativo per visualizzare i liposomi, in particolare per confermare la formazione di vescicole. Non fornisce osservazioni conclusive riguardanti le caratteristiche del doppio strato o la lamellarità delle vescicole (Bibi et al., 2011). Inoltre, la microscopia di polarizzazione è anche limitata dalla dimensione delle vescicole che possono essere visualizzate, con grandi vescicole nell’intervallo micrometrico con la chiarezza ottimale. Questa tecnica non fornisce immagini chiare di particelle nell’intervallo nanometrico.
Microscopia a fluorescenza
La microscopia a fluorescenza o “epifluorescenza” è una forma speciale di microscopia ottica che sfrutta la capacità dei fluorocromi di emettere luce dopo essere stati eccitati con luce di una certa lunghezza d’onda (Murphy e Davidson, 2012b). Questa tecnica è ampiamente utilizzata in biofisica per fornire informazioni essenziali sulla struttura e la dinamica dei componenti della membrana (Bouvrais et al., 2010). In questi studi, le sonde fluorescenti sono specificamente incorporate nella membrana in esame, consentendo la visualizzazione della struttura. Una vasta gamma di coloranti fluorescenti con varie proprietà chimiche e fotoniche sono disponibili in commercio, catering per una varietà di domande di ricerca. Ad esempio, alcuni coloranti fluorescenti possono preferire specifici ambienti a membrana che presentano diverse disposizioni e imballaggi laterali (Bouvrais et al., 2010). Come tale, la microscopia di fluorescenza tiene conto il potenziale applicare simultaneamente le sonde multiple all’interno di un campione per fornire le informazioni circa la struttura della membrana stessa. Le sonde fluorescenti possono essere posizionate all’interno del compartimento acquoso e nel doppio strato lipidico dei liposomi (Bibi et al., 2011). Questa disposizione può essere particolarmente utile quando si visualizzano i GUV, dove è possibile ottenere informazioni sulla forma, le dimensioni e la fluidità delle vescicole lipidiche (Klymchenko et al., 2009; Bouvrais et al., 2010). L’incorporazione di sonde, come i lipidi marcati con rodamina, direttamente nel doppio strato lipidico può anche consentire la visualizzazione della lamellarità dei liposomi (Bibi et al., 2011).
Lo svantaggio della microscopia fluorescente è che l’aggiunta di sonde e coloranti a un sistema a membrana può potenzialmente interferire con le proprietà del sistema di consegna liposomiale (Bouvrais et al., 2010; Bibi et al., 2011; Murphy e Davidson, 2012b). Tuttavia, l’uso di basse concentrazioni di colorante (≤1 mol%) ha dimostrato di avere un impatto minimo sulle proprietà fisiche della membrana (Bouvrais et al., 2010). È anche importante notare che la scelta del colorante fluorescente è un passaggio critico, poiché alcuni coloranti possono indurre grandi cambiamenti nella membrana ospite e/o causare artefatti sperimentali, con conseguente interpretazione dei dati imprecisa (Bouvrais et al., 2010). Inoltre, la perossidazione lipidica foto-indotta può anche portare alla formazione del dominio anche in sistemi di tintura semplici. Questo processo può portare alla formazione di grandi zattere e alla formazione spontanea di sfaccettature (Bouvrais et al., 2010). L’esposizione prolungata alla luce fluorescente può anche causare sbiancamento e perdita di intensità di fluorescenza. Pertanto, la scelta del colorante fluorescente e lo sviluppo di nuove sonde a membrana sono considerazioni importanti quando si utilizza la microscopia a fluorescenza (Klymchenko et al., 2009).
Microscopia confocale
La microscopia a scansione confocale è stata un progresso nell’area della microscopia a fluorescenza. Invece di illuminare l’intero campione, un’immagine viene creata scansionando uno (o più) fasci di luce focalizzati sul campione. La luce che ritorna dal campione illuminato passa attraverso un’apertura che respinge la luce fuori fuoco dall’alto e dal basso del piano di interesse; garantire che solo le immagini da una piccola profondità di campo sono ottenuti, migliorando notevolmente la risoluzione out-of-plane (Bibi et al., 2011; Murphy e Davidson, 2012a). Utilizzando questa tecnica, viene raccolta una” pila z ” di immagini, partendo dalla parte superiore della vescicola seguita da immagini scattate con incrementi z definiti fino alla parte inferiore del campione, risultando in un’immagine 3D composita del campione (Bibi et al., 2011; Murphy e Davidson, 2012a). La microscopia confocale di esame si è trasformata in in una tecnica più attraente sopra i microscopi leggeri epifluorescenti dovuto la sua chiarezza superiore di immagine. Nel caso dei GUV, questa tecnica è in grado di visualizzare la struttura interna dei sistemi lipidici, che spesso non è possibile con altri metodi di microscopia (Ruozi et al., 2011; Mertins e Dimova, 2013). Ad esempio, la separazione della fase a doppio strato acquoso e lipidico può essere chiaramente visualizzata in vescicole più grandi (Mertins e Dimova, 2013). Tuttavia, la microscopia confocale è ancora limitata alla diffrazione e, quindi, non è in grado di produrre immagini ad alta definizione di SUV o liposomi oligolamellari (Ruozi et al., 2011).
Tecniche di microscopia elettronica
La microscopia elettronica è un metodo per la visualizzazione di vescicole con ingrandimento molto elevato (Henry, 2005). È ampiamente usato nella caratterizzazione delle vescicole lipidiche in quanto la lunghezza d’onda dell’elettrone (e quindi la risoluzione limitata dalla diffrazione), è di molti ordini di grandezza inferiore a quella della microscopia ottica e quindi fornisce una super-risoluzione per una chiara visualizzazione di piccoli liposomi (Bibi et al., 2011; Ruozi et al., 2011). Questa tecnica utilizza un fascio di elettroni focalizzati sulla superficie del campione da varie lenti elettromagnetiche. Gli elettroni vengono quindi dispersi dal campione e vengono quindi riorientati e ingranditi da un’ulteriore serie di lenti elettromagnetiche nella colonna di imaging per produrre un’immagine proiettata (Henry, 2005). Esistono diversi tipi di microscopi elettronici, ognuno dei quali richiede un diverso metodo di preparazione del campione.
Microscopia elettronica a scansione (SEM)
I microscopi elettronici a scansione (SEMs) utilizzano un fascio di elettroni che viene scansionato attraverso o sopra un campione (piuttosto che attraverso un campione) per produrre un’immagine ingrandita di un oggetto (Adler e Schiemann, 1985). Alder et al. primo tentativo di utilizzare SEM per caratterizzare i liposomi nel 1984 (Adler e Schiemann, 1985). Hanno dimostrato che utilizzando il metodo di liofilizzazione per preparare i campioni di liposomi per SEM si è ottenuta una grande percentuale di grumi visibili e materiale incrostato (Adler e Schiemann, 1985). Studi più recenti hanno dimostrato che la stessa struttura del liposoma può subire perturbazioni a causa delle condizioni di alto vuoto e dei processi di colorazione necessari per questa tecnica di preparazione (Ruozi et al., 2011). SEM ora non è comunemente usato per analizzare i liposomi perché richiede che il campione sia asciugato o fissato prima dell’imaging (Ruozi et al., 2011). Tuttavia, SEM può fornire informazioni generali sulla struttura concentrica dei diversi strati lipidici, nonché fornire dettagli sulle dimensioni e sulla morfologia sferica di una preparazione (Nirale et al., 2009).
Microscopia elettronica a trasmissione (TEM)
La microscopia elettronica a trasmissione (TEM) è il metodo di imaging più frequentemente utilizzato per la valutazione della struttura delle nanoparticelle (Henry, 2005; Kuntsche et al., 2011). Comporta la preparazione di un campione sottile (<100 nm di spessore) che viene posto in una camera a vuoto. Il fascio di elettroni attraversa il campione, dove viene quindi focalizzato dalla lente dell’obiettivo per formare un’immagine. TEM può facilmente immaginare campioni di materia molle con una risoluzione spaziale fino a ben al di sotto di 1 nm di dimensione (Henry, 2005; Kuntsche et al., 2011; Ruozi et al., 2011). Questa tecnica può essere ulteriormente categorizzata in base al metodo di preparazione del campione utilizzato – in particolare, colorazione negativa, frattura da congelamento e TEM criogenico. Può fornire informazioni sulle modifiche superficiali delle nanoparticelle in quanto fornisce un migliore contrasto e contorno delle immagini rispetto ad altre tecniche di microscopia. Ad esempio, la coniugazione della transferrina alla superficie dei liposomi DSPC/colesterolo ha mostrato un rivestimento superficiale particolato con TEM a macchia negativa, che era assente nei preparati liposomici non coniugati (Anabousi et al., 2005). In un esperimento separato, sono stati aggiunti anticorpi specifici sollevati contro la transferrina umana prima della procedura di colorazione negativa per confermare l’identità del rivestimento superficiale del particolato (Anabousi et al., 2005). Pertanto, TEM offre la possibilità di ottenere una risoluzione molto migliorata quando si valuta la coniugazione dei ligandi alla superficie dei liposomi.
Tecnica di colorazione negativa
In TEM a macchia negativa, la preparazione del campione comporta una piccola quantità di campione idratato che viene posizionato su una griglia. Poiché le vescicole sono in contatto diretto con la griglia, il loro orientamento e la loro morfologia possono essere influenzati, e quindi questo dovrebbe essere preso in considerazione (Bibi et al., 2011). È inoltre necessario incorporare i liposomi in un materiale elettrone-denso adatto (ad es., sali di metalli pesanti come acetato di uranile o acido fosfotungstico) che fornisce un elevato contrasto, quindi le vescicole possono essere visualizzate su uno sfondo scuro (Ruozi et al., 2011). La tecnica di colorazione negativa è relativamente veloce e semplice; tuttavia, è stato dimostrato che causa cambiamenti alla struttura originale del liposoma e può portare alla creazione di frange chiare e scure che possono essere scambiate per strutture lamellari (Bibi et al., 2011; Ruozi et al., 2011). Inoltre, il posizionamento del campione sotto vuoto può causare un’ulteriore disidratazione del campione, che può nuovamente causare cambiamenti nella struttura delle vescicole (Bibi et al., 2011). Mentre la tecnica TEM a macchia negativa può fornire un ingrandimento molto più elevato per le nanoparticelle di imaging, il danno alla struttura del liposoma rende difficile valutare con precisione le caratteristiche morfologiche del campione. Pertanto, altre tecniche di imaging sono generalmente necessarie per confermare i risultati.
Tecnica Freeze–Fracture
La tecnica freeze-fracture non richiede alcun processo di essiccazione e può fornire ulteriori informazioni sulla struttura interna delle nanoparticelle (Kuntsche et al., 2011). Questo metodo comporta il posizionamento di un campione su una griglia TEM inserita tra due supporti in rame o oro (Severs, 2007). Il campione viene vetrificato tramite congelamento rapido, tipicamente con propano liquido o azoto liquido, prima di essere fratturato lungo aree del campione con interazioni molecolari deboli. Questa superficie di frattura può essere ulteriormente incisa e ombreggiata con un sottile strato di platino o carbonio per fornire una replica “negativa” del piano campione di frattura (Severs, 2007; Kuntsche et al., 2011). La replica viene quindi pulita con un solvente organico per rimuovere tutti i residui prima della visualizzazione al microscopio TEM. Poiché queste repliche sono così stabili, possono essere memorizzate e visualizzate in seguito (Kuntsche et al., 2011). Il principale vantaggio di questa tecnica è che le repliche riflettono da vicino lo stato nativo del campione e possono fornire informazioni dettagliate sulla struttura 3D delle vescicole e dell’organizzazione a doppio strato (Bibi et al., 2011; Kuntsche et al., 2011). Queste informazioni includono la costruzione multilamellare e l’imballaggio a doppio strato di vescicole multilamellari. Questa tecnica può anche valutare la dimensione aggregata e può essere particolarmente utile per esaminare l’interazione dei liposomi cationici con il DNA (Bibi et al., 2011). Tuttavia, gli artefatti possono ancora verificarsi nel campione durante la preparazione a causa di insufficiente velocità di congelamento, ri-deposizione di molecole di solvente e/o stress meccanico (Severs, 2007; Kuntsche et al., 2011). Ad esempio, un” effetto increspatura ” può verificarsi sui SUV nel campione (Bibi et al., 2011). Questa è una deformazione comune a doppio strato dovuta a un disturbo nelle transizioni delle catene aciliche prima del congelamento. L’incubazione delle vescicole tra la pre-transizione e la temperatura di transizione effettiva può anche causare increspature (Bibi et al., 2011). È interessante notare che questo può essere usato per fornire informazioni sulle transizioni di fase lipidiche che si verificano con la diversa natura dei lipidi utilizzati per le preparazioni liposomiali (Bibi et al., 2011).
TEM criogenico
TEM criogenico (cryo-TEM) è una variazione di TEM in cui vengono utilizzati film idrati acquosi sottili vetrificati in etano liquido prima dell’imaging. Questa tecnica consente l’analisi dei liposomi nel loro stato più nativo ed è uno strumento prezioso per determinare la dimensione, la forma, la struttura interna e la lamellarità dei liposomi (Weisman et al., 2004; Bibi et al., 2011; Kuntsche et al., 2011). Il principale vantaggio del congelamento rapido dei campioni di liposomi è ridurre al minimo la formazione di cristalli di ghiaccio e preservare proteine o altri materiali (Bibi et al., 2011; Kuntsche et al., 2011). Ciò è utile dove le proteine o il DNA sono stati incapsulati all’interno delle nanoparticelle (Weisman et al., 2004; Kuntsche et al., 2011). La crio-TEM è la forma più utile di microscopia attualmente disponibile per studiare i liposomi, in quanto evita problemi di fissazione chimica, disidratazione, taglio e colorazione – che possono influenzare la morfologia delle vescicole (Bibi et al., 2011). L’intervallo di risoluzione è da 5 5 a 500 nm, come definito dallo spessore del film (Almgren et al., 2000). Tuttavia, diverse limitazioni dovrebbero essere notate con questa tecnica, incluso il fatto che solo un’immagine 2D è ottenuta da oggetti 3D (che generalmente si applica anche alla maggior parte delle altre tecniche di microscopia). Per superare questa limitazione, è possibile ricostruire forme 3D da un numero sufficientemente elevato di immagini 2D di particelle non sferiche orientate casualmente (Orlova et al., 1999), oltre a visualizzare il campione a diversi angoli di inclinazione per ottenere informazioni sulla forma 3D (Van Antwerpen e Gilkey, 1994). La tomografia elettronica criogenica (cryo-ET) può anche essere utilizzata per ottenere immagini 3D (Le Bihan et al., 2009). Cryo-TEM utilizza anche dosi più basse di elettroni, il che significa che spesso ha una risoluzione inferiore rispetto ad altri metodi (Bibi et al., 2011; Kuntsche et al., 2011). Artefatti sono ancora possibili a causa della formazione di un film sottile di ghiaccio amorfo e l’uso di blotting sul campione applicando forze di taglio durante la formazione del film (Almgren et al., 2000; Bibi et al., 2011).
Microscopia elettronica a scansione ambientale (ESEM)
La microscopia elettronica a scansione ambientale (ESEM) è un sistema di imaging che non richiede l’uso di fissaggio, colorazione o congelamento di vescicole e può consentire l’imaging di cambiamenti dinamici di sistemi bagnati senza precedente preparazione del campione (Muscariello et al., 2005; Ruozi et al., 2011). La caratteristica principale di ESEM è la presenza di vapore acqueo nella camera del microscopio. La capacità di mantenere un’atmosfera contenente acqua attorno al campione che può essere parzialmente o addirittura completamente idratata è resa possibile dall’uso di un sistema di vuoto graduato a più aperture che consente di sostenere la camera di imaging a pressioni fino a 55 hPa (Bibi et al., 2011; Ruozi et al., 2011). Il fascio di elettroni primario può generare elettroni secondari che poi incontrano molecole di vapore, portando ad un’amplificazione a cascata del segnale prima di raggiungere il rivelatore. Per questo motivo, ESEM non richiede la preparazione del campione (Muscariello et al., 2005). Questa tecnica consente di variare l’ambiente del campione attraverso una serie di composizioni di pressione, temperatura e gas (Mohammed et al., 2004), che è utile per determinare come i cambiamenti ambientali influenzano le vescicole. Questo è applicabile a studi di formulazione e stabilità nanofarmaceutici (Bibi et al., 2011). ESEM inoltre è stato usato per analizzare il carico della droga nel doppio strato dei liposomi (Mohammed et al., 2004), oltre a determinare la dimensione e la forma delle vescicole. Una limitazione di ESEM è che non può fornire informazioni dettagliate sulla lamellarità e l’architettura interna delle strutture su scala nanometrica (Ruozi et al., 2011).
Microscopia a forza atomica (AFM)
La microscopia a forza atomica (AFM), nota anche come microscopia a forza di scansione (SFM), è un tipo di tecnica di microscopio a sonda a scansione. Funziona eseguendo una punta affilata attaccata a un cantilever e un sensore sulla superficie di un campione e misurando le forze di superficie tra la sonda e il campione (Sitterberg et al., 2010). Mentre il cantilever corre lungo la superficie del campione, si muove su e giù a causa delle caratteristiche della superficie e il cantilever devia di conseguenza. Questa deflessione viene solitamente quantificata utilizzando un sensore ottico, con il raggio laser che viene riflesso sul retro del cantilever sul rivelatore di luce (Sitterberg et al., 2010). AFM non ha bisogno di operare nel vuoto e può operare in aria ambiente o sotto liquido; quindi viene sempre più utilizzato per l’immagine di campioni biologici e nanoparticelle (Liang et al., 2004a, b; Ruozi et al., 2005, 2009). AFM ha una risoluzione eccezionale nell’ordine delle frazioni di un nanometro e può fornire un’immagine 3D dei liposomi insieme a dettagli su morfologia, distribuzione dimensionale, omogeneità e stabilità (Liang et al., 2004a, b; Ruozi et al., 2005, 2007, 2009). È importante sottolineare che l’AFM può essere utilizzato per caratterizzare le modifiche superficiali dei liposomi e rilevare i ligandi (ad esempio anticorpi e polimeri) coniugati sulla superficie della membrana liposomiale (Bendas et al., 1999; Moutardier et al., 2003; Anabousi et al., 2005; Liang et al., 2005). Ad esempio, Bendas et al. utilizzato AFM per ingrandire il bordo della membrana liposomiale e sono stati in grado di immagine strutture trimeriche, circa 8-10 nm di diametro, che rappresentava l’accoppiamento di anticorpi IgG alla superficie del liposoma (Bendas et al., 1999). I risultati hanno mostrato che l’efficacia della tecnica era fortemente dipendente dal metodo di coniugazione utilizzato, con anticorpi coniugati direttamente alla superficie liposomiale visibili con AFM (restricted protein mobility), rispetto agli anticorpi attaccati alle catene di PEG. Era suggestivo che le catene di PEG causassero un’elevata mobilità proteica e, quindi, non potessero essere scansionate (Bendas et al., 1999). Al contrario, Anabousi et al hanno dimostrato che l’incorporazione di lipidi pegilati nei liposomi ha indotto una stabilizzazione sterica con liposomi che mantengono una forma sferica (Anabousi et al., 2005). Le immagini AFM della superficie dei liposomi non coniugati erano lisce e non si potevano osservare strutture, mentre la coniugazione della transferrina alla superficie dei liposomi pegilati era visualizzata come piccole strutture globulari (Anabousi et al., 2005). Allo stesso modo, Moutardier et al prodotto liposomi con nuclei polimerici (LSP) che consisteva di farmaci caricati in particelle polimeriche che formavano il nucleo di vescicole lipidiche (Moutardier et al., 2003). Le immagini scattate con AFM hanno mostrato la presenza di una rete polimerica sulla superficie esterna, il che ha suggerito che il nucleo polimerico di collagene si è irradiato e ha formato uno strato superficiale sull’LSP (Moutardier et al., 2003). Oltre ai dettagli strutturali della superficie, AFM può fornire informazioni sulle proprietà meccaniche e chimiche di una superficie del campione attraverso misure di forza (Ruozi et al., 2007). Ad esempio, Mao et al. utilizzato questa tecnica per valutare l’elasticità e le proprietà adesive dei liposomi (Mao et al., 2004). Una limitazione dell’AFM è la necessità che le nanoparticelle vengano adsorbite su superfici di supporto, come mica o wafer di silicio. L’adsorbimento dei liposomi su un substrato solido ha il potenziale per modificare la dimensione e la forma delle vescicole e causare il loro appiattimento. (Ruozi et al., 2007). Inoltre, il contatto periodico della punta di sondaggio può trascinare i liposomi mentre si muove attraverso le vescicole in un campione (Jass et al., 2000). Nonostante questo, l’AFM è ancora uno strumento utile nella valutazione dei liposomi.
Conclusione
Esiste una vasta gamma di tecniche di imaging disponibili per valutare la morfologia dei liposomi, ognuna con i propri vantaggi e svantaggi. La microscopia ottica può fornire dettagli generali riguardanti le dimensioni e la forma delle vescicole più grandi e l’omogeneità di un campione in modo relativamente veloce. Al contrario, la TEM è la tecnica più comunemente utilizzata per esaminare la morfologia dei liposomi in modo molto più dettagliato; tuttavia, il potenziale di cambiamenti strutturali con ciascun sottotipo TEM dovuti alla colorazione e/o all’esposizione a condizioni di vuoto deve essere considerato nell’interpretazione dei risultati. L’ESEM è molto utile per determinare i cambiamenti liposomiali in risposta all’ambiente, mentre l’AFM sta emergendo come un metodo utile nell’analisi morfologica delle nanoparticelle e fornisce la massima risoluzione della superficie liposomiale. Sia AFM che TEM sono in grado di imaging ligandi coniugati alla superficie dei liposomi e forniscono informazioni complementari sulle modifiche superficiali. Nel complesso, la scelta della tecnica dipende da quali caratteristiche morfologiche e grado di dettaglio sono richiesti. Inoltre, la comprensione dei potenziali effetti del metodo di preparazione del campione di ciascuna tecnica di imaging è importante nel processo di selezione.
Contributi dell’autore
Redazione del manoscritto: A-LR e SH. Revisione critica dell’articolo per importanti contenuti intellettuali: SH, PD, JF, WP, AM, DS e AW.
Dichiarazione sul conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Ringraziamenti
Gli autori desiderano ringraziare il Pharmacy Research Trust del New South Wales, la Rebecca L. Cooper Medical Research Foundation, la Gladys M. Brawn Fellowship, ausEE Research Foundation e l’Università di Newcastle per aver fornito supporto finanziario per la nostra ricerca.
Adler, K., e Schiemann, J. (1985). Caratterizzazione dei liposomi mediante microscopia elettronica a scansione e tecnica freeze-fracture. Micron Microsc. Acta 16, 109-113. doi: 10.1016/0739-6260(85)90039-5
CrossRef Full Text/Google Scholar
Almgren, M., Edwards, K., e Karlsson, G. (2000). Microscopia elettronica a trasmissione crio di liposomi e strutture correlate. I colloidi navigano. Un Physicochem. Ing. ASP. 174, 3–21. doi: 10.1016/S0927-7757 (00)00516-1
CrossRef Full Text/Google Scholar
Anabousi, S., Laue, M., Lehr, C. M., Bakowsky, U., e Ehrhardt, C. (2005). Valutazione della modificazione della transferrina dei liposomi mediante microscopia a forza atomica e microscopia elettronica a trasmissione. EUR. J. Pharm. Biofarm. 60, 295–303. doi: 10.1016 / j. ejpb.2004.12.009
PubMed Abstract | CrossRef Full Text/Google Scholar
Bagatolli, L. A. (2009). Membrane e microscopia a fluorescenza. Recensioni in Fluorescenza 2007. New York, NY: Springer, 33-51. doi: 10.1007 | 978-0-387-88722-7_2
CrossRef Full Text/Google Scholar
Bakker-Woudenberg, I. A., Storm, G., e Woodle, M. C. (1994). Liposomi nel trattamento delle infezioni. J. Bersaglio della droga. 2, 363–371. doi: 10.3109 | 10611869408996811
PubMed Abstract/CrossRef Full Text/Google Scholar
Bendas, G. (2001). Immunoliposomi: un approccio promettente al targeting della terapia del cancro. BioDrugs 15, 215-224. doi: 10.2165 | 00063030-200115040-00002
CrossRef Full Text/Google Scholar
Bendas, G., Krause, A., Bakowsky, U., Vogel, J. e Rothe, U. (1999). Targetability di nuovi immunoliposomi preparati da una nuova tecnica di coniugazione anticorpale. Int. J. Pharm. 181, 79–93. il nostro sito utilizza cookie tecnici e di terze parti per migliorare la tua esperienza di navigazione e per migliorare la tua esperienza di navigazione., Lattmann, E., et al. (2011). Imaging al microscopio dei liposomi: dai coprioggetti al SEM ambientale. Int. J. Pharm. 417, 138–150. doi: 10.1016 / j. ijpharm.2010.12.021
PubMed Abstract | CrossRef Full Text/Google Scholar
Bouvrais, H., Pott, T., Bagatolli, LA, Ipsen, JH, and Meleard, P. (2010). Impatto delle sonde fluorescenti ancorate a membrana sulle proprietà meccaniche dei bistrati lipidici. Biochim. Biophys. Acta 1798, 1333-1337. doi: 10.1016 / j.bbamem.2010.03.026
PubMed Abstract | CrossRef Full Text/Google Scholar
Cullis, PR, Chonn, A., and Semple, SC (1998). Interazioni dei liposomi e dei sistemi di trasporto a base lipidica con le proteine del sangue: relazione al comportamento di clearance in vivo. Adv. Droga Deliv. Apoc 32, 3-17. doi: 10.1016/S0169-409X(97)00128-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Ding, B. S., Dziubla, T., Shuvaev, V. V., Muro, S., e Muzykantov, V. R. (2006). Sistemi avanzati di somministrazione di farmaci che colpiscono l’endotelio vascolare. Mol. Interv. 6, 98–112. doi: 10.1124 / mi.6.2.7
PubMed Abstract | CrossRef Full Text/Google Scholar
Henry, CR (2005). Morfologia delle nanoparticelle supportate. Prog. Surf. Sic. 80, 92–116. doi: 10.1016 / j.progsurf.2005.09.004
CrossRef Full Text/Google Scholar
Hua, S. (2013). Targeting siti di infiammazione: molecola di adesione intercellulare-1 come bersaglio per nuove terapie infiammatorie. Anteriore. Pharmacol. 4:127. doi: 10.3389 / fphar.2013.00127
PubMed Abstract | CrossRef Full Text/Google Scholar
Hua, S., Marks, E., Schneider, JJ, and Keely, S. (2015). I progressi nei sistemi di nano-delivery orali per la somministrazione di farmaci mirati al colon nella malattia infiammatoria intestinale: targeting selettivo per tessuti malati rispetto a quelli sani. Nanomedicina 11, 1117-1132. doi: 10.1016 / j.nano.2015.02.018
PubMed Abstract | CrossRef Full Text/Google Scholar
Hua, S., e Wu, S. Y. (2013). L’uso di nanocarrier a base lipidica per terapie del dolore mirate. Anteriore. Pharmacol. 4:143. doi: 10.3389 / fphar.2013.00143
PubMed Abstract | CrossRef Full Text/Google Scholar
Ishida, T., Harashima, H., e Kiwada, H. (2001). Interazioni dei liposomi con le cellule in vitro e in vivo: opsonins and receptors. Curr. Drug Metab. 2, 397–409. doi: 10.2174/1389200013338306
PubMed Abstract | CrossRef Full Text | Google Scholar
Jass, J., Tjarnhage, T., and Puu, G. (2000). From liposomes to supported, planar bilayer structures on hydrophilic and hydrophobic surfaces: an atomic force microscopy study. Biophys. J. 79, 3153–3163. doi: 10.1016/S0006-3495(00)76549-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Klymchenko, A. S., Oncul, S., Didier, P., Schaub, E., Bagatolli, L., Duportail, G., et al. (2009). Visualizzazione di domini lipidici in vescicole unilamellari giganti utilizzando una sonda a membrana sensibile all’ambiente basata su 3-idrossiflavone. Biochim. Biophys. Acta 1788, 495-499. doi: 10.1016 / j.bbamem.2008.10.019
PubMed Abstract | CrossRef Full Text/Google Scholar
Kuntsche, J., Horst, J. C., and Bunjes, H. (2011). Microscopia elettronica a trasmissione criogenica (cryo-TEM) per lo studio della morfologia dei sistemi di somministrazione di farmaci colloidali. Int. J. Pharm. 417, 120–137. doi: 10.1016 / j. ijpharm.2011.02.001
PubMed Abstract / CrossRef Full Text/Google Scholar
Le Bihan, O., Bonnafous, P., Marak, L., Bickel, T., Trepout, S., Mornet, S., et al. (2009). Tomografia crio-elettronica della trasmigrazione di nanoparticelle in liposomi. J. Struct. Biol. 168, 419–425. doi: 10.1016 / j. jsb.2009.07.006
PubMed Abstract | CrossRef Full Text/Google Scholar
Liang, X., Mao, G., and Ng, KY (2004a). Proprietà meccaniche e stabilità misurazione del liposoma contenente colesterolo su mica mediante microscopia a forza atomica. J. Interfaccia colloidale Sci. 278, 53–62.
PubMed Abstract/Google Scholar
Liang, X., Mao, G., e Ng, KY (2005). Effetto delle lunghezze delle catene di PEO-PPO-PEO su piccoli liposomi unilamellari morfologia e stabilità: un’indagine AFM. J. Interfaccia colloidale Sci. 285, 360–372. doi: 10.1016 / jcis.2004.11.042
PubMed Abstract | CrossRef Full Text/Google Scholar
Liang, X., Mao, G., e Simon Ng, KY (2004b). Sondare piccole vescicole unilpc unilamellari sulla superficie della mica mediante microscopia a forza atomica. I colloidi navigano. B Biointerfacce 34, 41-51.
PubMed Abstract/Google Scholar
Mao, G., Liang, X., e Ng, K. Y. S. (2004). Enciclopedia delle nanoscienze e delle nanotecnologie. Il film è stato diretto da Marcel Dekker.
Google Scholar
Mastrobattista, E., Koning, G. A., e Storm, G. (1999). Immunoliposomi per la consegna mirata di farmaci antitumorali. Adv. Droga Deliv. Apoc 40, 103-127. doi: 10.1016/S0169-409X(99)00043-5
CrossRef Full Text/Google Scholar
Mertins, O., e Dimova, R. (2013). Approfondimenti sulle interazioni del chitosano con le vescicole fosfolipidiche. Parte II: irrigidimento della membrana e formazione dei pori. Langmuir 29, 14552-14559. doi: 10.1021 | la4032199
PubMed Abstract/CrossRef Full Text/Google Scholar
Metselaar, JM, and Storm, G. (2005). Liposomi nel trattamento dei disturbi infiammatori. Esperto Opin. Droga Deliv. 2, 465–476. doi: 10.1517 | 17425247.2.3.465
PubMed Abstract / CrossRef Full Text/Google Scholar
Mohammed, A. R., Weston, N., Coombes, A. G., Fitzgerald, M., e Perrie, Y. (2004). Formulazione liposomica di farmaci scarsamente solubili in acqua: ottimizzazione del carico del farmaco e analisi ESEM della stabilità. Int. J. Pharm. 285, 23–34. doi: 10.1016 / j. ijpharm.2004.07.010
PubMed Abstract | CrossRef Full Text/Google Scholar
Moutardier, V., Tosini, F., Vlieghe, P., Cara, L., Delpero, J. R., and Clerc, T. (2003). Farmaci anticancro colloidali bioavailabilities nei modelli di somministrazione orale. Int. J. Pharm. 260, 23–38. doi: 10.1016/S0378-5173(03)00231-X
PubMed Abstract | CrossRef Full Text/Google Scholar
Murphy, DB, and Davidson, MW (2012a). Microscopia confocale a scansione laser. Fondamenti di Microscopia Ottica e Imaging Elettronico, 2 ° Edn. Hoboken, NJ: John Wiley& Figli, 265-305. doi: 10.1002/9781118382905.ch13
CrossRef Full Text/Google Scholar
Murphy, DB, e Davidson, MW (2012b). Microscopia a fluorescenza. Fondamenti di Microscopia ottica e Imaging elettronico. Weinheim: John Wiley & Figli, 199-231. doi: 10.1002/9781118382905.ch11
CrossRef Full Text / Google Scholar
Murphy, DB, e Davidson, MW (2012c). Fondamenti di Microscopia ottica e Imaging elettronico. Hoboken, NJ: John Wiley & Figli, 1-19. doi: 10.1002/9781118382905
CrossRef Full Text / Google Scholar
Murphy, DB, e Davidson, MW (2012d). Microscopia di polarizzazione. Fondamenti di Microscopia ottica e Imaging elettronico. Hoboken, NJ: John Wiley & Figli, 153-171. doi: 10.1002/9781118382905.ch9
CrossRef Full Text/Google Scholar
Muscariello, L., Rosso, F., Marino, G., Giordano, A., Barbarisi, M., Cafiero, G., et al. (2005). Una panoramica critica delle applicazioni ESEM in campo biologico. J. Cell. Physiol. 205, 328–334. doi: 10.1002 / jcp.20444
PubMed Abstract | CrossRef Full Text/Google Scholar
Nallamothu, R., Wood, G. C., Pattillo, C. B., Scott, R. C., Kiani, M. F., Moore, B. M., et al. (2006). Una vascolarizzazione tumorale ha mirato al sistema di consegna del liposoma per combretastatina A4: progettazione, caratterizzazione e valutazione in vitro. APS PharmSciTech 7: E32. il sito utilizza cookie tecnici, di terze parti, per migliorare la tua esperienza di navigazione e per migliorare la tua esperienza di navigazione. Fluticasone propionato liposomi per la consegna polmonare. Indiano J. Pharm. Sic. 71, 709–711.
Google Scholar
Orlova, E. V., Sherman, MB, Chiu, W., Mowri, H., Smith, L. C., e Gotto, A. M. Jr. (1999). Three-dimensional structure of low density lipoproteins by electron cryomicroscopy. Proc. Natl. Acad. Sci. U.S.A. 96, 8420–8425. doi: 10.1073/pnas.96.15.8420
CrossRef Full Text | Google Scholar
Ruozi, B., Belletti, D., Tombesi, A., Tosi, G., Bondioli, L., Forni, F., et al. (2011). AFM, ESEM, TEM, and CLSM in liposomal characterization: a comparative study. Int. J. Nanomedicine 6, 557–563. doi: 10.2147/IJN.S14615
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruozi, B., Tosi, G., Forni, F., Fresta, M., e Vandelli, M. A. (2005). Microscopia a forza atomica e spettroscopia di correlazione fotonica: due tecniche per la caratterizzazione rapida dei liposomi. EUR. J. Pharm. Sic. 25, 81–89. doi: 10.1016 / j. ejp.2005.01.020
PubMed Abstract | CrossRef Full Text/Google Scholar
Ruozi, B., Tosi, G., Leo, E., and Vandelli, M. A. (2007). Applicazione della microscopia a forza atomica per caratterizzare i liposomi come portatori di farmaci e geni. Talanta 73, 12-22. doi: 10.1016 / j.talanta.2007.03.031
PubMed Abstract | CrossRef Full Text/Google Scholar
Ruozi, B., Tosi, G., Tonelli, M., Bondioli, L., Mucci, A., Forni, F., et al. (2009). AFM phase imaging di campioni idratati: uno strumento versatile per completare lo studio chimico-fisico dei liposomi. J. Liposoma Res. 19, 59-67. doi: 10.1080 | 08982100802584071
PubMed Abstract / CrossRef Full Text/Google Scholar
Sawant, RR e Torchilin, VP (2012). Sfide nello sviluppo di terapie liposomiali mirate. APS J. 14, 303-315. doi: 10.1208 / s12248-012-9330-0
PubMed Abstract | CrossRef Full Text/Google Scholar
Senior, JH (1987). Destino e comportamento dei liposomi in vivo: una revisione dei fattori di controllo. Crit. Rev. Ther. Drug Carrier Syst. 3, 123–193.
PubMed Abstract/Google Scholar
Sercombe, L., Veerati, T., Moheimani, F., Wu, S. Y., Sood, A. K., e Hua, S. (2015). I progressi e le sfide del liposoma assisted drug delivery. Anteriore. Pharmacol. 6:286. doi: 10.3389 / fphar.2015.00286
CrossRef Full Text | Google Scholar
Severs, N. J. (2007). Freeze-fracture electron microscopy. Nat. Protoc. 2, 547–576. doi: 10.1038/nprot.2007.55
PubMed Abstract | CrossRef Full Text | Google Scholar
Sitterberg, J., Ozcetin, A., Ehrhardt, C., and Bakowsky, U. (2010). Utilising atomic force microscopy for the characterisation of nanoscale drug delivery systems. Eur. J. Pharm. Biopharm. 74, 2–13. doi: 10.1016/j.ejpb.2009.09.005
PubMed Abstract | CrossRef Full Text/Google Scholar
Torchilin, VP (1994). Immunoliposomi e immunoliposomi pegilati: possibile utilizzo per la somministrazione mirata di agenti di imaging. Immunometodi 4, 244-258. doi: 10.1006 / immu.1994.1027
PubMed Abstract | CrossRef Full Text/Google Scholar
Van Antwerpen, R., and Gilkey, JC (1994). La microscopia crio-elettronica rivela la sottostruttura umana della lipoproteina di densità bassa. J. Lipid Res. 35, 2223-2231.
PubMed Abstract | Google Scholar
Wang, X., Song, Y., Su, Y., Tian, Q., Li, B., Quan, J., et al. (2015). Are PEGylated liposomes better than conventional liposomes? A special case for vincristine. Drug Deliv. 29, 1–9. doi: 10.3109/10717544.2015.1027015
PubMed Abstract | CrossRef Full Text | Google Scholar
Weisman, S., Hirsch-Lerner, D., Barenholz, Y., and Talmon, Y. (2004). Nanostructure of cationic lipid-oligonucleotide complexes. Biophys. J. 87, 609–614. doi: 10.1529/biophysj.103.033480
PubMed Abstract | CrossRef Full Text/Google Scholar
Willis, M., and Forssen, E. (1998). Liposomi mirati al ligando. Adv. Droga Deliv. Apoc 29, 249-271. il nostro sito utilizza cookie tecnici e di terze parti per migliorare la tua esperienza di navigazione e per migliorare la tua esperienza di navigazione. Sistemi di co-somministrazione di farmaci basati su liposomi nelle cellule tumorali. Madre. Sic. Ing. C Madre. Biol. Appl. 71, 1327–1341. doi: 10.1016 / j.msec.2016.11.073
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply