Frontiere in Oncologia
Introduzione
Circa il 25% dei primi pazienti di cancro al seno ancora esperienza di recidiva locale e di sviluppare metastasi a distanza dopo il trattamento attivo (1), e quasi il 10% dei pazienti in stadio IV di malattia alla diagnosi iniziale nel mondo sviluppato, che è indicato come de novo cancro della mammella metastatico (MBC) (2). Nonostante i progressi del trattamento, MBC rimane incurabile e fino al 70-80% dei pazienti MBC muore di cancro entro 5 anni (2). Come risultato dell’eterogeneità di MBC, vengono sviluppati modelli prognostici multipli basati su fattori prognostici o punteggi per prevedere i loro esiti clinici e indirizzare i medici a prendere decisioni terapeutiche appropriate (3-5). Inoltre, ci sono anche una varietà di modelli prognostici per il cancro al seno con metastasi cerebrali (BCBM) per i medici di prevedere con precisione la sopravvivenza in questi pazienti (6, 7).
Il cancro al seno può metastatizzare ovunque nel corpo, ma principalmente metastatizza ai polmoni, alle ossa, al fegato, ai linfonodi non ascellari e al cervello (8). In particolare, la metastasi epatica (LM) non è solo un sito metastatico comune, ma è anche associata ad un aumento significativo del rischio di morte simile alla metastasi cerebrale, una mortalità sproporzionatamente più elevata rispetto alle metastasi polmonari o ossee (5, 8). Poiché la valutazione prognostica graduata (GPA) è ampiamente accettata nei pazienti con BCBM, i modelli prognostici sopra menzionati ci stimolano a proporre un modello pratico per BCLM (3-7). Il nostro obiettivo era costruire un modello prognostico affidabile e di facile utilizzo per BCLM e valutarne concordanza e accuratezza convalidandolo sia internamente che esternamente. Il modello prognostico potrebbe aiutare i medici a stimare il rischio di morte dei pazienti con BCLM e selezionare un trattamento ottimale.
Pazienti e metodi
Selezione dei pazienti
Il presente studio è stato approvato dai comitati etici indipendenti del FUSCC. Sono stati identificati pazienti MBC consecutivi diagnosticati al FUSCC da gennaio 2007 a dicembre 2018 (n = 9.062). I criteri di ammissibilità erano i seguenti: (1) carcinoma mammario confermato istologicamente, (2) pazienti di sesso femminile, (3) il fegato come primo sito di malattia metastatica nel carcinoma mammario de novo metastatico o ricorrente e (4) registrazioni complete e dettagliate. Sono stati esclusi i pazienti con carcinoma mammario bilaterale, altre neoplasie invasive o con follow-up non noti. Infine, sono stati selezionati 1.022 pazienti idonei per ulteriori analisi. I passaggi completi della selezione sono mostrati nella Figura S1.
Studio delle variabili e selezione dei valori di Cutoff
Sono state raccolte informazioni sulle seguenti variabili clinico-patologiche: età, sottotipi molecolari, informazioni sul trattamento precedente (chirurgia e chemioterapia sistemica), IFM, siti di metastasi extraepatiche (cervello, polmone, osso e linfonodi), caratteristiche delle metastasi epatiche (distribuzione, numero, diametro massimo), emoglobina (HB), test di funzionalità epatica e tempo di sopravvivenza. I sottotipi molecolari includevano lo stato del recettore ormonale (HR) e del recettore del fattore di crescita epidermico umano 2 (HER2). Abbiamo definito MFI come l’intervallo tra la data di diagnosi del cancro al seno primario e la data della prima metastasi a distanza. I punti di cutoff delle IFM utilizzati in questo studio sono stati di 3 e 24 mesi secondo il riferimento (9). Pertanto, i pazienti potrebbero essere suddivisi in tre gruppi: pazienti con MBC de novo (IFM < 3 mesi), pazienti con IFM breve (≤ 24 mesi) e pazienti con IFM lunga > 24 mesi. La metastasi linfonodale distante è stata definita come metastasi dei linfonodi ipsilaterali ascellari, sopraclavicolari, infraclavicolari o mammari interni. La diagnosi di LM era basata sull’imaging radiografico o sull’evidenza patologica. Le caratteristiche delle metastasi epatiche sono state valutate con l’aiuto di tomografia computerizzata addominale (CT), risonanza magnetica (MRI) o campioni di resezione chirurgica. Nel presente studio sono stati analizzati anche test di funzionalità epatica, tra cui bilirubina totale, alanina aminotransferasi (ALT), aspartato aminotransferasi (AST), fosfatasi alcalina (ALP), lattato deidrogenasi (LDH) e γ-glutamil transferasi in rapporto albumina (GAR). I campioni di sangue sono stati prelevati per test di laboratorio entro 1 settimana dalla diagnosi di LM. Le classificazioni della distribuzione, del numero o del diametro massimo delle metastasi epatiche e della LDH sono state basate su altri studi (10-13). I valori di cutoff per HB, bilirubina totale, ALT, AST e ALP sono stati determinati secondo i Criteri terminologici comuni per gli eventi avversi (CTCAE) perché anomalie moderate o di grado II nei livelli di emoglobina o nella funzionalità epatica potrebbero influenzare le scelte terapeutiche (14). Il valore di GAR è stato definito come un semplice rapporto tra il livello di serumy-glutamil transferasi (GGT, U/L) e il livello di albumina sierica (ALB g/L). OS dal momento della metastasi è stato misurato dalla data di diagnosi di LM alla morte per qualsiasi causa. L’ultimo periodo di follow-up è stato novembre 2019 con un tempo mediano di follow-up di 18,63 mesi. Se i pazienti sono stati persi per il follow-up, è stato censurato l’ultimo giorno di follow-up.
Analisi statistica
I pazienti sono stati suddivisi nella formazione (2007-2016, n = 715) e nella convalida (2016-2018, n = 307) impostata su un rapporto di 7:3. Il valore di taglio ottimale per GAR è stato scelto dal calcolo dell’indice Youden e ricevitore curva caratteristica operativa (ROC) analisi (Figura S2). Pearson chi-squared test o test esatto di Fisher è stato utilizzato per fare un confronto tra variabili categoriali. I modelli di regressione dei rischi proporzionali di Cox con il metodo di selezione all’indietro sono stati utilizzati per l’analisi multivariata e per calcolare i rapporti di rischio. I coefficienti di regressione sono stati calcolati attraverso l’analisi di regressione multivariata e quindi moltiplicati per 10 e arrotondati per rappresentare i punteggi prognostici finali. Il bootstrap è stato utilizzato per la convalida interna. Quindi, curve ROC dipendenti dal tempo e grafici di calibrazione sono stati utilizzati per valutare la discriminazione e la calibrazione di questo modello prognostico nel set di convalida. I valori di cutoff dei gruppi di rischio sono stati determinati dai grafici X-tile (15). L’analisi di sopravvivenza è stata eseguita utilizzando le curve di sopravvivenza di Kaplan-Meier e sono stati utilizzati test di log-rank per confrontare le curve di sopravvivenza. Tutti i valori P erano a due lati e i valori di P < 0.05 erano considerati statisticamente significativi. L’analisi statistica è stata effettuata utilizzando il software SPSS (SPSS 20, Chicago, IL, USA) e il software R versione 4.0.1.
Risultati
Caratteristiche e relazione con la stratificazione del rischio
Un totale di 1.022 pazienti selezionati in questo studio sono stati suddivisi in gruppi di formazione (n = 715) e validazione (n = 307). Una descrizione delle caratteristiche clinicopatologiche è riportata nella tabella 1 e nella tabella S1. Nel gruppo di formazione, c’erano 126 pazienti (17,6%) con diagnosi di MBC de novo e 589 pazienti (82,4%) con MBC ricorrente, di cui 297 pazienti (50,4%) avevano una IFM breve e 292 pazienti (49,6%) avevano una IFM lunga. L’età mediana alla diagnosi di LM era di 50 (intervallo 21-87) anni con 617 pazienti (86.3%) più giovane di 60 anni. Di questi pazienti, la percentuale di pazienti HR-positivi e HER2-positivi è stata rispettivamente del 62,2 e del 38,0%. Tra i pazienti MBC ricorrenti, quasi tutti i pazienti sono stati sottoposti a intervento chirurgico sul tumore primario (584, 99,2%) e hanno ricevuto (neo)chemioterapia adiuvante (569, 96,6%). I modelli di metastasi a distanza hanno mostrato che il sito più comune di metastasi extraepatiche era l’osso (42,7%) seguito da linfonodi distanti (36,1%), polmone (25,6%) e cervello (2,9%). Le metastasi epatiche erano caratterizzate da distribuzione diffusa e piccoli noduli, la maggior parte dei quali erano multipli (≥3 metastasi, 77,3%) ma piccoli noduli (≤3 cm, 59,4%) e coinvolgevano i lobi destro e sinistro (74,4%). Nella fase iniziale della LM, la funzionalità epatica era compromessa a vari livelli ma generalmente lieve. L’aumento di LDH (36,1%) e GAR (35,9%) sembrava essere indicatori sensibili di disfunzione epatica e anomalie moderate o superiori nei livelli di HB (2,9%), bilirubina totale (2,7%), ALT (3,6%), AST (9,5%) e ALP (3,9%) erano non comuni secondo CTCAE. Rispetto al gruppo a basso rischio, il gruppo intermedio e ad alto rischio presentava un più alto tasso di HR e negatività HER2, una breve MFI, metastasi extraepatiche, carico tumorale di metastasi epatiche e anomalie nei livelli di emoglobina o funzionalità epatica (tutti Ps ≤ 0,001), suggerendo che questi fattori potrebbero influenzare la prognosi di BCLM.
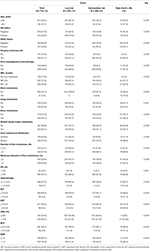
Tabella 1. Caratteristiche di base e sua relazione con la stratificazione del rischio del set di allenamento.
Modello Prognostico e Validazione
In multivariata di regressione di Cox del modello, sottotipi molecolari (HR e stato HER2), IFM, siti di metastasi extraepatiche (cervello, polmone e metastasi ossee), e test di funzionalità epatica (bilirubina totale, LDH, e GAR) sono stati associati con OS (Tabella 2). In particolare, il rischio di morte di pazienti HR negativi (HR 1.740, IC al 95% 1.424–2.127, P < 0.001) e HER2 negativi (HR 1.615, IC al 95% 1.316–1.983, P < 0.001) è aumentato rispetto a HR o HER2 controparti positive. La lunghezza di IFM anche avuto un impatto significativo sulla sopravvivenza di BCLM pazienti, e, di conseguenza, la sopravvivenza dei pazienti con una lunga IFM (HR 1.612, IC 95% 1.195–2.174, P < 0.001) è stato ridotto in confronto con i pazienti de novo MBC, e i pazienti con una breve IFM (HR 2.563, 95% CI 1.904–3.449, P < 0.001) era più di due volte il rischio di morte ad esse relative. Inoltre, la presenza di metastasi extraepatiche (metastasi cerebrali, polmonari e ossee) e funzionalità epatica anormale (bilirubina totale, LDH e GAR) erano tutte correlate con un impatto prognostico sfavorevole sul sistema operativo. Questo modello prognostico aveva l’area sotto la curva (AUC) di ROC dipendente dal tempo a 1 anno OS con 0,78 nel set di allenamento e 0,80 nel set di validazione, indicando che questo modello aveva una buona discriminazione (Figura 1). Il metodo di bootstrap è stato utilizzato per confermare la stabilità del nostro modello prognostico nel set di allenamento e i risultati finali sono stati piuttosto robusti (Tabella S2). Le curve di calibrazione del modello prognostico per 1 anno e 3 anni OS nel set di allenamento e 1 anno OS nel set di validazione hanno mostrato la sua buona concordanza (Figura 2).

Tabella 2. Modello di regressione Cox multivariata (Training set).
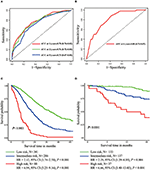
Figura 1. Curve ROC dipendenti dal tempo del modello prognostico nel set di allenamento (A) e nel set di validazione (B). Sopravvivenza globale da metastasi dei tre gruppi prognostici nel training (C) e nel set di validazione (D).
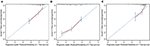
Figura 2. La curva di calibrazione per predire la sopravvivenza del paziente a 1 anno (A) e 3 anni (B) nel set di allenamento e a 1 anno (C) nel set di validazione.
Stratificazione del rischio e sopravvivenza

Tabella 3. Calcolo del punteggio e dei punti di taglio dei gruppi prognostici.
Discussione
Nella presente analisi di 1.022 pazienti trattati nel nostro istituto dal 2007 al 2018, abbiamo dimostrato che i sottotipi molecolari (HR e stato HER2), IFM, siti di metastasi extraepatiche (cervello, polmone e metastasi ossee), test di funzionalità epatica (bilirubina totale, LDH, e GAR) erano fattori prognostici indipendenti di BCLM pazienti. Quindi, un modello prognostico per i pazienti con BCLM è stato costruito utilizzando fattori prognostici.
Per quanto riguarda i sottotipi molecolari, HR positivo può indicare che la crescita e la proliferazione del cancro al seno sono ancora regolate da ormoni, chiamati tumori ormono-dipendenti. Allo stesso tempo, la terapia endocrina ha benefici tra cui poche reazioni avverse e effetti di lunga durata, che spesso possono portare benefici di sopravvivenza a lungo termine ai pazienti HR-positivi. Pertanto, HR positivo è stato considerato come un fattore significativo che suggerisce una prognosi favorevole nel cancro al seno precoce e metastatico (1, 3-5, 8-10, 16). Sebbene l’amplificazione e la sovraespressione di HER2 siano considerate un predittore di un rischio di metastasi a distanza e morte correlata al cancro al seno, gli agenti anti–HER2 sviluppati successivamente hanno notevolmente migliorato la sopravvivenza dei pazienti con cancro al seno HER2-positivi (2, 9, 17). Nell’era della terapia mirata, uno studio nei Paesi Bassi sudorientali ha rilevato che il rischio di mortalità dei pazienti HER2-negativi era aumentato del 44% (IC 95% 1,13–1,83, P = 0,003) rispetto ai pazienti HER2 positivi (9). Nel nostro studio, il rischio di morte dei pazienti HR-negativi e HER2-negativi è aumentato rispetto alle controparti HR o HER2-positive, in linea con queste osservazioni. I pazienti con una IFM breve, solitamente definita come ≤24 mesi, avevano una prognosi peggiore (3, 5, 9). Inoltre, i pazienti con MBC de novo sembravano avere una prognosi significativamente migliore rispetto ai pazienti con MBC ricorrenti, sebbene questa differenza fosse gradualmente ridotta con l’estensione dell’intervallo disease-free (DFI) o MFI (9, 18, 19). Lobbezoo et al. ha rilevato che i pazienti con IFM ≤24 mesi avevano un tempo di sopravvivenza significativamente più breve (9,1 vs. 29.4 mesi, P< 0,001) rispetto a quelli con malattie di stadio IV de novo, ma i pazienti con una IFM più lunga (>24 mesi) avevano una prognosi simile (27,9 contro 29,4 mesi, P = 0,73) (9). La possibile ragione di questo fenomeno è che i pazienti con MBC recidivante precedentemente sottoposti a terapia sistematica possono essere più resistenti alla chemioterapia rispetto ai pazienti naive alla terapia con MBC de novo, ma ulteriori indagini sono giustificate (9, 18, 19). Questo studio ha confermato che il tempo di sopravvivenza dei pazienti con una IFM lunga è stato ridotto rispetto alla MBC de novo con pazienti con una IFM breve che hanno dato un risultato significativamente peggiore.
La sopravvivenza MBC differiva significativamente in base ai siti metastatici e i pazienti con metastasi viscerali erano associati ad un aumentato rischio di mortalità rispetto a quelli con metastasi non viscerali (3-5, 9, 18). Inoltre, la presenza di metastasi cerebrali ha avuto un impatto maggiore sulla sopravvivenza rispetto a qualsiasi altro sito metastatico(3, 5, 9, 18). Non sorprende che più metastasi abbiano avuto un’influenza più sfavorevole sulla prognosi (3, 5, 9, 17, 18). In questa analisi, le metastasi extraepatiche, ad eccezione delle metastasi dei linfonodi distanti, potrebbero portare a una sopravvivenza ridotta, probabilmente perché le metastasi epatiche erano il fattore critico di pericolo di vita rispetto alle metastasi dei linfonodi.
Va notato che i pazienti con livelli più elevati di bilirubina avevano un rischio molto più basso per diverse malattie in parte attraverso le sue proprietà antiossidanti e antinfiammatorie (20). Uno studio recente ha anche riferito che una riduzione di quasi il 40% del rischio di morte è stata dimostrata tra i pazienti con cancro al seno precoce con un livello di bilirubina totale più elevato (21). Tuttavia, l’iperbilirubinemia è stata associata a prognosi infausta tra i pazienti con BCLM (22). È possibile che, a differenza della bilirubina totale relativamente più alta tra i pazienti con carcinoma mammario non metastatico, una bilirubina aumentata 1,5 volte superiore al limite superiore della norma (ULN) tra i pazienti con BCLM possa prevedere gravi lesioni epatiche e, quindi, contribuire alla sospensione del farmaco o all’encefalopatia epatica.
L’effetto Warburg spinge le cellule tumorali a dipendere dalla glicolisi aerobica anche quando l’apporto di ossigeno è sufficiente, che è il segno distintivo del metabolismo del cancro in contrasto con i tessuti normali (23). LDH svolge un ruolo indispensabile nella glicolisi grazie alla sua capacità di convertire il piruvato in lattato durante le condizioni anaerobiche (24). I livelli deregolamentati di LDH potrebbero riflettere un carico tumorale più elevato, una risposta al trattamento più povera e una prognosi, che erano stati precedentemente riportati in tumori multipli (21, 24-26). Una meta-analisi sull’effetto prognostico di LDH in pazienti con cancro al seno ha mostrato che livelli più elevati di LDH hanno portato a OS insoddisfacente e sopravvivenza libera da progressione, che ha incluso 11 studi che hanno coinvolto 6.102 pazienti (27).
GGT, il principale antiossidante endogeno, rende gli amminoacidi precursori assimilati e coinvolge nella sintesi del glutatione (28). Il GGT nei tumori consente alle cellule di ricostituire rapidamente il glutatione dopo aver ricevuto una terapia antitumorale pro-ossidante e, pertanto, è correlato alla resistenza ai farmaci e alla scarsa sopravvivenza (29). È interessante notare che, Fentiman et al. ha riferito che è stata identificata una relazione significativamente positiva tra GGT elevato e rischio di cancro al seno (30). L’ALB sintetizzato dal fegato funziona come antiossidante, trasportatore di sostanze nutritive e partecipa alle vie del segnale grazie alle sue proprietà strutturali uniche (31). L’ipoalbuminemia di solito si verifica nei pazienti oncologici avanzati ed è attribuita a vari meccanismi, tra cui compromissione della sintesi epatica, aumento del catabolismo e cachessia (21, 31). L’ipoalbuminemia è un indicatore indipendente di prognosi infausta di vari tumori (21, 22, 32, 33). In contrasto con la diminuzione dei livelli di albumina sierica, i livelli sierici di GGT tendono ad essere elevati quando la funzionalità epatica è compromessa. Pertanto, GAR sulla base dei due parametri di cui sopra può avere il vantaggio di riflettere la capacità di riserva del fegato e prevedere la prognosi (32, 33). Nello studio attuale, la funzionalità epatica anormale (bilirubina totale, LDH e GAR) erano tutte correlate con un impatto prognostico sfavorevole sul sistema operativo.
Dopo aver analizzato la prognosi di 123 pazienti BCLM, Duan et al. trovato che i pazienti con tre o più metastasi epatiche portavano 2.rischio di morte aumentato di 26 volte rispetto ai pazienti con metastasi epatiche<3 in analisi multivariata (10). Tuttavia, le caratteristiche delle metastasi epatiche in questo studio sembravano non fare differenza. Ci sono due potenziali ragioni che contribuiscono a questa discrepanza. Prima di tutto, la distribuzione, il numero e il diametro massimo delle metastasi epatiche erano significativamente diversi nei tre gruppi di rischio, indicando che il rischio di mortalità aumentava con l’espansione delle metastasi epatiche nell’analisi univariata. Successivamente, la funzionalità epatica anormale era strettamente correlata al carico tumorale delle metastasi epatiche, regolando il ruolo di questi fattori nell’analisi multivariata.
Ci sono stati molti studi sui fattori prognostici nell’impostazione di BCLM. Un’analisi di 145 pazienti BCLM ha mostrato che ipoalbuminemia, età avanzata e negatività ER erano predittori indipendenti di scarsa sopravvivenza (22). Un’analisi del registro greco ha ottenuto risultati simili, in cui la positività delle risorse umane, il basso grado istologico, l’assenza di metastasi extraepatiche e il buon stato di prestazione erano fattori prognostici significativi per la prognosi favorevole nell’analisi univariata (34). Un recente studio basato sulla popolazione che ha incluso più di 4.000 pazienti con BCLM de novo ha identificato fattori demografici e socioeconomici, grado patologico, numero totale di metastasi extraepatiche, trattamento e sottotipo molecolare come parametri che influenzano significativamente la sopravvivenza globale (17). Regierer et al. sviluppato un punteggio prognostico per MBC basato sullo stato HR, IFM e siti di metastasi per prevedere la loro prognosi e individuare il trattamento ottimale, che è stato convalidato internamente ed esternamente (5). Sfortunatamente, lo stato HER2 non è stato incluso nel punteggio prognostico e, quindi, ne ha limitato l’applicabilità. Il GPA mammario modificato per i pazienti con BCBM che integrava quattro semplici parametri clinici ha avuto un ruolo immediato nel predire la loro sopravvivenza, ma non è stato applicabile per i pazienti con BCLM (7). A nostra conoscenza, non esiste un modello prognostico che integri questi fattori prognostici per i pazienti con BCLM, quindi il nostro modello ha un senso pragmatico.
C’erano anche alcune limitazioni in questa ricerca. In primo luogo, uno studio a centro singolo e retrospettivo ha inevitabilmente portato a pregiudizi di selezione sebbene il nostro modello prognostico sia stato convalidato internamente ed esternamente. In secondo luogo, i pazienti che hanno sviluppato metastasi epatiche più tardi nel corso della malattia sono stati esclusi in modo che non siamo stati in grado di valutare questi pazienti. In terzo luogo, in questo studio non erano disponibili informazioni dettagliate sullo stato di prestazione e sul trattamento.
Conclusioni
Nonostante queste limitazioni, questa ricerca può fornire un modello prognostico semplice e affidabile. Il principale vantaggio del nostro studio è l’incorporazione di parametri facilmente accessibili nella pratica clinica sulla base del grande campione di pazienti BCLM. A parte la squisita classificazione dei tumori secondo i metodi di sequenziamento di nuova generazione, il nostro modello può aiutare a identificare sottogruppi con prognosi diversa e guidare la terapia successiva.
Data Availability Statement
I contributi originali presentati nello studio sono inclusi nell’articolo/Materiale supplementare, ulteriori richieste possono essere indirizzate all’autore/i corrispondente/i.
Ethics Statement
Il presente studio è stato approvato dai comitati etici indipendenti del FUSCC. I pazienti / partecipanti hanno fornito il loro consenso informato scritto a partecipare a questo studio.
Contributi dell’autore
LJ ha proposto lo studio. XZ e YG hanno raccolto i dati. LJ e LF hanno analizzato i dati e scritto la prima bozza. ZW recensì criticamente il manoscritto. Tutti gli autori hanno contribuito all’articolo e hanno approvato la versione presentata.
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di rapporti commerciali o finanziari che potrebbero essere interpretati come un potenziale conflitto di interessi.
Riconoscimenti
Riconosciamo Lei Cheng per l’analisi dei dati.
Materiale supplementare
Abbreviazioni
BCLM, cancro al seno con metastasi epatiche; FUSCC, Fudan University Shanghai Cancer Center; ROC, curva caratteristica di funzionamento ricevitore; MFI, metastatico intervallo libero, risorse umane, hazard ratio; IC, intervallo di confidenza; OS, overall survival; MBC, metastasi del cancro al seno; BCBM, il cancro al seno con metastasi cerebrali; LM, metastasi epatiche; GPA, classificati valutazione prognostica; HB, emoglobina; HR, ormone recettore; HER2, human epidermal growth factor receptor 2; TC, tomografia computerizzata; risonanza magnetica, risonanza magnetica; ALT alanina aminotransferasi; AST aspartato aminotransferasi; ALP, fosfatasi alcalina; LDH, lattato deidrogenasi; GAR, γ-glutamil transferasi all’albumina rapporto; GGT, γ-glutamil transferasi; ALB, albumina; CTCAE, Criteri terminologici comuni per gli eventi avversi; ULN, limite superiore della norma.
4. Puente J, Lopez-Tarruella S, Ruiz A, Lluch A, Pastor M, Alba E, et al. Indice prognostico pratico per pazienti con carcinoma mammario recidivante metastatico: analisi retrospettiva di 2.322 pazienti dal registro GEICAM spagnolo El Alamo. Trattamento del cancro al seno. (2010) 122:591–600. doi: 10.1007/s10549–009-0687–4
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Regierer AC, Wolters R, Ufen MP, Weigel A, Novopashenny I, Kohne CH, et al. An internally and externally validated prognostic score for metastatic breast cancer: analysis of 2269 patients. Ann Oncol. (2014) 25:633–8. doi: 10.1093/annonc/mdt539
PubMed Abstract | CrossRef Full Text
6. Il nostro obiettivo è quello di migliorare la qualità della vita. Predire la sopravvivenza nelle donne con cancro al seno e metastasi cerebrali: un nomogramma supera gli attuali modelli di previsione della sopravvivenza. Cancro. (2012) 118:3749–57. doi: 10.1002 / cncr.26716
PubMed Abstract | CrossRef Full Text/Google Scholar
7. Subbiah IM, Lei X, Weinberg JS, Sulman EP, Chavez-MacGregor M, Tripathy D, et al. Validazione e sviluppo di una valutazione prognostica modificata della mammella come strumento di sopravvivenza in pazienti con carcinoma mammario e metastasi cerebrali. J Clin Oncol. (2015) 33:2239–45. doi: 10.1200 / JCO.2014.58.8517
PubMed Abstract | CrossRef Full Text/Google Scholar
9. I nostri servizi sono a vostra disposizione per ogni esigenza e per ogni esigenza. Prognosi del carcinoma mammario metastatico: ci sono differenze tra i pazienti con carcinoma mammario metastatico de novo e ricorrente? Br J Cancer. (2015) 112:1445–51. doi: 10.1038/bjc.2015.127
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Duan XF, Dong NN, Zhang T, Li Q. The prognostic analysis of clinical breast cancer subtypes among patients with liver metastases from breast cancer. Int J Clin Oncol. (2013) 18:26–32. doi: 10.1007/s10147–011-0336-x
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Il nostro sito utilizza cookie tecnici e di terze parti. Validità e affidabilità della versione dei risultati riportati dai pazienti del National Cancer Institute degli Stati Uniti dei criteri terminologici comuni per gli eventi avversi (PRO-CTCAE). JAMA Oncol. (2015) 1:1051–9. doi: 10.1001 / jamaoncol.2015.2639
PubMed Abstract | CrossRef Full Text/Google Scholar
17. Xie J, Xu Z. Uno studio basato sulla popolazione sulle metastasi epatiche in donne con carcinoma mammario di nuova diagnosi. Cancer Epidemiol Biomarkers Indietro. (2019) 28:283–92. doi: 10.1158/1055–9965.EPI-18–0591
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Dawood S, Broglio K, Ensor J, Hortobagyi GN, Giordano SH. Survival differences among women with de novo stage IV and relapsed breast cancer. Ann Oncol. (2010) 21:2169–74. doi: 10.1093/annonc/mdq220
PubMed Abstract | CrossRef Full Text
19. den Brok WD, Speers CH, Gondara L, Baxter E, Tyldesley SK, Lohrisch CA. Sopravvivenza con carcinoma mammario metastatico basato sulla presentazione iniziale, de novo versus recidivato. Trattamento del cancro al seno. (2017) 161:549–56. doi: 10.1007 / s10549–016-4080–9
PubMed Abstract | CrossRef Full Text/Google Scholar
20. Fujiwara R, Haag M, Schaeffeler E, Nies AT, Zanger UM, Schwab M. Regolazione sistemica dell’omeostasi della bilirubina: potenziali benefici dell’iperbilirubinemia. Epatologia. (2018) 67:1609–19. doi: 10.1002/hep.29599
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Liu X, Meng QH, Ye Y, Hildebrandt MAT, Gu J, Wu X. Prognostic significance of pretreatment serum levels of albumin, LDH and total bilirubin in patients with non-metastatic breast cancer. Carcinogenesis. (2015) 36:243–8. doi: 10.1093/carcin/bgu247
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Vander Heiden MG, Cantley LC, Thompson CB. Comprendere l’effetto Warburg: i requisiti metabolici della proliferazione cellulare. Scienza. (2009) 324:1029–33. doi: 10.1126 / scienza.1160809
PubMed Abstract | CrossRef Full Text/Google Scholar
24. Mishra D, Banerjee D. Lattato deidrogenasi come legami metabolici tra tumore e stroma nel microambiente tumorale. Cancro. (2019) 11:750. doi: 10.3390/cancers11060750
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Pelizzari G, Basile D, Zago S, Lisanti C, Bartoletti M, Bortot L, et al. Lactate dehydrogenase (ldh) response to first-line treatment predicts survival in metastatic breast cancer: first clues for a cost-effective and dynamic biomarker. Cancers. (2019) 11:1243. doi: 10.3390/cancers11091243
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Hopkins AM, Rowland A, McKinnon RA, Sorich MJ. Predictors of long-term disease control and survival for HER2-positive advanced breast cancer patients treated with pertuzumab, trastuzumab, and docetaxel. Front Oncol. (2019) 9:789. doi: 10.3389/fonc.2019.00789
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Pentheroudakis G, Fountzilas G, Bafaloukos D, Koutsoukou V, Pectasidi D, Skarlos D, et al. Carcinoma mammario metastatico con metastasi epatiche: un’analisi del registro delle caratteristiche clinico-patologiche, di gestione e di esito di 500 donne. Trattamento del cancro al seno. (2006) 97:237–44. doi: 10.1007 / s10549–005-9117–4
PubMed Abstract | CrossRef Full Text / Google Scholar
Leave a Reply