Halobetasol Propionate Ointment
Forma di dosaggio: unguento
Medicamente recensito da Drugs.com. Ultimo aggiornamento marzo 1, 2020.
- Panoramica
- Effetti Collaterali
- Dosaggio
- Professional
- Interazioni
- Più
Halobetasol Propionato Unguento Descrizione
Halobetasol Propionato Unguento, 0.05% contiene halobetasol propionato, una sintesi di corticosteroidi per uso topico uso dermatologico. I corticosteroidi costituiscono una classe di steroidi principalmente sintetici utilizzati localmente come agente antinfiammatorio e antiprurito.
Chimicamente il propionato di alobetasolo è 21-cloro-6α, 9-difluoro-11β, 17-diidrossi-16β-metilpregna-1, 4-diene-3-20-dione, 17-propionato, C25H31ClF2O5. Ha la seguente formula strutturale:
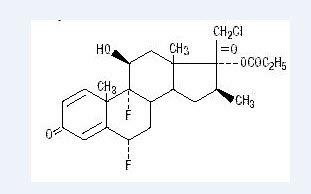
Il propionato di alobetasolo ha il peso molecolare di 485. È una polvere cristallina bianca insolubile in acqua.
Ogni grammo di Unguento alobetasolo propionato contiene 0.5 mg / g di propionato di alobetasolo in una base di stearato di alluminio, cera d’api, pentaeritritolo cocoato, vaselina, glicole propilenico, sorbitan sesquioleato e citrato di stearile.
Unguento alobetasolo propionato-Farmacologia clinica
Come altri corticosteroidi topici, il propionato di alobetasolo ha azioni antinfiammatorie, antipruriginose e vasocostrittive. Il meccanismo dell’attività antinfiammatoria dei corticosteroidi topici, in generale, non è chiaro. Tuttavia, si pensa che i corticosteroidi agiscano per induzione delle proteine inibitorie della fosfolipasi A2, chiamate collettivamente lipocortine. Si ipotizza che queste proteine controllino la biosintesi di potenti mediatori dell’infiammazione come prostaglandine e leucotrieni inibendo il rilascio del loro precursore comune acido arachidonico. L’acido arachidonico viene rilasciato dai fosfolipidi di membrana dalla fosfolipasi A2.
Farmacocinetica
L’entità dell’assorbimento percutaneo dei corticosteroidi topici è determinata da molti fattori tra cui il veicolo e l’integrità della barriera epidermica. Le medicazioni occlusive con idrocortisone fino a 24 ore non hanno dimostrato di aumentare la penetrazione; tuttavia, l’occlusione di idrocortisone per 96 ore migliora notevolmente la penetrazione. I corticosteroidi attuali possono essere assorbiti dalla pelle intatta normale. L’infiammazione e / o altri processi patologici nella pelle possono aumentare l’assorbimento percutaneo.
Studi sull’uomo e sugli animali indicano che meno del 6% della dose applicata di alobetasol propionato entra in circolazione entro 96 ore dalla somministrazione topica dell’unguento Alobetasol propionato.
Gli studi effettuati con l’unguento del proponiato del Halobetasol indicano che è nella gamma super-alta di potenza rispetto ad altri corticosteroidi attuali.
Indicazioni ed uso per l’unguento del proponiato del Halobetasol
L’unguento del proponiato del Halobetasol è un corticosteroide super-alto di potenza indicato per il sollievo delle manifestazioni infiammatorie e pruriginose delle dermatosi corticosteroide-rispondenti. Il trattamento oltre due settimane consecutive non è raccomandato e il dosaggio totale non deve superare i 50 g/settimana a causa del potenziale per il farmaco di sopprimere l’asse ipotalamo-ipofisi-surrene (HPA). L’uso nei bambini sotto i 12 anni di età non è raccomandato.
Come con altri corticosteroidi altamente attivi, la terapia deve essere interrotta una volta raggiunto il controllo. Se non si osserva alcun miglioramento entro 2 settimane, può essere necessaria una rivalutazione della diagnosi.
Controindicazioni
L’unguento al propionato di Halobetasol è controindicato in quei pazienti con una storia di ipersensibilità a uno qualsiasi dei componenti del preparato.
Precauzioni
Generale
L’assorbimento sistemico dei corticosteroidi topici può produrre la soppressione reversibile dell’asse ipotalamo – ipofisi-surrene (HPA) con il potenziale di insufficienza glucocorticoide dopo la sospensione del trattamento. Manifestazioni della sindrome di Cushing, iperglicemia e glucosuria possono anche essere prodotte in alcuni pazienti mediante assorbimento sistemico di corticosteroidi topici durante il trattamento.
I pazienti che applicano uno steroide topico su un’ampia superficie o su aree occlusive devono essere valutati periodicamente per rilevare la soppressione dell’asse HPA. Questo può essere fatto utilizzando la stimolazione ACTH, cortisolo plasma AM e test di cortisolo libero urinario. I pazienti che ricevono corticosteroidi super potenti non devono essere trattati per più di 2 settimane alla volta e solo piccole aree devono essere trattate contemporaneamente a causa dell’aumentato rischio di soppressione dell’HPA.
L’unguento del proponiato di Halobetasol ha prodotto la soppressione di asse di HPA una volta usato nelle dosi divise a 7 grammi al giorno per una settimana in pazienti con psoriasi. Questi effetti sono stati reversibili dopo la sospensione del trattamento.
Se si nota la soppressione dell’asse HPA, si deve tentare di ritirare il farmaco, ridurre la frequenza di applicazione o sostituire un corticosteroide meno potente. Il recupero della funzione dell’asse HPA è generalmente rapido dopo l’interruzione dei corticosteroidi topici. Raramente, possono verificarsi segni e sintomi di insufficienza glucocorticoide che richiedono corticosteroidi sistemici supplementari. Per informazioni sulla supplementazione sistemica, vedere informazioni sulla prescrizione di tali prodotti.
I pazienti pediatrici possono essere più suscettibili alla tossicità sistemica da dosi equivalenti a causa della loro maggiore superficie cutanea al rapporto di massa corporea (vedere PRECAUZIONI: Uso pediatrico).
Se si sviluppa irritazione, l’unguento alobetasol propionato deve essere interrotto e deve essere istituita una terapia appropriata. La dermatite allergica da contatto con corticosteroidi viene solitamente diagnosticata osservando la mancata guarigione piuttosto che notare una esacerbazione clinica come con la maggior parte dei prodotti topici che non contengono corticosteroidi. Tale osservazione dovrebbe essere corroborata con appropriati patch test diagnostici.
Se sono presenti o si sviluppano infezioni cutanee concomitanti, deve essere usato un appropriato agente antifungino o antibatterico. Se una risposta favorevole non si verifica prontamente, l’uso di Unguento alobetasol propionato deve essere interrotto fino a quando l’infezione non è stata adeguatamente controllata.
L’unguento al propionato di Halobetasol non deve essere usato nel trattamento della rosacea o della dermatite periorale e non deve essere usato sul viso, sull’inguine o sulle ascelle.
Informazioni per i pazienti
I pazienti che utilizzano corticosteroidi topici devono ricevere le seguenti informazioni e istruzioni:
- Il farmaco deve essere usato come indicato dal medico. È solo per uso esterno. Evitare il contatto con gli occhi.
- Il farmaco non deve essere usato per qualsiasi disturbo diverso da quello per cui è stato prescritto.
- L’area della pelle trattata non deve essere fasciata, altrimenti coperta o avvolta, in modo da essere occlusiva se non indicato dal medico.
- I pazienti devono segnalare al medico qualsiasi segno di reazioni avverse locali.\
Test di laboratorio
I seguenti test possono essere utili nella valutazione dei pazienti per la soppressione dell’asse HPA: ACTH-stimulation test; A. M. plasma cortisol test; Urinary free-cortisol test.
Carcinogenesi, mutagenesi, compromissione della fertilità
Non sono stati condotti studi a lungo termine sugli animali per valutare il potenziale cancerogeno di alobetasolo propionato. Effetti mutageni positivi sono stati osservati in due saggi di genotossicità. Halobetasol propionato è risultato positivo in un test del micronucleo di criceto cinese e in un test di mutazione del gene del linfoma di topo in vitro.
Gli studi condotti nel ratto dopo somministrazione orale a dosi fino a 50 mcg/kg/die non hanno indicato alcuna compromissione della fertilità o delle prestazioni riproduttive generali.
In altri test di genotossicità, l’alobetasolo propionato non è risultato genotossico nel test Ames / Salmonella, nel test di scambio cromatidico sorella in cellule somatiche del criceto cinese, in studi di aberrazione cromosomica su cellule germinali e somatiche di roditori e in un test a punti sui mammiferi per determinare mutazioni puntiformi.
Gravidanza
Effetti teratogeni: Gravidanza Categoria C
I corticosteroidi hanno dimostrato di essere teratogeni negli animali da laboratorio quando somministrati per via sistemica a livelli di dosaggio relativamente bassi. Alcuni corticosteroidi hanno dimostrato di essere teratogeni dopo l’applicazione cutanea in animali da laboratorio.
Halobetasol propionato ha dimostrato di essere teratogeno nei ratti SPF e nei conigli di tipo chinchilla quando somministrato per via sistemica durante la gestazione a dosi comprese tra 0,04 e 0,1 mg/kg nei ratti e 0,01 mg / kg nei conigli. Queste dosi sono circa 13, 33 e 3 volte, rispettivamente, la dose topica umana di unguento propionato alobetasolo. L’alobetasolo propionato è risultato embriotossico nei conigli ma non nei ratti.
Palatoschisi è stata osservata sia nei ratti che nei conigli. L’onfalocele è stato osservato nei ratti, ma non nei conigli.
Non esistono studi adeguati e ben controllati sul potenziale teratogeno di alobetasolo propionato in donne in gravidanza. Halobetasol Propionato Unguento deve essere usato durante la gravidanza solo se il potenziale beneficio giustifica il potenziale rischio per il feto.
Le madri che allattano
I corticosteroidi somministrati per via sistemica compaiono nel latte umano e potrebbero sopprimere la crescita, interferire con la produzione endogena di corticosteroidi o causare altri effetti indesiderati. Non è noto se la somministrazione topica di corticosteroidi possa determinare un assorbimento sistemico sufficiente a produrre quantità rilevabili nel latte materno. Poiché molti farmaci sono escreti nel latte umano, si deve usare cautela quando l’unguento alobetasolo propionato viene somministrato a una donna che allatta.
Uso pediatrico
La sicurezza e l’efficacia dell’unguento alobetasolo propionato nei pazienti pediatrici non sono state stabilite e l’uso nei pazienti pediatrici sotto i 12 anni non è raccomandato. A causa di un più alto rapporto della superficie della pelle alla massa corporea, i pazienti pediatrici sono ad un maggior rischio che gli adulti della soppressione di asse di HPA e della sindrome di Cushing quando sono trattati con i corticosteroidi attuali. Sono quindi anche a maggior rischio di insufficienza surrenalica durante o dopo la sospensione del trattamento. Effetti avversi, tra cui strie, sono stati riportati con un uso inappropriato di corticosteroidi topici nei neonati e nei bambini.
Soppressione dell’asse HPA, sindrome di Cushing, ritardo della crescita lineare, aumento di peso ritardato e ipertensione intracranica sono stati riportati in bambini trattati con corticosteroidi topici. Le manifestazioni di soppressione surrenale nei bambini includono bassi livelli di cortisolo plasmatico e un’assenza di risposta alla stimolazione ACTH. Le manifestazioni di ipertensione intracranica includono fontanelle sporgenti, mal di testa e papilledema bilaterale.
Uso geriatrico
Su 850 pazienti trattati con Alobetasolo propionato unguento negli studi clinici, il 21% aveva 61 anni e oltre e il 6% aveva 71 anni e oltre. Non sono state osservate differenze complessive in termini di sicurezza o efficacia tra questi pazienti e i pazienti più giovani; e altre esperienze cliniche riportate non hanno identificato differenze nelle risposte tra i pazienti anziani e i pazienti più giovani, ma non si può escludere una maggiore sensibilità di alcuni individui più anziani.
Reazioni avverse
Negli studi clinici controllati, gli eventi avversi più frequenti riportati per Halobetasol Propionato Unguento includevano bruciore o bruciore nell ‘ 1,6% dei pazienti. Le reazioni avverse riportate meno frequentemente sono state pustolazione, eritema, atrofia cutanea, leucoderma, acne, prurito, infezione secondaria, telangiectasia, orticaria, pelle secca, miliaria, parestesia ed eruzione cutanea.
Le seguenti ulteriori reazioni avverse locali sono riportate raramente con corticosteroidi topici e possono verificarsi più frequentemente con corticosteroidi ad alta potenza, come l’unguento alobetasolo propionato. Queste reazioni sono elencate in un ordine approssimativo decrescente di occorrenza: follicolite, ipertricosi, eruzioni acneiformi, ipopigmentazione, dermatite periorale, dermatite allergica da contatto, infezione secondaria, strie e miliaria.
Per segnalare REAZIONI AVVERSE SOSPETTE, contattare Teligent Pharma, Inc. a 1-856-697-1441, o FDA a 1-800-FDA-1088 o www.fda.gov / medwatch.
Sovradosaggio
per uso Topico, Halobetasol Propionato Unguento può essere assorbito in quantità sufficiente a produrre effetti sistemici (vedere PRECAUZIONI)h
Halobetasol Propionato Pomata Dosaggio e Amministrazione
Applicare uno strato sottile di Halobetasol Propionato Unguento per la pelle colpita una volta o due volte al giorno, come indicato dal vostro medico, e strofinare delicatamente e completamente.
L’unguento del proponiato di Halobetasol è un corticosteroide topico ad altissima potenza; pertanto, il trattamento deve essere limitato a due settimane e non devono essere utilizzate quantità superiori a 50 g/wk. Come con altri corticosteroidi, la terapia deve essere interrotta una volta raggiunto il controllo. Se non si osserva alcun miglioramento entro 2 settimane, può essere necessaria una rivalutazione della diagnosi.
L’unguento al propionato di Halobetasol non deve essere usato con medicazioni occlusive.
Come viene fornito l’unguento al propionato di alobetasolo
L’unguento al propionato di alobetasolo, 0,05%, viene fornito nelle seguenti dimensioni del tubo:
50 g (NDC 63739-998-67)
CONSERVAZIONE
Conservare l’unguento al propionato di alobetasolo tra 15°C e 30°C (59°F e 86°F).
Prodotto da:
Teligent Pharma, Inc.
Buena, NJ 08310
Distribuito da:
McKesson Corporation
dba Sky Packaging
4971 Southridge Blvd., Suite 101
Memphis, TN 38141
PI-073-00
C101430 Rev 02/2020
ETICHETTA DEL PACCHETTO.PANNELLO DI VISUALIZZAZIONE PRINCIPALE Cartone da 50 grammi
NDC 63739-998-67
Propionato di alobetasolo
Unguento, 0,05%
Solo per uso topico.
Non per l’uso negli occhi.
Peso netto. 50 grams
Rx Only

| HALOBETASOL PROPIONATE Halobetasol Propionate Ointment |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – McKesson Corporation (140529962)
Registrant – Teligent Pharma, Inc. (011036910)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Teligent Pharma, Inc. | 011036910 | manufacture(63739-998) | |
Frequently asked questions
- Halobetasol vs. clobetasol – how do they compare?
- Può essere usato per l’edera velenosa?
- Può essere utilizzato sul cuoio capelluto?
di Più su halobetasol attualità
- Effetti Collaterali
- Durante la Gravidanza o l’Allattamento al seno
- il Dosaggio di Informazioni
- interazioni Farmacologiche
- Confronto Alternative
- Prezzi & Coupon
- 25 Recensioni
- classe di Droga: topical steroids
Consumer resources
- Patient Information
- Halobetasol Topical application (Advanced Reading)
Professional resources
- Prescribing Information
- Halobetasol (FDA)
- Halobetasol Cream (FDA)
- Halobetasol Foam (FDA)
Other brands Ultravate, Lexette, Bryhali, Halonate
Related treatment guides
- Plaque Psoriasis
- Eczema
- Psoriasis
- Atopic Dermatitis
- Granuloma Annulare
- Dermatitis
Medical Disclaimer
Leave a Reply