Latenza virale: Giù ma non fuori
Quando immaginate i virus che si nascondono dal vostro sistema immunitario, si può pensare al virus herpes simplex, responsabile di herpes labiale e herpes genitale, o il virus varicella-zoster, che causa l’herpes zoster. Questi virus possono persistere per decenni in uno stato simile all’ibernazione noto come latenza ed evitare il rilevamento da parte del nostro sistema immunitario (Kennedy et al., 2015). I virus latenti a volte possono risvegliarsi e iniziare a replicarsi ancora una volta, causando sintomi e diffondendo l’infezione (Lieberman, 2016).
Il virus dell’immunodeficienza umana (HIV) è allo stesso modo un maestro artista di fuga. Forma un serbatoio latente all’inizio dell’infezione, consentendo al virus di eludere il sistema immunitario e di sopravvivere a lungo termine. Le persone che vivono con l’HIV assumono farmaci giornalieri noti come terapia antiretrovirale combinata (o ART) per prevenire la replicazione del virus. Tuttavia, l’ARTE non è una cura, in quanto non mira a virus già latenti. Questi farmaci sono quindi somministrati per tutta la vita di un individuo: interrompere il trattamento, anche per alcune settimane, consentirà ai virus latenti di riattivare e riaccendere l’infezione attiva. Le persone con HIV possono aspettarsi di avere una vita lunga e sana a causa dell’ARTE, ma i virus latenti saranno sempre presenti nel loro corpo.
Trovare una cura per l’HIV richiede essere in grado di eliminare o controllare il serbatoio virale latente. Tuttavia, alcune questioni chiave devono ancora essere affrontate per raggiungere questo obiettivo. Come, quando e dove l’HIV stabilisce la latenza? Qual è la dimensione del serbatoio latente e il modo migliore per misurarlo? Che cosa innesca virus latenti per riattivare? Ora, a eLife, Miles Davenport, Brandon Keele e colleghi dell’Università del New South Wales e del Frederick National Laboratory for Cancer Research-tra cui Mykola Pinkevych come primo autore-riferiscono quando il serbatoio latente è stabilito in un modello di primate non umano dell’HIV e quanto del serbatoio può essere riattivato (Pinkevych et al., 2019).
In questo studio, il team ha infettato i macachi rhesus con il virus dell’immunodeficienza simiana (SIV), un virus precursore endemico nelle scimmie africane e geneticamente simile all’HIV (Williams e Burdo, 2009). Ad un certo punto durante il 20 ° secolo, SIV saltato da primati non umani negli esseri umani; questo evento di trasmissione cross-specie, accoppiato con una rapida evoluzione, ha permesso al virus di diffondersi in modo efficiente nelle persone e di creare la pandemia di HIV in corso (Keele et al., 2006).
Pinkevych et al. iniziato infettando macachi rhesus con un SIV ingegnerizzato contenente oltre 10.000 sequenze randomizzate uniche di DNA; una volta sequenziati, questi “codici a barre” consentono l’identificazione di singoli virus (Fennessey et al., 2017). Le scimmie sono state quindi trattate con terapia antiretrovirale 4, 10 o 27 giorni dopo l’infezione. Questi intervalli simulano interventi acuti (4 giorni), precoci (10 giorni) o tardivi (27 giorni) con ART negli esseri umani. I farmaci sono stati somministrati per circa un anno e il virus è stato completamente soppresso in tutti gli animali. Il trattamento è stato quindi interrotto e il virus latente è stato permesso di riattivare. Usando il sequenziamento genetico e la modellazione matematica, il team ha determinato la dimensione del serbatoio latente di SIV e come si sarebbe riattivato.
Nelle scimmie, l’inizio del trattamento quattro giorni dopo l’infezione non ha bloccato la formazione del serbatoio latente, ma ne ha ridotto le dimensioni di circa 100 volte rispetto all’inizio successivo dell’ART. Allo stesso modo, le persone che iniziano l’ARTE entro pochi giorni dall’acquisizione dell’HIV hanno un serbatoio estremamente piccolo rispetto a quelli che iniziano il trattamento più tardi (Luzuriaga et al., 2015; Henrich et al., 2017). Nonostante queste grandi differenze nella dimensione complessiva del serbatoio, una volta interrotta l’ART, i virus latenti si sono riattivati a tassi simili negli animali trattati in modo acuto, precoce e tardivo (Figura 1). Pinkevych et al. pertanto concludere che la maggior parte dei virus che hanno il potenziale per riattivare stanno stabilendo la latenza presto dopo l’infezione.
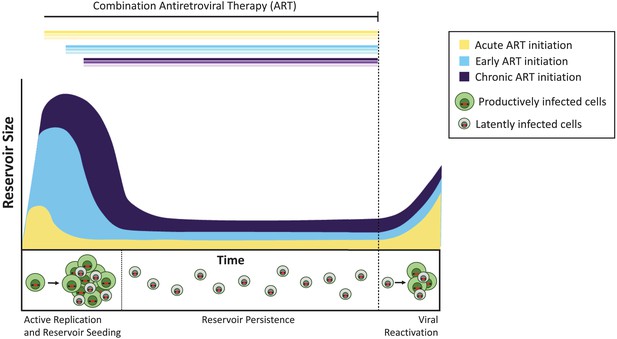
I tempi della terapia antiretrovirale influenzano la dimensione del serbatoio latente.
Senza trattamento, le cellule infette da virus a replica attiva (cellule infettate in modo produttivo; mostrato in verde) creano virus infettivi. Una minoranza di cellule infette contiene virus che possono persistere indefinitamente come serbatoio latente (cellule infette latentemente; mostrato in grigio), e questi virus possono potenzialmente essere riattivati in un secondo momento. Il trattamento somministrato durante la fase acuta dell’infezione (cioè entro giorni o settimane dall’infezione primaria; curva gialla) si traduce in un serbatoio latente più piccolo rispetto a quando il trattamento viene iniziato precocemente (entro sei mesi dall’infezione, blu chiaro) o durante l’infezione cronica (più di 6 mesi dall’infezione, viola). Se il trattamento viene interrotto (linea tratteggiata), il virus si riattiva da questi serbatoi a livelli simili per riaccendere l’infezione attiva e ri-seminare il serbatoio latente.
Per esplorare perché i tempi del trattamento non sembravano influenzare il tasso di riattivazione, il team ha misurato il livello di mutazioni genetiche nei virus latenti. Se i virus accumulano mutazioni più dannose più a lungo si replicano attivamente nel corpo, ciò suggerirebbe che gli animali che ricevono ART ritardata potrebbero trasportare una percentuale maggiore di virus latenti che sono difettosi e non possono risvegliarsi. Tuttavia, il team ha scoperto che la maggior parte dei virus (oltre l ‘ 80%) erano geneticamente intatti in tutti gli animali, indipendentemente da quando è iniziato il trattamento. Questo è molto diverso da ciò che accade con l’infezione da HIV negli esseri umani, dove la maggior parte dei virus latenti contengono importanti mutazioni genetiche e delezioni, lasciando solo una piccola frazione (tra 2% e 11%) che sono in grado di riattivazione (Ho et al., 2013; Bruner et al., 2019).
Un recente studio, che ha valutato la dinamica del serbatoio dell’HIV nelle persone su ARTE stabile, ha identificato un’altra discrepanza tra questo modello SIV e la latenza dell’HIV negli esseri umani. Nonostante l’ARTE in corso, l’HIV latente a volte può riattivarsi spontaneamente e i virus diventano rilevabili nel sangue per un breve periodo. Negli esseri umani, questi “blips” virali sono collegati filogeneticamente a un serbatoio virale stabilito non solo all’infezione iniziale, ma attraverso anni di infezione non trattata (Jones et al., 2018). Le ragioni alla base di queste differenze non sono ben comprese e rappresentano aree importanti per la ricerca in corso.
Nonostante le differenze tra i modelli di primati non umani e l’infezione da HIV umana, il lavoro di Pinkevych et al. conferma che la latenza virale è stabilita estremamente presto dopo l’infezione. Questi risultati indicano che la terapia antiretrovirale deve essere iniziata il prima possibile per controllare l’infezione da HIV e ridurre le dimensioni del serbatoio latente. Molto è ancora sconosciuto su come viene stabilita e mantenuta la latenza dell’HIV, specialmente durante il trattamento; tuttavia i modelli SIV rimarranno uno strumento importante per capire come sradicare il serbatoio latente.
Leave a Reply