単一二重結合と三重結合の違い
主な違い–単一対二重結合と三重結合
化学結合は、二つの原子の電子と核の間に力を確立することによって、分子内の原子を一緒に保持します。 化学反応は、化学結合を確立または破壊することによって支配される。 共有結合、イオン結合、ファンデルワール結合など、さまざまな種類の結合があります。 結合の特性は、分子の性質、固体型(結晶性または非晶質)などの様々な側面に応じて変化する。 共有結合は、二つ以上の電子を共有することによって形成される。 原子間の共有電子の数は結合の数を決定します;それは、単一、二重または三重であるかどうか。 したがって、単結合、二重結合および三重結合は共有結合である。 単一の二重結合と三重結合の主な違いは、共有電子の数です。 共有数が電子の一対である場合、結合は単結合になり、二つの原子が二対(四つの電子)で結合した場合、それは二重結合を形成する。 三重結合は、電子の3対(6個の原子)を共有することによって形成される。 これらの共有電子は、一般的に価電子として知られています。 この記事では、
1を見ていきます。 単結合とは何ですか?
-定義、プロパティ、例
2。 二重結合とは何ですか?
-定義、プロパティ、例
3。 三重結合とは何ですか?
–定義、プロパティ、例
4。 単一の二重結合と三重結合の違いは何ですか?
単結合とは何ですか
単結合は、隣接する二つの原子 単結合は、各原子が1つの価電子を提供する共有結合の最も単純な形態である。 これらの原子価電子は原子の最も外側の殻に位置しています。 ここでは、負に荷電した共有電子は、原子の正に荷電した核によって引っ張られている。 これらの引っ張り力は原子を一緒に保持します。 この配置は単結合として知られている。 単結合を有する分子は、多重結合を有する分子とは異なり、反応性が低い。 さらに、それらは多重結合より弱く、多重結合と比較されたとき原子間の低い引き力によるより高い結合の長さを有する。 メタン、エタン、プロパンなどのアルカンは、単結合を持つ化合物のいくつかの例である。
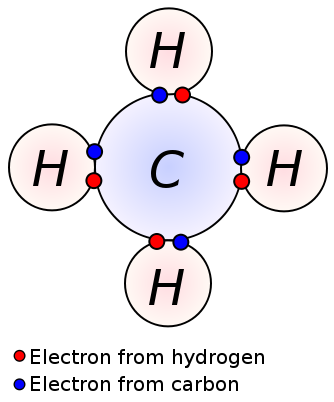
メタン
二重結合とは何ですか
二重結合は、原子の最も外側の軌道に位置する価電子 二重結合を有する化合物は、単一結合化合物よりも反応性が高いが、三重結合を有する化合物よりも反応性が低い。 二重結合は二つの平行なダッシュによって示される;例:C=C. 二重結合を有する化合物のいくつかの例には、エチレン、プロペン、カルボニル化合物(C=O)、アゾ化合物(N=N)、イミン(C=N)、およびスルホキシド(S=O)のよ
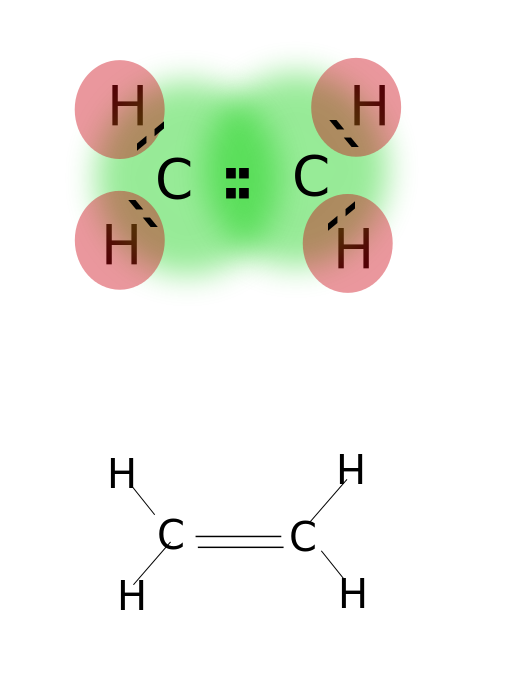
エチレン
三重結合とは何ですか
二つの原子が価電子(六つの価電子)の三対を共有すると、確立された結合は三重結合と呼ばれます。 三重結合は、最も強く、最も反応性の高い共有結合である。 単結合および二重結合と比較すると、三重結合は、二つの原子間のより高い引っ張り力のために最も低い結合長を有する。 三重結合を持つ化合物のいくつかの例には、窒素ガス(N≤N)、シアン化物イオン(C≤N)、アセチレン(CH≤CH)および一酸化炭素(C≤O)が含まれる。/p>
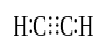
アセチレン
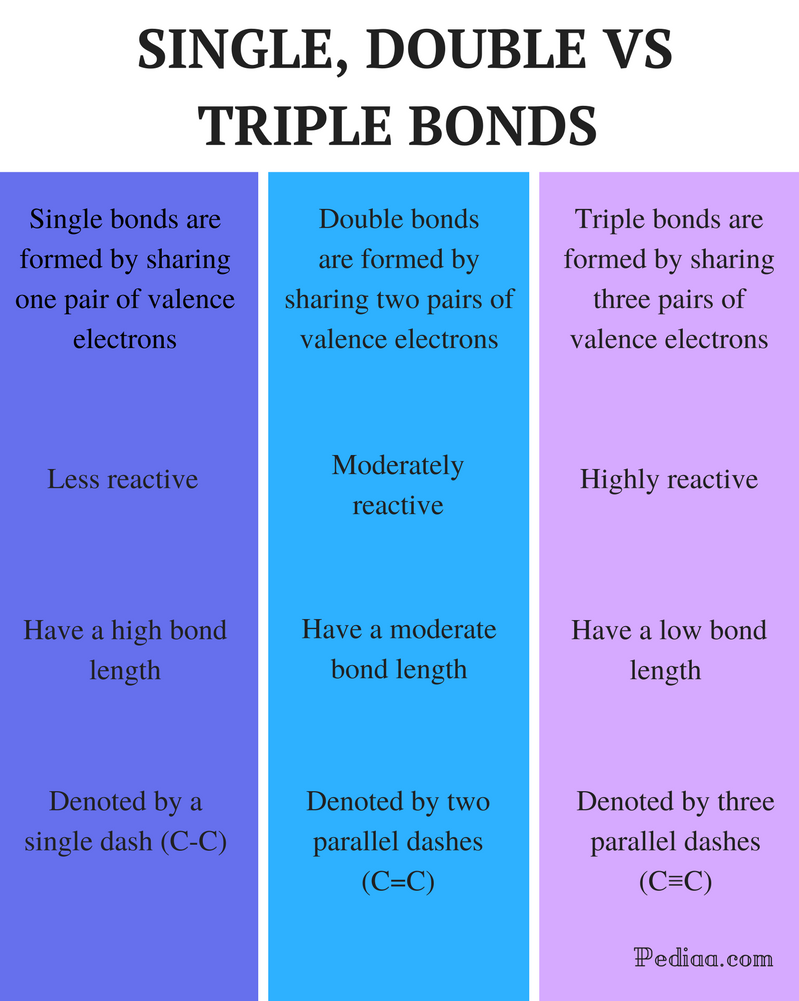
単一の二重結合と三重結合の違い
定義:
単結合: 単結合は、一対の価電子を共有することによって形成される。
二重結合:二重結合は、価電子の二対を共有することによって形成されます。
三重結合:三重結合は、3対の価電子を共有することによって形成される。反応性:単結合:単結合は反応性が低い。
反応性:単結合は反応性が低い。
反応性:単結合:単結合は反応性が低い。
二重結合:二重結合は適度に反応性があります。
三重結合:三重結合は非常に反応性があります。
結合長:
単結合:単結合は高い結合長を有する。
結合長:
単結合:単結合は高い結合長を有する。
二重結合:二重結合は適度な結合長を有する。
三重結合: 三重結合は結合強度が低い。
で示される:
単結合:単結合は、単一のダッシュ(C-C)で示されます。
二重結合:二重結合は2つの平行なダッシュ(C=C)で表されます。
三重結合:三重結合は三つの平行なダッシュ(C≤C)で表されます。
例:
単結合:例としては、メタン、エタン、プロパン、ブタンなどのアルカンが挙げられる。二重結合:例としては、エチレン、プロペン、カルボニル化合物(C=O)、アゾ化合物(N=N)、イミン(C=N)、およびスルホキシド(S=O)が挙げられる。
二重結合:例としては、エチレン、プロペン、カルボニル化合物(C=O)、アゾ化合物(N=N)、イミン(C=
三重結合: 例としては、窒素ガス(N≦N)、シアン化物イオン(C≦N)、アセチレン(C H≦C H)および一酸化炭素(C≦O)が挙げられる。
![]()
![]()
![]()
Leave a Reply