7.2: Chymotrypsin
Innledning
Chymotrypsin er et av de mest studerte enzymene på grunn av sin tofasekinetikk: pre-steady state og steady state. Studien av disse to kinetiske tilstandene gir bevis på» Ping-Pong » – mekanismen, dannelsen av kovalente komplekser som fører til kovalente hydrolysereaksjoner og frekvensen av de katalyserte reaksjonene. Syntese av chymotrypsin forekommer hovedsakelig i bukspyttkjertelen. I stedet for den aktive formen produseres den imidlertid som et inaktivt zymogen kalt chymotrypsinogen for å forhindre at proteaseaktiviteten fordøyer bukspyttkjertelen. Ved sekresjon i tynntarmens lumen omdannes den til sin aktive form av et annet enzym som kalles trypsin. Denne avhengigheten av et annet enzym for aktivering av en protease er en vanlig måte for kroppen å forhindre fordøyelse av organer og andre skadelige enzymatiske bivirkninger.
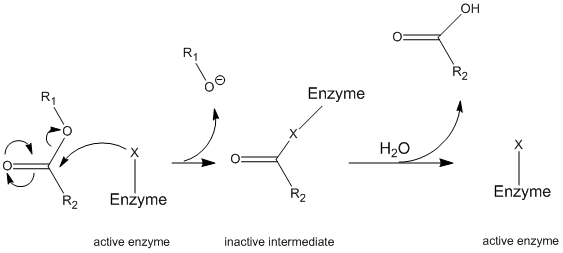
Chymotrypsin opererer gjennom en generell mekanisme kjent som pingpongmekanismen (Figur \(\PageIndex{1}\)) hvor enzymet reagerer med et substrat for å danne et enzym mellomliggende. Dette mellomproduktet har forskjellige egenskaper enn det opprinnelige enzymet, så for å regenerere den første enzymatiske aktiviteten må den reagere med et sekundært substrat. Denne prosessen er illustrert nedenfor:

mer spesifikt, chymotrypsin opererer gjennom en bestemt type ping-pong mekanisme kalt kovalent hydrolyse. Dette betyr at enzymet først danner en kovalent binding med målsubstratet, forflytter den mer stabile delen til løsning. Dette enzym-substratkomplekset kalles enzymet mellomliggende. Mellomproduktet reagerer deretter med vann, som forskyver den gjenværende delen av det opprinnelige substratet og reformerer det opprinnelige enzymet.
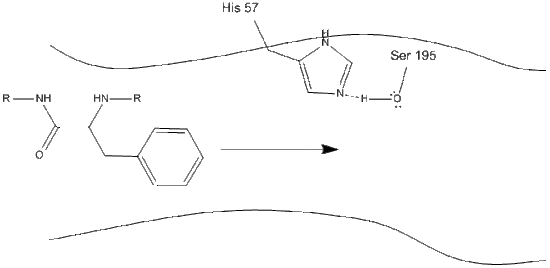
Chymotrypsin, som de fleste enzymer, er spesifikk i typer substrater som det reagerer på. Som en protease spalter den polypeptider, og dens iboende spesifisitet tillater det å virke bare på karboksy-terminalen av aromatiske rester. Det er en noe komplisert mekanisme, og er best forklart i en rekke trinn.
1. Målet går inn i det aktive stedet for chymotrypsin, og det holdes der ved hydrofobe interaksjoner mellom eksponerte ikke-polare grupper av enzymrester og den ikke-polare aromatiske sidekjeden av substratet. Det er viktig å merke seg hydrogenbindingen Mellom Schiff-nitrogenet på histidin-57 og oksygen-sidekjeden av serin-195.
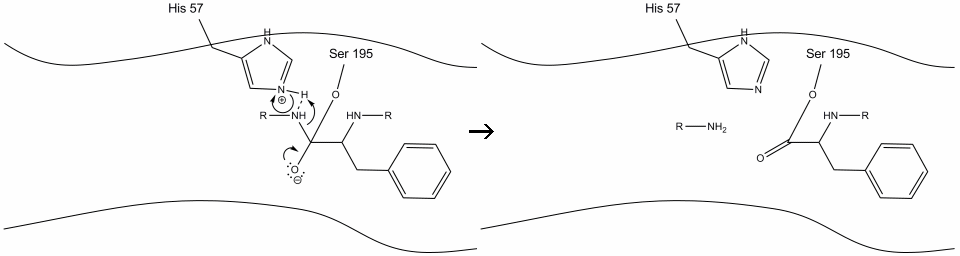
2. Hjulpet av histidin-serin hydrogenbinding, utfører hydroksylgruppen på serin-195 et nukleofilt angrep på karbonylkarbon av en aromatisk aminosyre samtidig som hydroksylhydrogen overføres til histidin Schiff nitrogen. Dette angrepet skyver pi-karbonylelektronene på karbonyloksygenet, og danner et kortvarig mellomprodukt bestående av et c-terminalt karbon med fire enkeltbindinger: en oksygenanion, beta-karbonet av den aromatiske aminosyren, n-terminus av den etterfølgende aminosyren av substratproteinet og serin-195 sidekjeden oksygen.
.gif?revision=1&size=bestfit&width=720&height=192)
3. Dette mellomproduktet er kortvarig, da oksyanionelektronene reformerer pi-bindingen med c-terminus av den aromatiske aminosyren. Bindingen mellom karboksyterminalen av den aromatiske aminosyren og n-terminusen av den etterfølgende rest spaltes, og dets elektroner brukes til å trekke ut hydrogenet av det protonerte Schiff-nitrogenet på histidin-57. Bindingene mellom karbonylkarbon og serin-195 oksygen forblir i en esterkonfigurasjon. Dette kalles acyl-enzym-mellomproduktet. Den c-terminale siden av polypeptidet er nå fri til å dissosiere fra enzymets aktive sted.
4. Vannmolekyler kan nå komme inn og binde seg til aktivt sted gjennom hydrogenbinding mellom hydrogenatomer av vann og histidin-57 Schiff nitrogen.

5. Vannet oksygen gjør nå et nukleofilt angrep på karbonylkarbonet i acyl-enzym-mellomproduktet, og skyver karbonylens pi-elektroner på karbonylkarbonet da histidin-57 trekker ut en proton fra vann. Dette danner et annet kvaternært karbon kovalent bundet med serin, en hydroksyl, en oksyanion og den aromatiske aminosyren. Protonen på den nylig protonerte histidin-57 er nå i stand til å lage en hydrogenbinding med serin oksygen.
6. Oksyanionelektronene reformerer karbonyl pi-bindingen, spalter bindingen mellom karbonylkarbon og serinhydroksyl. Elektronene i denne bindingen brukes av serin oksygen for å deprotonere histidin Schiff nitrogen og reformere det opprinnelige enzymet. Substratet har ikke lenger affinitet for det aktive stedet, og det dissocierer snart fra komplekset.

Leave a Reply