Fosfofructokinase (PFK)
Innhold
- 1 Introduksjon
- 2 Rolle I Glykolyse
- 3 Mekanisme og Regulering Av Fosfofructokinase
- 4 Regulering
- 5 Konformasjonsendringer i EN Dimerisk ENHET AV PFK
- 6 De Viktigste Konformasjonsendringene i EN Underenhet av PFK pfk.
- 7 Stedsrettet Mutagenese
- 8 Sykdom
- 9 3d-strukturer AV PFK
Introduksjon
Fosfofructokinase-1 (PFK-1) er et glykolytisk enzym som katalyserer overføringen av en fosforylgruppe fra til til utbytte og . Se Glykolyse Enzymer. Mg2+ er ogsa viktig i denne reaksjonen (). Fosfofructokinase-2 (PFK-2) virker på de samme substratene for å gi ADP og . . PFK-reaksjonen er sterkt eksergonisk (irreversibel) under fysiologiske forhold og er derfor et av de hastighetsbestemmende trinnene på glykolytisk vei. I de fleste organismer/vev er PFK det viktigste fluxregulerende enzymet på glykolytisk vei; dets aktivitet styres av konsentrasjonene av et uvanlig stort antall metabolitter, INKLUDERT ATP, ADP, AMP, PEP og fruktose-2,6-bisfosfat.
er en tetramer av identiske 320-rest underenheter. Det er et allosterisk enzym som er beskrevet ved hjelp av symmetrimodellen av allosterisme, hvorved det er en samordnet overgang fra sin høyaktivitets r-tilstand til sin lavaktivitets T-tilstand. Røntgenstrukturer av både r Og T-tilstander av enzymet har blitt rapportert. Bindingen av et molekyl av substratet F6P, som binder Seg Til R – tilstandsenzymet med høy affinitet, men Til t-tilstandsenzymet med lav affinitet, fører TIL AT PFK tar Opp R-tilstanden, noe som igjen øker bindingsaffiniteten til enzymet for ytterligere F6P (en homotrop effekt). Aktivatorer som ADP og AMP binder seg til såkalte allosteriske steder, bindingssteder som er forskjellige fra det aktive stedet, hvor de også letter dannelsen Av r-tilstanden og dermed aktiverer enzymet (en heterotrop effekt; ADP, som er et produkt AV PFK-reaksjonen, binder også på enzymets aktive sted). På samme måte binder hemmere SOM PEP til allosteriske steder (SOM I TILFELLE PFK overlapper det aktiverende allosteriske stedet) hvor de fremmer dannelsen Av T-tilstanden, og derved hemmer enzymet.
To av de aktive områdene av enzymet er lokalisert ved grensesnittet til med de aktive områdegrensesnittene i magenta med substratene i cyan. To aktive nettsteder er i grensesnittet Til underenheter B (grønn) Og C (rosa). Et nærbilde av underenheten D (Gul) viser at aminosyrer fra begge underenhetene A (lyseblå) og D (Gul) bidrar til bindingen AV F6P. To av de allosteriske stedene er plassert ved grensesnittet Til Og to ved grensesnittet Til Underenhetene C Og D. igjen er grensesnittene magenta med allosterisk ligand i cyan. Et nærbilde av av underenhet a viser bidrag fra begge underenheter til bindingen AV ADP. De konformasjonsendringer i å gå mellom R og T tilstander AV PFK er illustrert nedenfor.atomkoordinatene for R state PFK ble hentet fra 4pfk; de For T state PFK ble hentet fra Philip Evans, MRC Laboratory Of Molecular Biology, Cambridge, Storbritannia, men er nå tilgjengelige som 6pfk.
Rolle I Glykolyse
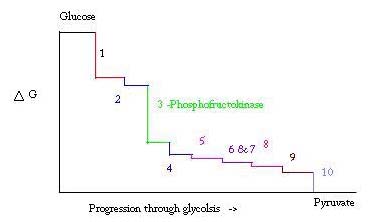
Glykolyse er prosessen for å forberede og bryte ned glukose for å lage pyruvsyre, som brukes i anaerob respirasjon eller som en av startreaktantene i sitronsyresyklusen. Tre punkter i prosessen med glykolyse forekommer med en stor negativ fri energi og er derfor irreversibel. Disse tre punktene er heksokinase, fosfofructokinase og pyruvatkinase; AV DISSE TRE PFK regnes som det viktigste reguleringspunktet for glykolyse i muskel med EN Δ= -25,9 kJ / mol.
Mekanisme og Regulering Av Fosfofructokinase
Fosfofructokinase binder Både MG2+-ATP og fruktose-6-fosfat (F6P) for å lage fruktose-1,6-bisfosfat og Mg2+-ADP. Selv om bildet med begge disse produktene ikke er bestemt, har bundet til enzymet vært. Det er tre ligandbindingssteder per underenhet. To utgjør det aktive området, som binder F6P OG ATP, mens den tredje er et allosterisk bindingssted. Noen foreslåtte rester involvert på det aktive stedet inkluderer . PFK eksisterer i to konformasjonelle tilstander, begge og som er i likevekt. ATP binder både aktive og allosteriske steder i begge konformasjoner. MENS ATP binder det aktive stedet like godt, binder det fortrinnsvis det allosteriske stedet For T-tilstanden denne preferansebindingen forårsaker et skifte fra likevekt av de to tilstandene, til en større mengde T-tilstand, noe som reduserer affiniteten FOR F6P. binder også til allosterisk sted for å øke forholdet Mellom r-tilstandsfosfofructokinase. SAMMEN MED ADP,AMP Og F2 hemmer 6P DEN REGULATORISKE rollen TIL ATP. PFK Er Km FOR ATP er .020 mm og .032mm.
Regulering
Glykolyse er en viktig metabolsk prosess for overlevelse. Derfor må det i sin aktivering og undertrykkelse være sterkt regulert. Tre punkter i prosessen med glykolyse forekommer med en stor negativ fri energi og er derfor irreversibel. Disse tre punktene er heksokinase, fosfofructokinase og pyruvatkinase. Disse tre reaksjonene er kandidater til å være de viktigste reguleringspunktene på grunn av deres høye negative frie energier. AV DE tre ANSES PFK som det viktigste reguleringspunktet for glykolyse (#3 på bildet nedenfor) i muskel, med EN Δ= -25,9 kJ/mol, fordi det er et forpliktet trinn. NÅR PFK konverterer F6P Til F1, 6P, vil reaksjonen ikke lett reverseres på grunn av den høye mengden energi som må overvinnes for å gå bakover. . Denne energibarrieren er fornuftig ettersom pyruvatkinase katalyserer den endelige reaksjonen (#10) og heksokinase (#1) ikke er involvert i glykolyse i det hele tatt når prosessen påbegynnes fra glykogen.
PFK er regulert AV ATP, AMP og ADP. MENS ATP binder på det aktive stedet like godt i Både R og T-tilstander, binder det fortrinnsvis allosterisk stedet For T-tilstanden. denne preferansebindingen forårsaker et skifte fra likevekt av de to tilstandene, til en større mengde T-tilstand, noe som reduserer affiniteten FOR F6P. Allosterisk aktivator ADP binder også til allosterisk stedet for å øke forholdet Mellom r-tilstandsfosfofructokinase. Som det fremgår av grafen nedenfor, er plottene for AKTIVITETEN TIL PFK sigmoidal. Dette demonstrerer videre enzymets kooperative natur. Den første bindingen av substratet til enzymet er vanskelig, men når det er bundet og tvinger endringen i tilstand Fra T – > R, binder de andre substratene mye lettere. Grafen viser også at å legge TIL ATP flytter plottet til høyre (dvs.reduserer affinitet FOR F6P), mens du legger TIL AMP flytter den til venstre.
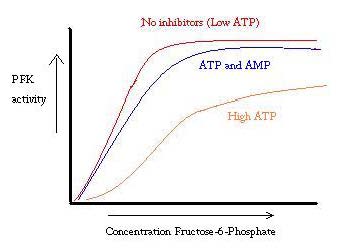
reguleringssystemet samsvarer godt med FUNKSJONEN TIL PFK. NÅR PFK er aktiv, BLIR ATP produsert nedstrøms fra DET som ytterligere produkter brytes ned mer fullstendig. NÅR ATP-nivåene er lave og FLERE må gjøres, vil AKTIVITETEN TIL PFK økes, fordi ADP vil være i høy konsentrasjon. Det motsatte gjelder også, fordi høy ATP-konsentrasjon hemmer proteinaktivitet. Og likevel kan denne forklaringen ikke helt forklare reguleringen AV PFK, fordi NIVÅENE AV ATP ikke varierer sterkt nok mellom aktive og hvilende muskler. Et annet middel til allosterisk regulering må bli funnet.
PFKS Km for ATP er .020 mm og .032mM.Denne Kinemage-øvelsen består av to kinemage-scener som illustrerer noen av de allosterisk induserte konformasjonsendringene som forekommer I PFK fra Bacillus stearothermophilus.
Konformasjonsendringer i EN Dimerisk ENHET AV PFK
denne kinemage viser de to underenhetene til tetramer hvis grensesnitt inneholder to aktive steder. (KineMage støttes for øyeblikket ikke)den første visningen, 1: PFK dimer, viser de to underenhetene i Deres R – tilstandskonformasjon som representert av Deres Ca-rygger med Underenhet 1 i rosa fargetone og Underenhet 2 i rosa. To sidekjeder i hver underenhet er vist, De Av Glu 161 (rød) og Arg 162(cyan), som er en del AV F6P-bindingsstedet I T-og R-tilstandene, srespectively (se nedenfor). EN f6p (hotpink) og EN ADP (grønn; «ADP-active») er bundet i det aktive området for hver underenhet. En EKSTRA ADP (gul; «ADP-allo») er bundet i et eget såkalt allosterisk sted for hver underenhet. ADPs hver har en tilknyttet Mg2+, som er representert her av en ball av samme farge som ADP som den binder.
Klikk på» ANIMER » – knappen for å bytte dimer mellom R – og T-tilstandene. I Sin t-tilstand er underenhet 1 bluetint og Underenhet 2 er skyblue. Sidekjedene Til Glu 161 Og Arg 162 i begge underenheter er røde og cyan som før (bare Ca – og Cb-atomer Av Arg 162 sidekjeden i Underenhet 1 observeres i Røntgenstrukturen Til t-tilstanden; De Av Underenhet 2 er alle observert). T – tilstandsenzymet binder inhibitoren 2-fosfoglykolat (gull; «PGC»), en ikke-fysiologisk analog av det glykolytiske intermediære fosfoenolpyruvat (PEP). Merk at bindingsstedet TIL PGC i t-tilstanden overlapper DET allosteriske bindingsstedet TIL ADP I R-tilstanden («ADP-allo») og dermed er bindingen gjensidig utelukkende. De Aktive t-tilstandsstedene, som ikke inneholder F6P, er merket med «ghost» F6Ps (gray; «F6P site»), som har de samme posisjonene som F6Ps i r-tilstandsenzymet.
den andre visningen, 2: Allo / Act Sites, er et nærbilde av den øvre delen av den første visningen som viser både det aktive stedet og det allosteriske stedet i denne regionen. Legg merke til at det aktive området er plassert i grensesnittet mellom to underenheter, og at allosteric-området samhandler direkte med det aktive området på den tilstøtende underenheten. Sammenlign r-tilstanden og t-tilstandskonformasjonene ved å vise begge samtidig eller klikke på «ANIMER». Kan Du identifisere mg2 + ion forbundet med Hver Av Adpene bundet til enzymet I R-tilstanden? Hvilke ADP-atomer koordinerer Disse Mg2 + – ionene?
fosfatgruppen av PGC binder seg til det allosteriske stedet I T-tilstanden i nesten samme posisjon som betafosfatgruppen AV «ADP-allo» binder Til r-tilstandsallosteriske stedet; begge fosfatgruppene binder til sidekjedene av de samme tre rester (2 arg og 1 Lys; ikke vist).I høyaktivitets r-tilstanden danner den positivt ladede sidekjeden Av Arg 162 en hydrogenbundet saltbro med den negativt ladede 6-fosfatgruppen F6P( hvite stiplede linjer), en interaksjon som antagelig stabiliserer r-tilstanden i forhold til T-tilstanden og er derfor delvis ansvarlig for F6PS homotrope effekt.
De Viktigste Konformasjonsendringene i EN UNDERENHET AV PFK.
DENNE KINEMAGE viser disse segmentene nær allosteriske området (rester 53-60 er ikke vist her). Som I KINEMAGE 1 representeres polypeptidet av Sin Ca-kjede Med R-tilstandsunderenheter 1 og 2 i rødtint og rosa, Og T-tilstandsunderenheter 1 og 2 i bluetint og skyblue. (KineMage støttes for øyeblikket ikke)KINEMAGE 2 kommer opp i visning 1: Det Allosteriske Stedet, I r-tilstanden som viser fosfatgruppen F6P (hotpink) bundet i enzymets aktive sted i en hydrogenbundet saltbro (stiplede hvite linjer) med sidekjeden Av Arg 162 (cyan). EN ADP (gul; «ADP-allo») opptar det tilstøtende allosteriske stedet. Klikk en gang på «ANIMER» for å bytte Til t-tilstanden. DETTE erstatter ADP i r state allosteric stedet med inhibitor og pep analog pgc (gull). F6P opptar ikke lenger det aktive nettstedet, men dets posisjon I r-tilstanden er indikert av «ghost» F6P(grå; sett ved å klikke på «F6P site»).
Hva skjer med det sentrale polypeptid spiralformede segmentet (rester 149-164) i r Til T-overgangen? Hva gjør dette med de relative posisjonene til den negativt ladede Glu 161 og den positivt ladede Arg 162? Klikk på «F6P site». Hvilken innflytelse ville fraværet av den positive ladningen Av Arg 162 ha på bindingen AV F6P? Forklarer dette, i det minste delvis, hvorfor T state PFK har lav affinitet for F6P? Gå Til View 2: Closeup, for et nærbilde AV f6p-sidekjedeinteraksjonene. Senter molekylene ved å velge «pickcenter » fra» verktøy » – menyen og klikke på atomet du vil være i sentrum. Skyv glidebryteren «zoom» for å forstørre visningen.
Stedsrettet Mutagenese
på en gang ble den negative ladningen Av Glu 161 antatt å ha en negativ effekt PÅ f6p-binding I t-tilstanden. Denne ideen har ikke blitt støttet av stedsrettede mutageneseforsøk. Flere mutante Pfk-er er laget, inkludert R162A, E161A og R162A/E161A. r162a-mutasjonen forårsaket en 30 ganger reduksjon I f6p-binding. E161A-mutasjonen hadde imidlertid liten effekt på peps evne til å hemme f6p-binding.
Sykdom
Arvet erytrocytter PFK-mangel er forbundet med myopati og hemolyse (Tarui sykdom).
3d strukturer AV PFK
Fosfofructokinase 3d strukturer
Leave a Reply