Frontiers in Oncology
Introduksjon
Omtrent 25% av tidlige brystkreftpasienter opplever fortsatt lokal tilbakefall og utvikler fjernmetastaser etter aktiv behandling (1), og nesten 10% av pasientene er I STADIUM IV-sykdom ved første diagnose i den utviklede verden, som kalles DE novo metastatisk brystkreft (MBC) (2). TIL tross for behandlingsfremskritt forblir MBC uhelbredelig, og opptil 70-80% AV MBC-pasientene dør av kreft innen 5 år (2). SOM et resultat av heterogeniteten TIL MBC, utvikles flere prognostiske modeller basert på prognostiske faktorer eller score for å forutsi deres kliniske utfall og direkte klinikere for å ta passende terapeutiske beslutninger (3-5). Videre finnes det også en rekke prognostiske modeller for brystkreft MED hjernemetastase (BCBM) for klinikere å nøyaktig forutsi overlevelse hos disse pasientene (6, 7).Brystkreft kan metastasere hvor som helst i kroppen, men metastaserer primært til lunge, bein, lever, ikke-aksillære lymfeknuter og hjerne (8). Spesielt er levermetastase (LM) ikke bare et vanlig metastatisk sted, men også forbundet med signifikant økt dødsrisiko som ligner på hjernemetastase, en uforholdsmessig høyere dødelighet sammenlignet med lunge-eller benmetastaser (5, 8). Ettersom gradert prognostisk vurdering (gpa) er allment akseptert hos BCBM-pasienter, stimulerer de ovennevnte prognostiske modellene oss til å foreslå en praktisk modell FOR BCLM (3-7). Vårt mål var å konstruere en pålitelig og brukervennlig prognostisk modell FOR BCLM og å evaluere dens konkordans og nøyaktighet ved å validere den både internt og eksternt. Den prognostiske modellen kan hjelpe klinikere til å estimere dødsrisiko for BCLM-pasienter og velge optimal behandling.
Pasienter og Metoder
Utvalg Av Pasienter
denne studien ble godkjent av DE uavhengige etiske komiteene I FUSCC. Påfølgende MBC-pasienter diagnostisert ved FUSCC fra januar 2007 til desember 2018 ble identifisert (n = 9062). Kvalifikasjonskriteriene var som følger: (1) histologisk bekreftet brystkreft, (2) kvinnelige pasienter, (3) leveren som det første stedet for metastatisk sykdom i enten de novo metastatisk eller tilbakevendende brystkreft, og (4) komplette og detaljerte poster. Pasienter med bilateral brystkreft, andre invasive neoplasmer eller med ukjent oppfølging ble ekskludert. Til slutt var det 1022 kvalifiserte pasienter valgt for videre analyse. De fullstendige trinnene for valg er vist I Figur S1.
Studere Variabler og Utvalg Av Cutoff Verdier
Informasjon ble samlet på følgende kliniske variabler: alder, molekylære subtyper, tidligere behandlingsinformasjon (kirurgi og systemisk kjemoterapi), MFI, steder med ekstrahepatisk metastase (hjerne, lunge, ben og lymfeknuter), kjennetegn ved levermetastase (distribusjon, antall, maksimal diameter), hemoglobin (hb), leverfunksjonstester og overlevelsestid. Molekylære subtyper inkluderte hormonreseptor (HR) og human epidermal vekstfaktorreseptor 2 (HER2) status. VI definerte MFI som intervallet mellom datoen for diagnose av primær brystkreft og datoen for første fjernmetastase. Cutoff poeng AV MFI brukt i denne studien var 3 og 24 måneder i henhold til referanse (9). Pasientene kunne derfor deles inn i tre grupper: pasienter med de novo MBC (mfi < 3 måneder), pasienter med kort MFI (≤ 24 måneder) og pasienter med lang MFI > 24 måneder. Fjern lymfeknutemetastase ble definert som metastase ut av ipsilaterale aksillære, supraclavikulære, infraclavikulære eller interne brystlymfeknuter. Diagnosen AV LM var basert på radiografisk bildebehandling eller patologisk bevis. Kjennetegn ved levermetastase ble evaluert ved hjelp av abdominal computertomografi (CT), magnetisk resonans imaging (MR) eller kirurgiske reseksjonsprøver. Leverfunksjonstester ble også analysert i denne studien, inkludert total bilirubin, alaninaminotransferase (ALAT), aspartataminotransferase (ASAT), alkalisk fosfatase (ALP), laktatdehydrogenase (LDH) og γ-glutamyltransferase til albumin ratio (GAR). Blodprøver ble tatt for laboratorietester innen 1 uke etter diagnosen LM. Klassifikasjoner av distribusjon, antall eller maksimal diameter av levermetastaser og LDH var basert på andre studier (10-13). Grenseverdiene FOR HB, total bilirubin, ALAT, ASAT og ALP ble bestemt i Henhold Til COMMON Terminology Criteria FOR Adverse Events (CTCAE) fordi moderate eller grad II avvik i hemoglobinnivå eller leverfunksjon kan påvirke terapeutiske valg (14). VERDIEN AV GAR ble definert som et enkelt forhold mellom serumy-glutamyltransferase (GGT, U/L) nivå og serumalbumin (ALB g/L) nivå. OS fra metastasetidspunktet ble målt fra datoen for diagnose AV LM til døden av en hvilken som helst årsak. Siste oppfølgingstid var November 2019 med en median oppfølgingstid på 18,63 måneder. Hvis pasientene ble tapt for oppfølging, ble det sensurert på den siste oppfølgingsdagen.
Statistisk Analyse
Pasientene ble delt inn i opplæringen (2007-2016, n = 715) og validering (2016-2018, n = 307) satt til et forhold på 7:3. Den optimale cutoff-verdien FOR GAR ble valgt ved beregning Av Youden index og receiver operating characteristic curve (Roc) analyse (Figur S2). Pearson chi-squared test eller Fisher ‘ s exact test ble brukt til å sammenligne kategoriske variabler. Cox proporsjonale farer regresjonsmodeller med bakover seleksjonsmetoden ble brukt for multivariat analyse og for å beregne hazard ratio. Regresjonskoeffisientene ble beregnet gjennom multivariat regresjonsanalyse og deretter multiplisert med 10 og avrundet for å representere endelige prognostiske score. Bootstrapping ble brukt til intern validering. Deretter ble tidsavhengige ROC-kurver og kalibreringspott brukt til å vurdere diskriminering og kalibrering av denne prognostiske modellen i valideringssettet. Grenseverdiene for risikogrupper ble bestemt Av x-fliser (15). Overlevelsesanalyse ble utført ved Bruk Av kaplan-Meier overlevelseskurver, og log-rank-tester ble brukt til å sammenligne overlevelseskurver. Alle p-verdier var tosidige, og verdier av P < 0,05 ble vurdert som statistisk signifikante. Statistisk analyse ble utført VED HJELP AV spss-programvare (SPSS 20, Chicago, IL, USA) og R-programvareversjon 4.0.1.
Resultater
Karakteristika og Sammenheng med Risikostratifisering
Totalt 1022 pasienter valgt i denne studien ble delt inn i opplæringssett (n = 715) og valideringssett (n = 307). En beskrivelse av kliniske karakteristika er gitt I Tabell 1 Og Tabell S1. I treningsgruppen var det 126 pasienter (17,6%) diagnostisert med de novo MBC og 589 pasienter (82,4%) med tilbakevendende MBC, hvorav 297 pasienter (50,4%) hadde en kort MFI og 292 pasienter (49,6%) hadde en lang MFI. Median alder ved diagnosen LM var 50 (variasjonsbredde 21-87) år med 617 pasienter (86.3%) yngre enn 60 år. Av disse pasientene var andelen HR-positive og HER2-positive pasienter henholdsvis 62,2 og 38,0%. Blant tilbakevendende MBC-pasienter gjennomgikk nesten alle pasienter kirurgi på primærtumoren (584, 99,2%) og fikk (neo) adjuvant kjemoterapi (569, 96,6%). Mønstre av fjernmetastaser viste at det vanligste stedet for ekstrahepatisk metastase var ben (42,7%) etterfulgt av fjerne lymfeknuter (36,1%), lunge (25,6%) og hjerne (2,9%). Levermetastaser var preget av diffus fordeling og små knuter, hvorav de fleste var multiple (≥3 metastaser, 77,3%), men små knuter (≤3 cm, 59,4%) og involverte høyre og venstre fliker (74,4%). I tidlig STADIUM av LM var leverfunksjonen svekket i varierende grad, men generelt mild. Økningen AV LDH (36,1%) og GAR (35,9%) syntes å være følsomme indikatorer for leverdysfunksjon, og moderate eller høyere abnormiteter i HB (2,9%), total bilirubin (2,7%), ALAT (3,6%), ASAT (9,5%) og alp (3,9%) var mindre vanlige I HENHOLD TIL CTCAE. Sammenlignet med lavrisikogruppen presenterte mellom-og høyrisikogruppen en høyere FREKVENS AV HR-og her2-negativitet, en kort MFI, ekstrahepatisk metastase, levermetastasetumorbelastning og abnormiteter i hemoglobinnivåer eller leverfunksjon (Alle Ps ≤ 0,001), noe som tyder på at disse faktorene kan påvirke prognosen FOR BCLM.
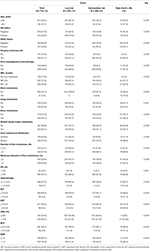
Tabell 1. Baseline egenskaper og dens forhold til risiko stratifisering av trening sett.
Prognostisk Modell og Validering
i den multivariate cox-regresjonsmodellen var molekylære subtyper (HR og HER2-status), MFI, steder med ekstrahepatisk metastase (hjerne -, lunge-og benmetastase) og leverfunksjonstester (total bilirubin, LDH og GAR) assosiert MED OS (Tabell 2). Spesielt dødsrisikoen FOR HR negativ (HR 1,740, 95% KI 1,424–2,127, P < 0,001) og HER2 negativ (HR 1,615, 95% KI 1,316–1,983, P < 0,001) pasienter økte sammenlignet MED HR eller her2 positive kolleger. LENGDEN på MFI hadde også en signifikant innvirkning på overlevelsen AV bclm–pasienter, og derfor ble overlevelsen av pasienter med lang MFI (HR 1.612, 95% CI 1.195–2.174, p < 0.001) forkortet sammenlignet med pasienter med de novo MBC, og pasienter med kort MFI (HR 2.563, 95% CI 1.904-3.449, p < 0.001) HADDE MER ENN DOBBELT SÅ STOR RISIKO FOR DØD I FORHOLD TIL DEM. I tillegg var tilstedeværelse av ekstrahepatisk metastase (hjerne -, lunge-og benmetastase) og unormal leverfunksjon (total bilirubin, LDH og GAR) korrelert med en ugunstig prognostisk påvirkning på OS. Denne prognostiske modellen hadde arealet under kurven (AUC) av tidsavhengig ROC ved 1 års OS med 0,78 i treningssettet og 0,80 i valideringssettet, noe som indikerer at denne modellen hadde god diskriminering (Figur 1). Bootstrapping-metoden ble brukt for å bekrefte stabiliteten til vår prognostiske modell i treningssettet, og de endelige resultatene var ganske robuste (Tabell S2). Kalibreringskurver av prognostisk modell for 1 år OG 3 år OS i treningssettet, samt 1 år OS i valideringssettet viste sin gode konkordans (Figur 2).

Tabell 2. Multivariat cox regresjonsmodell (Treningssett).
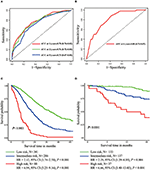
Figur 1. Tidsavhengige ROC-kurver for den prognostiske modellen i treningssettet (A) og valideringssettet (B). Total overlevelse fra metastase av de tre prognostiske gruppene i opplæringssettet (C) og valideringssettet (D).
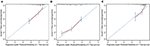
Figur 2. Kalibreringskurven for å forutsi pasientoverlevelse ved 1 år (A) og 3 år (B) i treningssettet og ved 1 år (C) i valideringssettet.
Risiko Lagdeling og Overlevelse

Tabell 3. Beregning av score og cutoff poeng av prognostiske grupper.
Diskusjon
i den foreliggende analysen av 1022 pasienter behandlet i vår institusjon fra 2007 TIL 2018 har vi vist at molekylære subtyper (HR og her2 status), MFI, steder med ekstrahepatisk metastase (hjerne -, lunge-og benmetastase), leverfunksjonstester (total bilirubin, LDH og GAR) var uavhengige prognostiske faktorer for bclm pasienter. Derfor ble en prognostisk modell for BCLM-pasienter konstruert ved hjelp av prognostiske faktorer.MED hensyn til molekylære subtyper KAN HR-positive indikere at brystkreftvekst og proliferasjon fortsatt reguleres av hormoner, kalt hormonavhengige svulster. Samtidig har endokrin terapi fordeler, inkludert få bivirkninger og langvarige effekter, noe som ofte kan gi langsiktige overlevelsesfordeler til HR-positive pasienter. DERFOR HAR HR positiv blitt ansett som en signifikant faktor som tyder på en gunstig prognose i tidlig og metastatisk brystkreft (1, 3-5, 8-10, 16). Selv OM her2-forsterkning og overuttrykk anses å være en prediktor for risiko for fjernmetastase og brystkreftrelatert død, har senere utviklede anti-HER2-midler bemerkelsesverdig forbedret overlevelse hos HER2-positive brystkreftpasienter (2, 9, 17). I tiden med målrettet terapi fant en studie i sørøst-Nederland at dødelighetsrisikoen for HER2-negative pasienter økte med 44% (95% KI 1,13–1,83, P = 0,003) sammenlignet MED HER2-positive pasienter (9). I vår studie økte dødsrisikoen for HR-negative og HER2-negative pasienter sammenlignet med HR – eller HER2-positive kolleger, i samsvar med disse observasjonene. Pasienter med kort MFI, vanligvis definert som ≤24 måneder, hadde dårligere prognose (3, 5, 9). Videre syntes de novo MBC-pasienter å ha en signifikant bedre prognose i forhold til tilbakevendende MBC-pasienter, selv om denne forskjellen gradvis ble redusert med forlengelse av sykdomsfritt intervall (DFI) eller MFI (9, 18, 19). Eirik et al. funnet at pasienter med mfi ≤24 måneder hadde signifikant kortere overlevelsestid (9,1 vs. 29.4 måneder, P <0,001) enn de med de novo STADIUM IV sykdommer, men pasienter med lengre MFI (> 24 måneder) hadde en lignende prognose (27,9 vs. 29,4 måneder, P = 0,73) (9). Den mulige årsaken til dette fenomenet er at pasienter med RESIDIVERENDE MBC som tidligere har gjennomgått systematisk behandling, kan være mer resistente mot kjemoterapi enn behandlingsnaive pasienter med de novo MBC, men videre utredning er berettiget (9, 18, 19). Denne studien bekreftet at overlevelsestiden til pasienter med lang MFI ble forkortet i forhold til de novo MBC hos pasienter med kort MFI som ga et betydelig dårligere utfall.
MBC-overlevelse varierte signifikant i henhold til metastasesteder, og pasienter med visceral metastase var assosiert med økt risiko for dødelighet sammenlignet med DE med ikke-visceral metastase (3-5, 9, 18). Videre hadde tilstedeværelsen av hjernemetastase større innvirkning på overlevelse enn noen andre metastasesteder (3, 5, 9, 18). Det var ikke overraskende at flere metastaser hadde en mer ugunstig innflytelse på prognosen (3, 5, 9, 17, 18). I denne analysen kan ekstrahepatisk metastase, med unntak av fjern lymfeknutemetastase, føre til forkortet overlevelse, sannsynligvis fordi levermetastase var den kritisk livstruende faktoren sammenlignet med lymfeknutemetastase.
det bør bemerkes at pasienter med høyere bilirubinnivåer hadde mye lavere risiko for flere sykdommer, delvis via dets antioksidanter og antiinflammatoriske egenskaper (20). En nylig studie rapporterte også at en nesten 40% reduksjon av dødsrisikoen ble vist blant tidlige brystkreftpasienter med høyere total bilirubinnivå (21). Hyperbilirubinemi var imidlertid forbundet med dårlig prognose blant BCLM-pasienter (22). Det er mulig at, i motsetning til relativt høyere total bilirubin blant ikke-metastaserende brystkreftpasienter, kan forhøyet bilirubin 1,5 ganger mer enn øvre normalgrense (ULN) blant bclm-pasienter forutsi alvorlig leverskade og dermed bidra til seponering av legemidlet eller hepatisk encefalopati.Warburg-effekten driver kreftceller til å stole på aerob glykolyse selv når oksygenforsyningen er tilstrekkelig, noe som er kjennetegnet for kreftmetabolisme i motsetning til normalt vev (23). LDH spiller en uunnværlig rolle i glykolyse på grunn av sin evne til å konvertere pyruvat til laktat under anaerobe forhold (24). DEREGULERTE NIVÅER AV LDH kan reflektere høyere tumorbelastning, dårligere behandlingsrespons og prognose, som tidligere var rapportert i flere svulster (21, 24-26). En meta-analyse av prognostisk effekt AV LDH hos brystkreftpasienter viste at høyere LDH-nivåer resulterte i utilfredsstillende OS og progresjonsfri overlevelse, som inkluderte 11 studier med 6102 pasienter (27).
GGT, den viktigste endogene antioksidanten, gjør forløperaminosyrer assimilert og involverer i glutationsyntese (28). GGT i svulster gjør det mulig for celler å raskt fylle glutation etter å ha mottatt prooksidant anticancerbehandling og er derfor korrelert med stoffresistens og dårlig overlevelse (29). Interessant, Fentiman et al. rapportert at det ble identifisert en signifikant positiv sammenheng mellom forhøyet GGT og brystkreftrisiko (30). ALB syntetisert av leveren fungerer som en antioksidant, transportør av næringsstoffer, og har deltakelse i signalveier på grunn av sine unike strukturelle egenskaper (31). Hypoalbuminemi forekommer vanligvis hos avanserte kreftpasienter og tilskrives ulike mekanismer, inkludert nedsatt leversyntese, økt katabolisme og kakeksi (21, 31). Hypoalbuminemi er en uavhengig indikator på dårlig prognose av ulike svulster (21, 22, 32, 33). I motsetning til reduserte serumalbuminnivåer, har serum GGT-nivåer en tendens til å være forhøyet når leverfunksjonen er svekket. DERFOR, GAR basert pa de ovennevnte to parametrene kan ha fordelen a reflektere lever reserve evne og forutsi prognosen (32, 33). I den nåværende studien var unormal leverfunksjon (total bilirubin, LDH og GAR) alle korrelert med en ugunstig prognostisk innvirkning på OS.
etter å ha analysert prognosen for 123 bclm pasienter, Duan Et al. fant at pasienter med tre eller flere levermetastaser bar 2.26 ganger økt risiko for død i forhold til pasienter med <3 levermetastaser i multivariat analyse (10). Egenskapene til levermetastase i denne studien syntes imidlertid ikke å gjøre noen forskjell. Det er to mulige årsaker til dette avviket. Først av alt var fordelingen, antall og maksimal diameter av levermetastaser signifikant forskjellig i de tre risikogruppene, noe som indikerer at risikoen for dødelighet økte med utvidelse av levermetastase i univariate analyser. Etterpå var unormal leverfunksjon nært relatert til tumorbelastningen av levermetastase, og justerte rollen til disse faktorene i multivariat analyse.
det har vært mange studier på prognostiske faktorer i innstillingen AV BCLM. En analyse av 145 BCLM-pasienter viste at hypoalbuminemi, eldre alder og er-negativitet var uavhengige prediktorer for dårlig overlevelse (22). En gresk registeranalyse oppnådde lignende resultater, HVOR HR-positivitet, lav histologisk grad, fravær av ekstrahepatisk metastase og god prestasjonsstatus var signifikante prognostiske faktorer for gunstig prognose i univariate analyser (34). En nylig populasjonsbasert studie med mer enn 4000 pasienter med de novo BCLM har identifisert demografiske og sosioøkonomiske faktorer, patologisk grad, totalt antall ekstrahepatisk metastase, behandling og molekylær subtype som parametere som påvirker total overlevelse signifikant (17). Regierer et al. utviklet en prognostisk score for MBC basert PÅ HR-status, mfi og steder for metastaser for å forutsi prognose og individualisere optimal behandling, som ble validert internt og eksternt (5). DESSVERRE var HER2-status ikke inkludert i prognostisk score og begrenset derfor anvendeligheten. Modifisert bryst-gpa for BCBM-pasienter som integrerte fire enkle kliniske parametere hadde en umiddelbar rolle i å forutsi overlevelse, men var ikke aktuelt for BCLM-pasienter (7). Så vidt vi vet er det ingen prognostisk modell som integrerer disse prognostiske faktorene for BCLM-pasienter, så vår modell er pragmatisk fornuftig.
det var også noen begrensninger i denne undersøkelsen. For det første resulterte en enkelt-senter og retrospektiv studie uunngåelig i seleksjonsbias, selv om vår prognostiske modell ble validert internt og eksternt. For det andre ble pasienter som utviklet levermetastase senere i sykdomsforløpet ekskludert slik at vi ikke kunne evaluere disse pasientene. For det tredje var detaljert informasjon om funksjonsstatus og behandling ikke tilgjengelig i denne studien.
Konklusjoner
Til tross for disse begrensningene kan denne forskningen gi en enkel og pålitelig prognostisk modell. Den største fordelen med vår studie er inkorporering av parametere som er lett tilgjengelige i klinisk praksis på grunnlag av det store utvalget AV bclm-pasienter. Bortsett fra utsøkt klassifisering av svulster i henhold til neste generasjons sekvenseringsmetoder, kan vår modell bidra til å identifisere undergrupper med forskjellig prognose og veilede etterfølgende behandling.
Data Availability Statement
de opprinnelige bidragene som presenteres i studien er inkludert i artikkelen / Supplerende Materiale, ytterligere henvendelser kan rettes til den tilsvarende forfatteren/s.
Etikkerklæring
denne studien ble godkjent av DE uavhengige etikkomiteene I FUSCC. Pasientene / deltakerne ga skriftlig informert samtykke til å delta i denne studien.
Forfatterbidrag
LJ foreslo studien. XZ og YG samlet inn dataene. LJ og LF analyserte dataene og skrev det første utkastet. ZW kritisk gjennomgått manuskriptet. Alle forfattere bidro til artikkelen og godkjente den innsendte versjonen.
Interessekonflikt
forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller økonomiske forhold som kan tolkes som en potensiell interessekonflikt.
Bekreftelser
Vi anerkjenner Lei Cheng for å utføre dataanalyse.
Supplerende Materiale
Forkortelser
BCLM, brystkreft med levermetastase; FUSCC, Fudan University Shanghai Cancer Center; ROC, mottaker opererende karakteristisk kurve; MFI, metastatisk-fritt intervall; HR, hazard ratio; KI, konfidensintervall; OS, total overlevelse; MBC, metastatisk brystkreft; BCBM, brystkreft med hjernemetastaser; LM, levermetastase; GPA, gradert prognostisk vurdering; HB, hemoglobin; HR, hormonreseptor; HER2, human epidermal vekstfaktorreseptor 2; CT, datastyrt tomografi; MR, magnetisk resonansavbildning; ALT, alaninaminotransferase; ASAT, aspartataminotransferase; ALP, ALKALISK FOSFATASE; ldh, LAKTATDEHYDROGENASE; gar, Γ-glutamyltransferase til albuminforhold; Ggt, γ-glutamyltransferase; ALB, albumin; CTCAE, Vanlige Terminologikriterier for Bivirkninger; ULN, øvre normalgrense.
4. Puente J, Lopez-Tarruella S, Ruiz A, Lluch A, Pastor M, Alba E, et al. Praktisk prognostisk indeks for pasienter med metastatisk tilbakevendende brystkreft: retrospektiv analyse av 2322 pasienter FRA geicam Spanish el Alamo Register. Brystkreft Res Behandle. (2010) 122:591–600. doi: 10.1007/s10549–009-0687–4
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Regierer AC, Wolters R, Ufen MP, Weigel A, Novopashenny I, Kohne CH, et al. An internally and externally validated prognostic score for metastatic breast cancer: analysis of 2269 patients. Ann Oncol. (2014) 25:633–8. doi: 10.1093/annonc/mdt539
PubMed Abstract | CrossRef Full Text
6. Marko NF, Xu Z, Gao T, Kattan MW, Weil RJ. Forutsi overlevelse hos kvinner med brystkreft og hjernemetastase: et nomogram overgår nåværende overlevelsespredikasjonsmodeller. Kreft. (2012) 118:3749–57. doi: 10.1002 / cncr.26716
PubMed Abstrakt | CrossRef Fulltekst / Google Scholar
7. Subbiah IM, Lei X, Weinberg JS, Sulman EP, Chavez-MacGregor M, Tripathy D, Et al. Validering og utvikling av en modifisert brystgradert prognostisk vurdering som et verktøy for overlevelse hos pasienter med brystkreft og hjernemetastaser. J Clin Oncol. (2015) 33:2239–45. doi: 10.1200 / JCO.2014.58.8517
PubMed Abstrakt | CrossRef Fulltekst/Google Scholar
9. E-MAIL:
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Duan XF, Dong NN, Zhang T, Li Q. The prognostic analysis of clinical breast cancer subtypes among patients with liver metastases from breast cancer. Int J Clin Oncol. (2013) 18:26–32. doi: 10.1007/s10147–011-0336-x
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dueck AC, Mendoza TR, Mitchell SA, Reeve BB, Castro KM, Rogak LJ, et al. Validitet og Pålitelighet av US National Cancer Institute ‘ S Pasientrapporterte Utfallsversjon Av Common Terminology Criteria For Adverse Events (PRO-CTCAE). JAMA Oncol. (2015) 1:1051–9. doi: 10.1001 / jamaoncol.2015.2639
PubMed Abstrakt | CrossRef Fulltekst/Google Scholar
17. Xie J, Xu Z. En Populasjonsbasert Studie på Levermetastaser Hos Kvinner Med Nylig Diagnostisert Brystkreft. Kreft Epidemiol Biomarkører Prev. (2019) 28:283–92. doi: 10.1158/1055–9965.EPI-18–0591
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Dawood S, Broglio K, Ensor J, Hortobagyi GN, Giordano SH. Survival differences among women with de novo stage IV and relapsed breast cancer. Ann Oncol. (2010) 21:2169–74. doi: 10.1093/annonc/mdq220
PubMed Abstract | CrossRef Full Text
19. Den Brok WD, Speers CH, Gondara L, Baxter E, Tyldesley SK, Lohrisch CA. Overlevelse med metastatisk brystkreft basert på innledende presentasjon, de novo versus residiverende. Brystkreft Res Behandle. (2017) 161:549–56. doi: 10.1007 / s10549–016-4080–9
PubMed Abstrakt | CrossRef Full Tekst/Google Scholar
20. Fujiwara R, Haag M, Schaeffeler E, Nies AT, Zanger UM, Schwab M. Systemisk regulering av bilirubin homeostase: potensielle fordeler med hyperbilirubinemi. Hepatologi. (2018) 67:1609–19. doi: 10.1002/hep.29599
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Liu X, Meng QH, Ye Y, Hildebrandt MAT, Gu J, Wu X. Prognostic significance of pretreatment serum levels of albumin, LDH and total bilirubin in patients with non-metastatic breast cancer. Carcinogenesis. (2015) 36:243–8. doi: 10.1093/carcin/bgu247
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Vander Heiden MG, Cantley LC, Thompson CB. Forstå warburg-effekten: de metabolske kravene til celleproliferasjon. Science. (2009) 324:1029–33. doi: 10.1126 / vitenskap.1160809
PubMed Abstrakt | CrossRef Full Tekst/Google Scholar
24. Mishra D, Banerjee D. Laktatdehydrogenaser som metabolske forbindelser mellom tumor og stroma i tumormikromiljøet. Kreft. (2019) 11:750. doi: 10.3390/cancers11060750
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Pelizzari G, Basile D, Zago S, Lisanti C, Bartoletti M, Bortot L, et al. Lactate dehydrogenase (ldh) response to first-line treatment predicts survival in metastatic breast cancer: first clues for a cost-effective and dynamic biomarker. Cancers. (2019) 11:1243. doi: 10.3390/cancers11091243
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Hopkins AM, Rowland A, McKinnon RA, Sorich MJ. Predictors of long-term disease control and survival for HER2-positive advanced breast cancer patients treated with pertuzumab, trastuzumab, and docetaxel. Front Oncol. (2019) 9:789. doi: 10.3389/fonc.2019.00789
PubMed Abstract | CrossRef Full Text | Google Scholar
34. G, Bafaloukos D, Koutsoukou V, Pektasider D, Skarlos D, Et al. Metastatisk brystkreft med levermetastaser: en registeranalyse av klinikopatologiske, styrings-og utfallskarakteristikker hos 500 kvinner. Brystkreft Res Behandle. (2006) 97:237–44. doi: 10.1007 / s10549–005-9117–4
PubMed Abstract | CrossRef Full Text/Google Scholar
Leave a Reply