Grenser I Farmakologi
Innledning
Liposomer er en type nanocarrier som har blitt mye undersøkt for narkotika-levering formål. De er sammensatt av fosfolipid bilayers som omslutter en distinkt vandig plass, for derved å tillate innkapsling av både hydrofile og hydrofobe forbindelser (Metselaar og Storm, 2005). Liposomer er i stand til å stabilisere terapeutiske forbindelser og overvinne barrierer for cellulær og vevopptak (Ding et al., 2006; Hua og Wu, 2013). Dette tillater dem å forbedre målretting av forbindelser til sykdomssteder og dermed redusere akkumulering i ikke-målorganer (Bakker-Woudenberg et al., 1994; Mastrobattista et al., 1999; Hua, 2013; Hua et al., 2015; Jørgen et al., 2015; Zununi Vahed et al., 2017). Det er fire hovedtyper av liposomer basert på deres overflateegenskaper-konvensjonelle liposomer, Pegylerte liposomer, ligandmålrettede liposomer og theranostiske liposomer (Figur 1; Sercombe et al., 2015). Ligand-målrettede liposomer gir potensial for stedsspesifikk levering av legemidler til visse vev eller organer som selektivt uttrykker målrettet ligand (Willis Og Forssen, 1998; Bendas, 2001; Sawant og Torchilin, 2012), mens Pegylerte liposomer gir sterisk hindring for å forbedre sirkulasjonshalveringstiden til leveringssystemet etter systemisk administrasjon (Torchilin, 1994; Wang et al., 2015). Liposomer som inneholder en kombinasjon av de forskjellige leveringsplattformene, kan ytterligere forbedre leveransen av innkapslede forbindelser, avhengig av administrasjonsvei og sykdomssted.
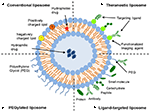
FIGUR 1. Skjematisk fremstilling av de forskjellige typer liposomale legemiddelleveringssystemer – (A) Konvensjonelt liposom, (B) Pegylert liposom, (C) Ligandmålrettet liposom og (D) Theranostisk liposom (Sercombe et al., 2015).
Etter produksjonsprosessen er liposomer karakterisert for å sikre homogenitet på tvers av en rekke parametere, inkludert medikamentinnkapsling, ligandkonjugering, lipidsammensetning, overflateladning og morfologiske egenskaper (f.eks. størrelse, form og antall lameller) (Kuntsche et al., 2011). Disse egenskapene er viktige da de kan ha stor innvirkning på liposomers oppførsel både in vitro og in vivo (Sawant og Torchilin, 2012; Sercombe et al., 2015). Anerkjennelse og clearance av liposomer ved kroppens forsvar, inkludert retikuloendotelialsystemet (RES) og adsorpsjon av opsoniner med påfølgende opptak av det mononukleære fagocytiske systemet, er viktige bidragsytere til clearance og nedbrytning av liposomer (Senior, 1987; Cullis et al., 1998; Ishida et al., 2001). Derfor er det viktig å kunne bestemme de fysisk-kjemiske egenskapene til produserte liposomer for å optimalisere en formulering for videre translasjonell evaluering.et viktig aspekt i den fysisk-kjemiske vurderingen av liposomer er å visualisere morfologien til nanopartikler ved hjelp av mikroskopi. Det finnes en rekke teknikker tilgjengelig for imaging liposomer og andre nanopartikler som kan grovt kategoriseres i lys, elektron eller atomkraftmikroskopi (Bibi et al., 2011). Hver teknikk har sine egne fordeler og begrensninger, som bør vurderes når man vurderer studier på nanopartikkelbaserte legemiddelleveringssystemer (Tabell 1). Denne gjennomgangen vil evaluere hver avbildningsteknikk som brukes til å vurdere de morfologiske egenskapene til liposomer.

TABELL 1. Sammendrag av gjeldende bildeteknikker for karakterisering av liposommorfologi.
Lysmikroskop
Lys eller optisk mikroskopi refererer til mikroskoper som bruker synlig lys og et arrangement av linser for å forstørre et synsfelt (Murphy Og Davidson, 2012c). Grunnleggende lysmikroskopi i seg selv er ikke i stand til å gi omfattende informasjon om lipid dobbeltlaget i forhold til detaljene som tilbys av andre mikroskopi teknikker. Det kan imidlertid brukes til raskt å få et bilde av vesikler ved hjelp av grunnleggende laboratorieutstyr (Bibi et al., 2011). Denne teknikken kan være spesielt nyttig når man samler generell informasjon om størrelse, form, homogenitet og grad av aggregering av en liposomprøve (Nallamothu et al., 2006). Lysmikroskoper har en endelig oppløsning på ∼250 nm (styrt av den minste diffraksjonsbegrensede spotstørrelsen som kan oppnås av instrumentet), og som sådan er de vanligvis ikke i stand til å gi detaljert informasjon om strukturer av små unilamellære vesikler (Suver) og lamellariteten til vesikler (Bibi et al., 2011). Vanligvis kan lysmikroskopi bare gi betydelig informasjon om gigantiske unilamellære vesikler( GUVs), som kan variere fra enkelt til hundrevis av mikrometer i diameter (Bagatolli, 2009). Inkorporering av fluorescerende prober, polarisasjonsteknikker og anvendelse av høyoppløselig konfokal mikroskopi kan gi mer informasjon OM 3d-strukturen og lamellariteten til vesiklene (Bagatolli, 2009).
Polarisasjonsmikroskopi
denne typen lysmikroskopi benytter den unike evnen til polarisert lys til å samhandle med polariserbare bindinger av bestilte molekyler (Murphy Og Davidson, 2012d). Forbedret lysabsorpsjon oppstår når molekylære dipoler i prøven er justert med polarisasjonsvektoren til den innfallende lysbølgen; dette resulterer i faseforskjeller mellom prøvetakingslysstråler, som igjen gir interferensavhengige endringer i amplitude i bildeplanet (Murphy og Davidson, 2012d). Bildekontrast oppstår da ikke bare fra virkningen av interferens og diffraksjon, men også på grunn av tilstedeværelsen av bestilte molekylære ordninger (Murphy Og Davidson, 2012d). Den kan brukes til å studere formen og dynamikken i mange bestilte cellestrukturer, inkludert lipid bilayers av plasmamembraner (Bibi et al.(2011; Murphy Og Davidson, 2012d). Bilder kan fås i enten monokrom eller farge. Denne teknikken gir en alternativ metode for å visualisere liposomer, spesielt for å bekrefte dannelsen av vesikler. Det gir ikke avgjørende observasjoner angående bilagskarakteristikkene eller lamellariteten til vesiklene (Bibi et al., 2011). I tillegg er polarisasjonsmikroskopi også begrenset av størrelsen på vesiklene som kan visualiseres, med store vesikler i mikrometerområdet som har optimal klarhet. Denne teknikken gir ikke klare bilder av partikler i nanometerområdet.
Fluorescensmikroskopi
Fluorescens eller «epifluorescens» mikroskopi er en spesiell form for lysmikroskopi som utnytter evnen til fluorokromer å avgi lys etter å ha blitt begeistret med lys av en viss bølgelengde (Murphy Og Davidson, 2012b). Denne teknikken er mye brukt i biofysikk for å gi viktig informasjon om strukturen og dynamikken i membrankomponenter (Bouvrais et al., 2010). I disse studiene, fluorescerende prober er spesielt innlemmet i membranen under etterforskning, tillater visualisering av strukturen. Et stort utvalg av fluorescerende fargestoffer med ulike kjemiske og fotoniske egenskaper er kommersielt tilgjengelig, catering til en rekke forskningsspørsmål. For eksempel kan visse fluorescerende fargestoffer foretrekke spesifikke membranmiljøer som viser forskjellige arrangementer og lateral pakking (Bouvrais et al., 2010). Som sådan tillater fluorescensmikroskopi potensialet til samtidig å anvende flere prober i en prøve for å gi informasjon om membranstrukturen selv. Fluorescerende prober kan plasseres i det vandige rommet, så vel som lipid-dobbeltlaget av liposomer (Bibi et al., 2011). Dette arrangementet kan være spesielt nyttig når Du ser På Guver, hvor informasjon kan fås angående form, størrelse og fluiditet av lipid vesiklene (Klymchenko et al., 2009; Bouvrais et al., 2010). Inkorporering av prober, som rhodamin-merkede lipider, direkte inn i lipid-dobbeltlaget, kan også tillate visualisering av lamellariteten til liposomer (Bibi et al., 2011).ulempen med fluorescerende mikroskopi er at tilsetningen av prober og fargestoffer til et membransystem potensielt kan forstyrre egenskapene til det liposomale leveringssystemet (Bouvrais et al., 2010; Bibi et al.(2011; Murphy Og Davidson, 2012b). Bruk av lave fargekonsentrasjoner (≤1 mol%) har imidlertid vist seg å ha minimal innvirkning på membranets fysiske egenskaper (Bouvrais et al., 2010). Det er også viktig å merke seg at valget av fluorescerende fargestoff er et kritisk skritt, da noen fargestoffer kan indusere store endringer i vertsmembranen og / eller forårsake eksperimentelle artefakter, noe som resulterer i unøyaktig datatolkning (Bouvrais et al., 2010). I tillegg kan fotoindusert lipidperoksydasjon også føre til domeneformasjon selv i enkle fargesystemer. Denne prosessen kan resultere i dannelse av store flåter og spontan fasettdannelse (Bouvrais et al., 2010). Langvarig eksponering for fluorescerende lys kan også føre til bleking og tap av fluorescens intensitet. Derfor er valget av fluorescerende fargestoff og utvikling av nye membranprober viktige hensyn ved bruk av fluorescensmikroskopi (Klymchenko et al., 2009).
Konfokal Mikroskopi
Konfokal skanning mikroskopi har vært en fremgang i området fluorescens mikroskopi. I stedet for å belyse hele prøven, bygges et bilde ved å skanne en (eller flere) fokuserte lysstråler over prøven. Lys som kommer tilbake fra den opplyste prøven passerer gjennom en blenderåpning som avviser ut-av-fokus lys fra over og under planet av interesse; sikre at bare bilder fra en liten dybdeskarphet oppnås, noe som forbedrer oppløsningen utenfor flyet (Bibi et al.(2011; Murphy Og Davidson, 2012a). Ved hjelp av denne teknikken samles en «z-stack» av bilder, fra toppen av vesiklet etterfulgt av bilder tatt i definerte z-trinn til bunnen av prøven, noe som resulterer i et sammensatt 3D-bilde av prøven (Bibi et al.(2011; Murphy Og Davidson, 2012a). Konfokal skanning mikroskopi har blitt en mer attraktiv teknikk over epifluorescent lysmikroskop på grunn av sin overlegne bildeklarhet. Når Det Gjelder GUVs, er denne teknikken i stand til å visualisere den indre strukturen til lipidsystemene, noe som ofte ikke er mulig med andre mikroskopimetoder (Ruozi et al.(2011; Mertins Og Dimova, 2013). For eksempel kan separasjon av vandig og lipid dobbeltlagsfase tydelig visualiseres i større vesikler(Mertins Og Dimova, 2013). Konfokal mikroskopi er imidlertid fortsatt diffraksjonsbegrenset og kan derfor ikke produsere hd-bilder Av Suver eller oligolamellære liposomer (Ruozi et al., 2011).
Elektronmikroskopiteknikker
Elektronmikroskopi er en metode for visualisering av vesikler under svært høy forstørrelse (Henry, 2005). Det er mye brukt i karakterisering av lipid vesikler som elektron bølgelengde (og dermed diffraksjon-begrenset oppløsning), er mange størrelsesordener lavere enn for optisk mikroskopi, og gir derfor super-oppløsning for klar visualisering av små liposomer(Bibi et al., 2011; Ruozi et al., 2011). Denne teknikken bruker en stråle av elektroner fokusert på overflaten av prøven av ulike elektromagnetiske linser. Elektronene blir deretter spredt av prøven, og blir deretter refokusert og forstørret av en ytterligere serie elektromagnetiske linser i bildesøylen for å produsere et projisert bilde (Henry, 2005). Det finnes en rekke forskjellige typer elektronmikroskop, som hver krever en annen prøveprepareringsmetode.
Scanning Electron Microscopy (SEM)
Scanning electron microscopes (SEMs) bruker en elektronstråle som skannes over eller over en prøve (i stedet for gjennom en prøve) for å produsere et forstørret bilde av et objekt (Adler Og Schiemann, 1985). Alder et al. først forsøkte Å bruke SEM til å karakterisere liposomer i 1984 (Adler Og Schiemann, 1985). De viste at bruk av frysetørkingsmetoden for å forberede liposomprøver for SEM resulterte i en stor andel synlige klumper og crusted materiale (Adler Og Schiemann, 1985). Nyere studier har vist at liposomstrukturen i seg selv kan lide forstyrrelser på grunn av høyvakuumforholdene og fargeprosessene som kreves for denne forberedelsesteknikken (Ruozi et al., 2011). SEM er nå ikke vanlig brukt til å analysere liposomer fordi det krever at prøven tørkes eller festes før avbildning (Ruozi et al., 2011). SEM kan imidlertid gi generell informasjon om den konsentriske strukturen til de forskjellige lipidlagene, samt gi detaljer om størrelsen og sfærisk morfologi av et preparat (Nirale et al., 2009).
Transmisjonselektronmikroskopi (TEM)
Transmisjonselektronmikroskopi (TEM) er den mest brukte avbildningsmetoden for evaluering av strukturen av nanopartikler (Henry, 2005; Kuntsche et al., 2011). Det innebærer fremstilling av en tynn prøve (< 100 nm tykk) som er plassert i et vakuumkammer. Elektronstrålen krysser prøven, hvor den deretter fokuseres av objektivlinsen for å danne et bilde. TEM kan lett vise myke prøver med en romlig oppløsning ned til godt under 1 nm i størrelse (Henry, 2005; Kuntsche et al., 2011; Ruozi et al., 2011). Denne teknikken kan videre kategoriseres basert på prøveprepareringsmetoden som benyttes-spesielt negativ farging, frysefraktur og kryogen TEM. Det kan gi informasjon om overflate modifikasjoner av nanopartikler som det gir bedre kontrast og kontur av bilder enn andre mikroskopi teknikker. For eksempel viste konjugering av transferrin til overflaten AV dspc/kolesterol liposomer et partikkelformet overflatebelegg med negativ flekk TEM, som var fraværende i de ukonjugerte liposompreparatene (Anabousi et al., 2005). I et separat eksperiment ble spesifikke antistoffer hevet mot humant transferrin tilsatt før den negative flekkprosedyren for å bekrefte identiteten til partikkeloverflatebelegget (Anabousi et al., 2005). DERFOR gir TEM muligheten til å oppnå mye forbedret oppløsning ved vurdering av konjugering av ligander til overflaten av liposomer.
Negativ Fargingsteknikk
i negativ flekk TEM innebærer prøvepreparering en liten mengde hydrert prøve som plasseres på et rutenett. Da vesiklene er i direkte kontakt med rutenettet, kan deres orientering og morfologi påvirkes, og derfor bør dette tas i betraktning (Bibi et al., 2011). Det er også nødvendig å legge liposomene i et egnet elektrontett materiale (f. eks., tungmetallsalter som uranylacetat eller fosfotungstinsyre) som gir høy kontrast, slik at vesikler kan ses mot en mørkfarget bakgrunn (Ruozi et al., 2011). Den negative fargingsteknikken er relativt rask og enkel; det har imidlertid vist seg å forårsake endringer i den opprinnelige liposomstrukturen og kan føre til dannelse av lyse og mørke frynser som kan forveksles med lamellære strukturer (Bibi et al., 2011; Ruozi et al., 2011). I tillegg kan plassering av prøven under vakuum føre til ytterligere dehydrering av prøven, noe som igjen kan føre til endringer i strukturen av vesiklene (Bibi et al., 2011). Mens den negative flekken TEM teknikken kan gi mye høyere forstørrelse for imaging nanopartikler, gjør skaden på liposomstrukturen det vanskelig å nøyaktig vurdere de morfologiske egenskapene til prøven. Derfor er andre bildebehandlingsteknikker generelt nødvendig for å bekrefte resultatene.
Fryse-Fraktur Teknikk
fryse–fraktur teknikken krever ingen tørkeprosess og kan gi ytterligere informasjon om den interne strukturen av nanopartikler (Kuntsche et al., 2011). Denne metoden innebærer å plassere en prøve på ET tem-rutenett som er smeltet mellom to kobber – eller gullholdere (Severs, 2007). Prøven blir forglasset via hurtig frysing, typisk med flytende propan eller flytende nitrogen, før den brytes langs områder av prøven med svake molekylære interaksjoner. Denne bruddflaten kan videre etses og skygges med et tynt platina – eller karbonlag for å gi en «negativ» kopi av bruddprøveplanet (Severs, 2007; Kuntsche et al., 2011). Replikaen rengjøres deretter med et organisk løsemiddel for å fjerne alle rester før visualisering under et tem-mikroskop. Da disse replikene er så stabile, kan de lagres og vises senere (Kuntsche et al., 2011). Den største fordelen med denne teknikken er at replikaene nøye reflekterer den opprinnelige tilstanden til prøven, og kan gi detaljert informasjon OM 3d-strukturen i vesiklene og bilagsorganisasjonen (Bibi et al., 2011; Kuntsche et al., 2011). Denne informasjonen inkluderer multilamellær konstruksjon og dobbeltlagspakning av multilamellære vesikler. Denne teknikken kan også vurdere aggregatstørrelse og kan være spesielt nyttig for å undersøke samspillet mellom kationiske liposomer OG DNA (Bibi et al., 2011). Imidlertid kan gjenstander fortsatt forekomme i prøven under forberedelse på grunn av utilstrekkelig frysehastighet, re-deponering av løsningsmiddelmolekyler og / eller mekanisk stress (Severs, 2007; Kuntsche et al., 2011). For eksempel kan en «rippling effekt» oppstå på Suvene i prøven (Bibi et al., 2011). Dette er en vanlig dobbeltlagsdeformasjon som skyldes en forstyrrelse i overgangene til acylkjedene før frysing. Inkuberende vesikler mellom forovergangen og selve overgangstemperaturen kan også forårsake krusninger (Bibi et al., 2011). Interessant kan dette brukes til å gi informasjon om lipidfaseovergangene som oppstår med varierende natur av lipider som brukes til liposomale preparater (Bibi et al., 2011).
Kryogen TEM
Kryogen tem (cryo-TEM) Er en variant av tem hvor tynne vandige hydratfilmer som er forglasset i flytende etan brukes før avbildning. Denne teknikken tillater analyse av liposomer i deres mest opprinnelige tilstand, Og er et verdifullt verktøy for å bestemme størrelse, form, indre struktur og lamellaritet av liposomer (Weisman et al., 2004; Bibi et al., 2011; Kuntsche et al., 2011). Den største fordelen med raskt frysende liposomprøver er å minimere dannelsen av iskrystaller og bevare proteiner eller andre materialer (Bibi et al., 2011; Kuntsche et al., 2011). Dette er gunstig der proteiner ELLER DNA har blitt innkapslet i nanopartikler (Weisman et al., 2004; Kuntsche et al., 2011). Cryo-TEM er den mest nyttige formen for mikroskopi som for tiden er tilgjengelig for å studere liposomer, da det unngår problemer med kjemisk fiksering, dehydrering, kutting og farging-som alle kan påvirke vesiklens morfologi (Bibi et al., 2011). Oppløsningsområdet er ∼5 til 500 nm, som definert av tykkelsen på filmen (Almgren et al., 2000). Imidlertid bør flere begrensninger noteres med denne teknikken, inkludert det faktum AT bare ET 2D-bilde er hentet FRA 3D-objekter (som generelt også gjelder for de fleste andre mikroskopiteknikker). For å overvinne denne begrensningen er rekonstruksjon AV 3D-former fra et tilstrekkelig stort antall 2d-bilder av tilfeldig orienterte ikke-sfæriske partikler mulig (Orlova et al., 1999), samt visning av prøven i forskjellige hellingsvinkler for å oppnå informasjon OM 3D-form(Van Antwerpen Og Gilkey, 1994). Kryogen elektrontomografi (cryo-ET) kan også brukes i stedet for Å oppnå 3D-bilder (Le Bihan et al., 2009). Cryo-TEM benytter også lavere doser elektroner, noe som betyr at det ofte har en lavere oppløsning sammenlignet med andre metoder (Bibi et al., 2011; Kuntsche et al., 2011). Artefakter er fortsatt mulige på grunn av dannelsen av en tynn film av amorf is og bruken av blotting på prøven som påfører skjærkrefter under filmdannelsen (Almgren et al ., 2000; Bibi et al., 2011).
Environmental Scanning Electron Microscopy (ESEM)
Environmental scanning electron microscopy (ESEM) Er Et avbildningssystem som ikke krever bruk av feste, farging eller frysing av vesikler, og kan tillate avbildning av dynamiske endringer av våte systemer uten tidligere prøvepreparering (Muscariello et al., 2005; Ruozi et al., 2011). Hovedtrekk VED ESEM er tilstedeværelsen AV vanndamp i mikroskopkammeret. Evnen til å opprettholde en vannholdig atmosfære rundt prøven som kan være delvis eller til og med fullt hydrert, gjøres mulig ved bruk av et vakuumsystem med flere blenderåpninger som gjør at bildekammeret kan opprettholdes ved trykk opp til 55 hPa (Bibi et al., 2011; Ruozi et al., 2011). Den primære elektronstrålen kan generere sekundære elektroner som deretter støter på dampmolekyler, noe som fører til en kaskadeforsterkning av signalet før de når detektoren. PÅ grunn AV DETTE KREVER ESEM ikke prøvepreparering (Muscariello et al., 2005). Denne teknikken tillater variasjon i prøvemiljøet gjennom en rekke trykk, temperatur og gassblandinger (Mohammed et al., 2004), som er nyttig når man bestemmer hvordan miljøendringer påvirker vesiklene. Dette gjelder for nanofarmasøytisk formulering og stabilitetsstudier (Bibi et al., 2011). ESEM har også blitt brukt til å analysere stoffbelastning i dobbeltlaget av liposomer (Mohammed et al., 2004), samt å bestemme størrelsen og formen på vesikler. En begrensning AV ESEM er at den ikke kan gi detaljert informasjon om lamellaritet og interne arkitekturen i nanoskala strukturer (Ruozi et al., 2011).
Atomic Force Mikroskopi (AFM)
Atomic force mikroskopi (AFM), også kjent som scanning-force mikroskopi (SFM), er en type scanning probe mikroskop teknikk. Det fungerer ved å kjøre en skarp spiss festet til en cantilever og sensor over overflaten av en prøve og måle overflatekrefter mellom sonden og prøven (Sitter Et al., 2010). Som cantilever går langs prøven overflaten, den beveger seg opp og ned på grunn av overflaten funksjoner og cantilever avbøyer tilsvarende. Denne avbøyningen kvantifiseres vanligvis ved hjelp av en optisk sensor, med laserstrålen reflektert på baksiden av cantilever på lysdetektoren (Sitterberg et al., 2010). AFM trenger ikke å operere i vakuum og kan operere i omgivende luft eller under væske; derfor blir det i økende grad brukt til å avbilde biologiske prøver og nanopartikler (Liang et al., 2004a, b; Ruozi et al., 2005, 2009). AFM har enestående oppløsning i størrelsesorden fraksjoner av et nanometer og kan gi ET 3d-bilde av liposomer sammen med detaljer om morfologi, størrelsesfordeling, homogenitet og stabilitet (Liang et al., 2004a, b; Ruozi et al., 2005, 2007, 2009). Viktigere, KAN AFM brukes til å karakterisere overflaten modifikasjoner av liposomer og oppdage ligander (f.eks antistoffer og polymerer) konjugert på liposomal membran overflaten (Bendas et al., 1999; Moutardier et al., 2003; Anabousi et al., 2005; Liang et al., 2005). For eksempel, Bendas et al. brukes AFM å forstørre liposomal membran grensen og var i stand til bilde trimeric strukturer, ca 8-10 nm i diameter, som representerte koblingen Av IgG antistoffer til liposome overflaten (Bendas et al., 1999). Funnene viste at effektiviteten av teknikken var svært avhengig av konjugeringsmetoden som ble brukt, med antistoffer konjugert direkte til den liposomale overflaten som var synlig MED AFM (begrenset proteinmobilitet), i forhold til antistoffer festet til PEG-kjeder. Det var tydelig at PEG-kjedene forårsaket høy proteinmobilitet og derfor ikke kunne skannes (Bendas et al., 1999). Omvendt, Anabousi et al viste at inkorporering Av Pegylerte lipider i liposomer indusert en sterisk stabilisering med liposomer opprettholde en sfærisk form (Anabousi et al., 2005). AFM-bilder av overflaten av ukonjugerte liposomer var glatte og ingen strukturer kunne observeres, mens konjugering av transferrin til overflaten Av Pegylerte liposomer ble visualisert som små kuleformede strukturer (Anabousi et al., 2005). På samme måte produserte Moutardier et al liposomer med polymere kjerner (LSP) som besto av stoffer lastet inn i polymere partikler som dannet kjernen av lipidblærer (Moutardier et al., 2003). Bilder tatt MED AFM viste tilstedeværelsen av et polymernettverk på den ytre overflaten, noe som antydet at kollagenpolymerkjernen utstrålte og dannet et overflatelag PÅ LSP (Moutardier et al., 2003). I tillegg til overflatestrukturelle detaljer KAN AFM gi informasjon om de mekaniske og kjemiske egenskapene til en prøveflate gjennom kraftmålinger (Ruozi et al., 2007). For eksempel, Mao Et al. brukt denne teknikken for å vurdere elastisitet og klebende egenskaper av liposomer (Mao et al., 2004). EN begrensning AV AFM er behovet for nanopartikler som skal adsorberes på støtteflater, for eksempel glimmer eller silisiumskiver. Adsorpsjonen av liposomer på et fast substrat har potensial til å endre størrelsen og formen på vesiklene, og forårsake flattning. (Ruozi et al., 2007). I tillegg kan den periodiske kontakten til probingstippen trekke liposomene når den beveger seg over vesiklene i en prøve (Jass et al., 2000). TIL tross for DETTE ER AFM fortsatt et nyttig verktøy i evalueringen av liposomer.
Konklusjon
det finnes et bredt spekter av imaging teknikker tilgjengelig for å evaluere morfologi av liposomer, med hver har sine egne fordeler og ulemper. Lysmikroskopi kan gi generelle detaljer om størrelsen og formen på større vesikler og homogeniteten til en prøve på en relativt rask måte. Omvendt ER TEM den mest brukte teknikken for å undersøke morfologien til liposomer i mye mer detalj; imidlertid må potensialet for strukturelle endringer med hver tem-undertype på grunn av farging og/eller eksponering for vakuumforhold vurderes ved tolkning av resultatene. ESEM er mest nyttig ved bestemmelse av liposomale endringer som respons på miljøet, MENS AFM fremstår som en nyttig metode i den morfologiske analysen av nanopartikler og gir maksimal oppløsning av den liposomale overflaten. BÅDE AFM og TEM er i stand til å avbilde ligander konjugert til overflaten av liposomer og gi komplementær informasjon om overflateendringer. Samlet sett er valg av teknikk avhengig av hvilke morfologiske egenskaper og detaljgrad som kreves. I tillegg er det viktig å forstå de potensielle effektene av prøveprepareringsmetoden for hver avbildningsteknikk i utvelgelsesprosessen.
Forfatterbidrag
Utkast av manuskript: A-LR og SH. Revidere artikkelen kritisk for viktig intellektuelt innhold: SH, PD, JF, WP, AM, DS og AW.
Interessekonflikt
forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller økonomiske forhold som kan tolkes som en potensiell interessekonflikt.
Takk
forfatterne ønsker å takke Pharmacy Research Trust Of New South Wales, Rebecca L. Cooper Medical Research Foundation, Gladys M. Brawn Fellowship, ausEE Research Foundation og University of Newcastle for å gi økonomisk støtte til vår forskning.
Adler, K., Og Schiemann, J. (1985). Karakterisering av liposomer ved å skanne elektronmikroskopi og frysefrakturteknikken. Micron Microsc. Acta 16, 109-113. doi: 10.1016/0739-6260(85)90039-5
CrossRef Full Text | Google Scholar
Almgren, M., Edwards, K., Og Karlsson, G. (2000). Cryo transmisjonselektronmikroskopi av liposomer og relaterte strukturer. Kolloider Surfe. En Fysikkchem. Eng. ASP. 174, 3–21. doi: 10.1016 / S0927-7757 (00)00516-1
Kryssref Fulltekst | Google Scholar
Anabousi, S., Laue, M., Lehr, Cm, Bakowsky, U. Og Ehrhardt, C. (2005). Vurdering av transferrin modifikasjon av liposomer ved atomkraftmikroskopi og transmisjonselektronmikroskopi. Eur. J. Pharm. Biopharm. 60, 295–303. doi: 10.1016 / j.ejpb.2004.12.009
PubMed Abstract | CrossRef Full Text / Google Scholar
Bagatolli, La (2009). Membraner Og Fluorescensmikroskopi. Anmeldelser I Fluorescens 2007. New York, NY: Springer, 33-51. doi: 10.1007/978-0-387-88722-7_2
CrossRef Full Text/Google Scholar
Bakker-Woudenberg, I. A., Storm, G. Og Woodle, M. C. (1994). Liposomer i behandling av infeksjoner. J. Narkotikamål. 2, 363–371. doi: 10.3109/10611869408996811
PubMed Abstract | CrossRef Full Text/Google Scholar
Bendas, G. (2001). Immunoliposomer: en lovende tilnærming til å målrette kreftbehandling. BioDrugs 15, 215-224. doi: 10.2165 / 00063030-200115040-00002
CrossRef Full Text / Google Scholar
Bendas, G., Krause, A., Bakowsky, U., Vogel, J., Og Rothe, U. (1999). Målbarhet av nye immunoliposomer utarbeidet av en ny antistoffkonjugeringsteknikk. Int. J. Pharm. 181, 79–93. doi: 10.1016 / S0378-5173 (99)00002-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Bibi, S., Kaur, R., Henriksen-Lacey, M., McNeil, S. E., Wilkhu, J., lattmann, e., et al. (2011). Mikroskopi avbildning av liposomer: fra dekkglass til miljø SEM. Int. J. Pharm. 417, 138–150. doi: 10.1016 / j. ijpharm.2010.12.021
PubMed Abstract | CrossRef Full Text/Google Scholar
Bouvrais, H., Pott, T., Bagatolli, L. A., Ipsen, J. H. og Meleard, P. (2010). Påvirkning av membranforankrede fluorescerende prober på de mekaniske egenskapene til lipidbilayers. Biochim. Biophys. Acta 1798, 1333-1337. doi: 10.1016 / j.bbamem.2010.03.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Cullis, Pr, Chonn, A., og Semple, S. C. (1998). Interaksjoner mellom liposomer og lipidbaserte bærersystemer med blodproteiner: forhold til klaring atferd in vivo. Adv. Drug Deliv. Åp 32, 3-17. doi: 10.1016/S0169-409x(97)00128-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Ding, B. S., Dziubla, T., Shuvaev, V. V., Muro, S., Og Muzykantov, V. r. (2006). Avanserte legemiddelleveringssystemer som retter seg mot det vaskulære endotelet. Mol. Interv. 6, 98–112. doi: 10.1124 / mi.6.2.7
PubMed Abstract | CrossRef Full Text | Google Scholar
Henry, C. R. (2005). Morfologi av støttede nanopartikler. Prog. Surf. Sci. 80, 92–116. doi: 10.1016 / j.progrurf.2005.09.004
CrossRef Full Text | Google Scholar
Hua, S. (2013). Targeting sites of inflammation: intercellular adhesjon molecule-1 som et mål for nye inflammatoriske terapier. Front. Pharmacol. 4:127. doi: 10.3389 / fphar.2013.00127
PubMed Abstract | CrossRef Full Text | Google Scholar
Hua, S., Marks, E., Schneider, jj, Og Keely, S. (2015). Fremskritt i oral nano – leveringssystemer for kolon målrettet levering av legemidler i inflammatorisk tarmsykdom: selektiv målretting mot syke versus sunt vev. Nanomedisin 11, 1117-1132. doi: 10.1016 / j.nano.2015.02.018
PubMed Abstract | CrossRef Full Text / Google Scholar
Hua, S., Og Wu, S. Y. (2013). Bruk av lipidbaserte nanocarriers for målrettede smertebehandlinger. Front. Pharmacol. 4:143. doi: 10.3389 / fphar.2013.00143
PubMed Abstract | CrossRef Full Text | Google Scholar
Ishida, T., Harashima, H., Og Kiwada, H. (2001). Interaksjoner av liposomer med celler in vitro og in vivo: opsonins and receptors. Curr. Drug Metab. 2, 397–409. doi: 10.2174/1389200013338306
PubMed Abstract | CrossRef Full Text | Google Scholar
Jass, J., Tjarnhage, T., and Puu, G. (2000). From liposomes to supported, planar bilayer structures on hydrophilic and hydrophobic surfaces: an atomic force microscopy study. Biophys. J. 79, 3153–3163. doi: 10.1016/S0006-3495(00)76549-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Klymchenko, A. S., Oncul, S., Didier, P., Schaub, E., Bagatolli, L., Mcgill, G., et al. (2009). Visualisering av lipiddomener i gigantiske unilamellære vesikler ved hjelp av en miljøfølsom membranprobe basert på 3-hydroksyflavon. Biochim. Biophys. Acta 1788, 495-499. doi: 10.1016 / j.bbamem.2008.10.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuntsche, J., Horst, J. C., Og Bunjes, H. (2011). Kryogen transmisjonselektronmikroskopi (cryo-TEM) for å studere morfologien til kolloidale legemiddelleveringssystemer. Int. J. Pharm. 417, 120–137. doi: 10.1016 / j. ijpharm.2011.02.001
PubMed Abstract | CrossRef Full Text/Google Scholar
Le Bihan, O., Bonnafous, P., Marak, L., Bickel, T., Trepout, S., Mornet, S., et al. (2009). Cryo-elektron tomografi av nanopartikkel transmigrasjon til liposom. J. Struct. Biol. 168, 419–425. doi: 10.1016/j.jsb.2009.07.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Liang, X., Mao, G., Og Ng, K. Y. (2004a). Mekaniske egenskaper og stabilitetsmåling av kolesterolholdig liposom på glimmer ved atomkraftmikroskopi. J. Kolloid Grensesnitt Sci. 278, 53–62.
PubMed Abstract/Google Scholar
Liang, X., Mao, G., Og Ng, K. Y. (2005). Effekt AV kjedelengder AV PEO-PPO-PEO på liten unilamellar liposommorfologi og stabilitet: EN AFM-undersøkelse. J. Kolloid Grensesnitt Sci. 285, 360–372. doi: 10.1016/j. jcis.2004.11.042
PubMed Abstract | CrossRef Full Text | Google Scholar
Liang, X., Mao, G., Og Simon Ng, K. Y. (2004b). Sondering små unilamellar EggPC vesikler på glimmer overflaten av atomic force mikroskopi. Kolloider Surfe. B Biointerfaces 34, 41-51.
PubMed Abstract/Google Scholar
Mao, G., Liang, X., Og Ng, K. Y. S. (2004). Encyclopedia Of Nanovitenskap Og Nanoteknologi. New York: Marcel Dekker.
Google Scholar
Mastrobattista, E., Koning, G. A., Og Storm, G. (1999). Immunoliposomer for målrettet levering av antitumormedikamenter. Adv. Drug Deliv. Åp 40, 103-127. doi: 10.1016 / S0169-409x (99)00043-5
Kryssref Fulltekst/Google Scholar
Mertins, O., Og Dimova, R. (2013). Innsikt om samspillet mellom chitosan og fosfolipid vesikler. Del II: membranstivning og poredannelse. Langmuir 29, 14552-14559. doi: 10.1021 / la4032199
PubMed Abstract | CrossRef Full Text / Google Scholar
Metselaar, J. M., Og Storm, G. (2005). Liposomer i behandlingen av inflammatoriske lidelser. Ekspert Opin. Narkotika Deliv. 2, 465–476. doi: 10.1517/17425247.2.3.465
PubMed Abstrakt | CrossRef Fulltekst / Google Scholar
Mohammed, A. R., Weston, N., Coombes, A. G., Fitzgerald, M., Og Perrie, Y. (2004). Liposomformulering av dårlig vannløselige legemidler: optimalisering av legemiddelbelastning og ESEM-analyse av stabilitet. Int. J. Pharm. 285, 23–34. doi: 10.1016 / j. ijpharm.2004.07.010
PubMed Abstract | CrossRef Full Text/Google Scholar
Moutardier, V., Tosini, F., Vlieghe, P., Cara, L., Delpero, J. R., Og Clerc, T. (2003). Kolloidale anticancer narkotika biotilgjengelighet i oral administrasjon modeller. Int. J. Pharm. 260, 23–38. doi: 10.1016 / S0378-5173(03)00231-x
PubMed Abstract | CrossRef Full Text/Google Scholar
Murphy, D. B., Og Davidson, M. W. (2012a). Konfokal Laserskanning Mikroskopi. Grunnleggende Om Lysmikroskopi og Elektronisk Bildebehandling, 2. Edn. Hoboken ,NJ: John Wiley & Sønner, 265-305. doi: 10.1002/9781118382905.ch13
CrossRef Full Text/Google Scholar
Murphy, D. B., Og Davidson, M. W. (2012b). Fluorescensmikroskopi. Grunnleggende Om Lysmikroskopi og Elektronisk Bildebehandling. Weinheim: John Wiley & Sønner, 199-231. doi: 10.1002/9781118382905.ch11
CrossRef Full Text/Google Scholar
Murphy, D. B., Og Davidson, M. W. (2012c). Grunnleggende Om Lysmikroskopi og Elektronisk Bildebehandling. Hoboken, NJ: John Wiley & Sønner, 1-19. doi: 10.1002 / 9781118382905
CrossRef Full Text / Google Scholar
Murphy, D. B., Og Davidson, M. W. (2012d). Polarisering Mikroskopi. Grunnleggende Om Lysmikroskopi og Elektronisk Bildebehandling. Hoboken, NEW JERSEY: John Wiley & Sønner, 153-171. doi: 10.1002 / 9781118382905. ch9
CrossRef Full Text/Google Scholar
Muscariello, L., Rosso, F., Marino, G., Giordano, A., Barbarisi, m., Cafiero, G., Et al. (2005). En kritisk oversikt OVER ESEM-applikasjoner i det biologiske feltet. J. Cell. Physiol. 205, 328–334. doi: 10.1002 / jcp.20444
PubMed Abstract | CrossRef Full Text/Google Scholar
Nallamothu, R., Wood, G. C., Pattillo, C. B., Scott, R. C., Kiani, M. F., Moore, B. M., et al. (2006). Et tumorvaskulatur målrettet liposom leveringssystem for combretastatin A4: design, karakterisering og in vitro evaluering. Aaps PharmSciTech 7: E32. doi: 10.1208 / pt070232
PubMed Abstract | CrossRef Full Text / Google Scholar
Nirale, Nm, Vidhate, Rd og Nagarsenker, Ms (2009). Flutikasonpropionat liposomer for lungelevering. Indisk J. Pharm. Sci. 71, 709–711.
Google Scholar
Orlova, E. V., Sherman, Mb, Chiu, W., Mowri, H., Smith, L. C., Og Gotto, A. M. Jr. (1999). Three-dimensional structure of low density lipoproteins by electron cryomicroscopy. Proc. Natl. Acad. Sci. U.S.A. 96, 8420–8425. doi: 10.1073/pnas.96.15.8420
CrossRef Full Text | Google Scholar
Ruozi, B., Belletti, D., Tombesi, A., Tosi, G., Bondioli, L., Forni, F., et al. (2011). AFM, ESEM, TEM, and CLSM in liposomal characterization: a comparative study. Int. J. Nanomedicine 6, 557–563. doi: 10.2147/IJN.S14615
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruozi, B., Tosi, G., Forni, F., Fresta, M., Og Vandelli, M. A. (2005). Atomic force mikroskopi og foton korrelasjonsspektroskopi: to teknikker for rask karakterisering av liposomer. Eur. J. Pharm. Sci. 25, 81–89. doi: 10.1016 / j.ejps.2005.01.020
PubMed Abstract | CrossRef Full Text/Google Scholar
Ruozi, B., Tosi, G., Leo, E., Og Vandelli, Ma (2007). Anvendelse av atomkraftmikroskopi for å karakterisere liposomer som narkotika-og genbærere. Talanta 73, 12-22. doi: 10.1016 / j.talanta.2007.03.031
PubMed Abstract | CrossRef Full Text/Google Scholar
Ruozi, B., Tosi, G., Tonelli, M., Bondioli, L., Mucci, A., Forni, F., Et al. (2009). AFM fase avbildning av myke hydratiserte prøver: et allsidig verktøy for å fullføre kjemisk-fysisk studie av liposomer. J. Liposom Res. 19, 59-67. doi: 10.1080/08982100802584071
PubMed Abstract / CrossRef Full Text / Google Scholar
Sawant, Rr, Og Torchilin, Vp (2012). Utfordringer i utviklingen av målrettede liposomale terapier. AAPS J. 14, 303-315. doi: 10.1208 / s12248-012-9330-0
PubMed Abstract | CrossRef Full Text/Google Scholar
Senior, Jh (1987). Skjebne og oppførsel av liposomer in vivo: en gjennomgang av kontrollerende faktorer. Crit. Pastor Ther. Drug Carrier Syst. 3, 123–193.
PubMed Abstract/Google Scholar
Sercombe, L., Veerati, T., Moheimani, F., Wu, S. Y., Sood, A. K., Og Hua, S. (2015). Fremskritt og utfordringer med liposomassistert legemiddellevering. Front. Pharmacol. 6:286. doi: 10.3389 / fphar.2015.00286
CrossRef Full Text | Google Scholar
Severs, N. J. (2007). Freeze-fracture electron microscopy. Nat. Protoc. 2, 547–576. doi: 10.1038/nprot.2007.55
PubMed Abstract | CrossRef Full Text | Google Scholar
Sitterberg, J., Ozcetin, A., Ehrhardt, C., and Bakowsky, U. (2010). Utilising atomic force microscopy for the characterisation of nanoscale drug delivery systems. Eur. J. Pharm. Biopharm. 74, 2–13. doi: 10.1016/j.ejpb.2009.09.005
PubMed Abstract | CrossRef Full Text/Google Scholar
Torchilin, V. P. (1994). Immunoliposomer Og Pegylerte immunoliposomer: mulig bruk for målrettet levering av bildebehandlingsmidler. Immunmetoder 4, 244-258. doi: 10.1006 / immu.1994.1027
PubMed Abstract | CrossRef Full Text/Google Scholar
Van Antwerpen, R., Og Gilkey, J. C. (1994). Kryo-elektronmikroskopi avslører humant lipoproteinunderstruktur med lav tetthet. J. Lipid Res. 35, 2223-2231.
PubMed Abstract | Google Scholar
Wang, X., Song, Y., Su, Y., Tian, Q., Li, B., Quan, J., et al. (2015). Are PEGylated liposomes better than conventional liposomes? A special case for vincristine. Drug Deliv. 29, 1–9. doi: 10.3109/10717544.2015.1027015
PubMed Abstract | CrossRef Full Text | Google Scholar
Weisman, S., Hirsch-Lerner, D., Barenholz, Y., and Talmon, Y. (2004). Nanostructure of cationic lipid-oligonucleotide complexes. Biophys. J. 87, 609–614. doi: 10.1529/biophysj.103.033480
PubMed Abstract / CrossRef Full Text / Google Scholar
Willis, M., Og Forssen, E. (1998). Ligand-målrettede liposomer. Adv. Drug Deliv. Åp 29, 249-271. doi: 10.1016 / S0169-409x(97)00083-5
CrossRef Full Text | Google Scholar
Zununi Vahed, S., Salehi, R., Davaran, S. og Sharifi, S. (2017). Liposom-baserte narkotika co-levering systemer i kreftceller. Bill. Sci. Eng. C Mater. Biol. Appl. 71, 1327–1341. doi: 10.1016 / j.msek.2016.11.073
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply