Halobetasol Propionate Salve
Doseringsform: salve
Medisinsk anmeldt Av Drugs.com. sist oppdatert 1.Mars 2020.
- Oversikt
- Bivirkninger
- Dosering
- Profesjonell
- Interaksjoner
- Mer
Halobetasol Propionat Salve, 0,05% inneholder halobetasol propionat, et syntetisk kortikosteroid for aktuell dermatologisk bruk. Kortikosteroider utgjør en klasse av primært syntetiske steroider som brukes lokalt som et antiinflammatorisk og antipruritisk middel.
kjemisk halobetasolpropionat er 21-klor-6α, 9-difluoro-11β, 17-dihydroksy-16β-metylpregna-1, 4-dien-3-20-dion, 17-propionat, C25H31ClF2O5. Den har følgende strukturformel:
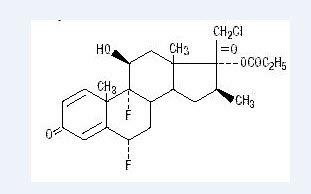
Halobetasolpropionat har molekylvekten på 485. Det er et hvitt krystallinsk pulver uoppløselig i vann.
Hvert gram Halobetasol Propionat Salve inneholder 0.5 mg/g halobetasolpropionat i en base av aluminiumstearat, bivoks, pentaerytritolkokoat, petrolatum, propylenglykol, sorbitansesquioleat og stearylsitrat.
Halobetasol Propionat Salve-Klinisk Farmakologi
som andre topikale kortikosteroider har halobetasolpropionat antiinflammatoriske, antipruritiske og vasokonstriktive tiltak. Mekanismen for den antiinflammatoriske aktiviteten til de aktuelle kortikosteroider er generelt uklar. Kortikosteroider antas imidlertid å virke ved induksjon av fosfolipase a2-hemmende proteiner, kollektivt kalt lipokortiner. Det er postulert at disse proteinene kontrollerer biosyntesen av potente mediatorer av betennelse som prostaglandiner og leukotriener ved å hemme frigjøringen av deres felles forløper arakidonsyre. Arakidonsyre frigjøres fra membranfosfolipider av fosfolipase A2.
Farmakokinetikk
graden av perkutan absorpsjon av topikale kortikosteroider bestemmes av mange faktorer, inkludert kjøretøyet og integriteten til epidermal barrieren. Okklusive dressinger med hydrokortison i opptil 24 timer har ikke vist seg å øke penetrasjonen, men okklusjon av hydrokortison i 96 timer øker penetrasjonen markant. Topikale kortikosteroider kan absorberes fra normal intakt hud. Inflammasjon og / eller andre sykdomsprosesser i huden kan øke perkutan absorpsjon.
Studier på Mennesker og dyr indikerer at mindre enn 6% av den påførte dosen av halobetasolpropionat kommer inn i sirkulasjonen innen 96 timer etter lokal administrasjon Av Halobetasolpropionatsalven.
Studier utført Med Halobetasol Propionat Salve indikerer at det er i det superhøye spekteret av potens sammenlignet med andre aktuelle kortikosteroider.
Indikasjoner og Bruk For Halobetasol Propionat Salve
Halobetasol Propionat Salve er en super-høy potens kortikosteroid indisert for lindring av inflammatoriske og pruritiske manifestasjoner av kortikosteroid-responsive dermatoser. Behandling utover to påfølgende uker anbefales ikke, og den totale dosen bør ikke overstige 50 g / uke på grunn av potensialet for stoffet å undertrykke hypothalamus-hypofyse-binyre (HPA) aksen. Bruk hos barn under 12 år anbefales ikke.
som med andre svært aktive kortikosteroider, bør behandlingen seponeres når kontroll er oppnådd. Hvis ingen forbedring er sett innen 2 uker, kan revurdering av diagnosen være nødvendig.
Kontraindikasjoner
Halobetasol Propionat Salve er kontraindisert hos pasienter med overfølsomhet overfor noen av komponentene i preparatet.
Forsiktighetsregler
Generelt
Systemisk absorpsjon av topikale kortikosteroider kan gi reversibel undertrykkelse av hypothalamus-hypofyse-binyre (HPA) akse med potensial for glukokortikosteroidinsuffisiens etter seponering av behandlingen. Manifestasjoner Av Cushings syndrom, hyperglykemi og glukosuri kan også produseres hos noen pasienter ved systemisk absorpsjon av topikale kortikosteroider under behandling.
Pasienter som påfører et topisk steroid på et stort overflateareal eller på områder under okklusjon bør evalueres periodisk for tegn PÅ hpa-aksesuppresjon. DETTE kan gjøres VED HJELP AV ACTH stimulering, am plasma kortisol, og urin fri-kortisol tester. Pasienter som får superpotente kortikosteroider bør ikke behandles i mer enn 2 uker om gangen, og kun små områder bør behandles til enhver tid på grunn av økt risiko for hpa-suppresjon.
Halobetasol Propionat Salve produsert hpa akse undertrykkelse når det brukes i delte doser på 7 gram per dag i en uke hos pasienter med psoriasis. Disse effektene var reversible ved seponering av behandlingen.
hvis hpa-aksesuppresjon er notert, bør man forsøke å trekke ut legemidlet, redusere hyppigheten av påføring eller erstatte et mindre potent kortikosteroid. Gjenoppretting AV hpa-aksefunksjonen er vanligvis rask ved seponering av topikale kortikosteroider. I sjeldne tilfeller kan tegn og symptomer på glukokortikosteroidinsuffisiens forekomme som krever supplerende systemiske kortikosteroider. For informasjon om systemisk tilskudd, se preparatomtale for disse produktene.
Pediatriske pasienter kan være mer utsatt for systemisk toksisitet fra tilsvarende doser på grunn av deres større hudoverflate til kroppsmasseforhold (SE FORHOLDSREGLER: Pediatrisk Bruk).
Hvis irritasjon oppstår, skal Halobetasolpropionatsalve seponeres og egnet behandling igangsettes. Allergisk kontaktdermatitt med kortikosteroider er vanligvis diagnostisert ved å observere manglende helbredelse i stedet for å merke seg en klinisk forverring som med de fleste aktuelle produkter som ikke inneholder kortikosteroider. En slik observasjon bør bekreftes med passende diagnostisk patch testing.
hvis samtidig hudinfeksjon er tilstede eller utvikler seg, bør det brukes et egnet antifungal eller antibakterielt middel. Hvis en gunstig respons ikke oppstår raskt, bør Bruk Av Halobetasol Propionat Salve seponeres til infeksjonen er tilstrekkelig kontrollert.
Halobetasol Propionat Salve Skal ikke brukes til behandling av rosacea eller perioral dermatitt, og den skal ikke brukes på ansikt, lyske eller i axillene.
Informasjon til Pasienter
Pasienter som bruker topikale kortikosteroider bør få følgende informasjon og instruksjoner:
- medisinen skal brukes som anvist av legen. Det er kun til ekstern bruk. Unngå kontakt med øynene.
- medisinen bør ikke brukes til noen annen lidelse enn den som den ble foreskrevet for.
- det behandlede hudområdet skal ikke bandasjeres, ellers dekkes eller pakkes inn for å være okklusivt, med mindre det er instruert av legen.
- Pasienter bør informere legen om tegn på lokale bivirkninger.\
Laboratorietester
følgende tester kan være nyttige for å evaluere pasienter for hpa-akseundertrykkelse: ACTH-stimuleringstest; am plasma kortisol test; Urinfri kortisol test.
Karsinogenese, Mutagenese, Nedsatt Fertilitet
Langtidsstudier på dyr er ikke utført for å vurdere halobetasolpropionats karsinogene potensial. Positive mutagenisitetseffekter ble observert i to gentoksisitetsanalyser. Halobetasolpropionat var positivt i En Mikronukleustest Fra Kinesisk hamster, og i en genmutasjonstest hos mus in vitro.
studier hos rotter etter oral administrasjon med dosenivåer opp til 50 mikrogram/kg/dag indikerte ingen nedsatt fertilitet eller generell reproduksjonsevne.
i andre gentoksisitetstester ble halobetasolpropionat ikke funnet å være gentoksisk i ames / Salmonella-analysen, i søsterkromatid-utvekslingstesten i Somatiske celler Fra Den Kinesiske hamsteren, i kromosomavviksstudier av germinale og somatiske celler fra gnagere, og i en pattedyrspottest for å bestemme punktmutasjoner.
Graviditet
Teratogene effekter: Graviditetskategori C
Kortikosteroider har vist seg å være teratogene hos laboratoriedyr når de administreres systemisk ved relativt lave dosenivåer. Noen kortikosteroider har vist seg å være teratogene etter hudpåføring hos laboratoriedyr.Halobetasolpropionat er vist å være teratogent hos SPF-rotter og chinchilla-kaniner når det gis systemisk under drektighetsdoser på 0,04 til 0,1 mg / kg hos rotter og 0,01 mg / kg hos kaniner. Disse dosene er omtrent 13, 33 og 3 ganger, henholdsvis den humane topikale dosen Av Halobetasol Propionat Salve. Halobetasolpropionat var embryotoksisk hos kaniner, men ikke hos rotter.
Ganespalte ble observert hos både rotter og kaniner. Omphalocele ble sett hos rotter, men ikke hos kaniner.
det foreligger ikke tilstrekkelige og velkontrollerte studier av halobetasolpropionats teratogene potensial hos gravide kvinner. Halobetasol Propionat Salve Skal bare brukes under graviditet dersom den potensielle fordelen begrunner den potensielle risikoen for fosteret.
Ammende Mødre
systemisk administrerte kortikosteroider forekommer i morsmelk og kan undertrykke vekst, forstyrre endogen kortikosteroidproduksjon eller forårsake andre uheldige effekter. Det er ikke kjent om lokal administrering av kortikosteroider kan resultere i tilstrekkelig systemisk absorpsjon til å gi detekterbare mengder i morsmelk. Fordi mange legemidler utskilles i morsmelk, bør forsiktighet utvises når Halobetasol Propionat Salve administreres til en sykepleier.
Pediatrisk Bruk
Sikkerhet Og effekt Av Halobetasol Propionat Salve hos pediatriske pasienter er ikke fastslått, og bruk hos pediatriske pasienter under 12 år anbefales ikke. På grunn av et høyere forhold mellom hudoverflate og kroppsmasse, har pediatriske pasienter større risiko enn voksne FOR hpa-aksesuppresjon og Cushings syndrom når de behandles med topikale kortikosteroider. De har derfor også større risiko for binyreinsuffisiens under eller etter seponering av behandlingen. Bivirkninger inkludert striae er rapportert ved upassende bruk av topikale kortikosteroider hos spedbarn og barn.
hpa-aksesuppresjon, Cushings syndrom, lineær vekstretardasjon, forsinket vektøkning og intrakraniell hypertensjon er rapportert hos barn som får topikale kortikosteroider. Manifestasjoner av binyreundertrykkelse hos barn inkluderer lave plasmakortisolnivåer og fravær av respons PÅ ACTH-stimulering. Manifestasjoner av intrakranial hypertensjon inkluderer bulging fontaneller, hodepine og bilateral papilledema.
Geriatrisk Bruk
av 850 pasienter behandlet Med Halobetasolpropionatsalve i kliniske studier var 21% 61 år og over og 6% 71 år og over. Ingen generelle forskjeller i sikkerhet eller effekt ble observert mellom disse pasientene og yngre pasienter, og annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter, men større følsomhet hos noen eldre individer kan ikke utelukkes.
Bivirkninger
i kontrollerte kliniske studier inkluderte de hyppigste bivirkningene rapportert For Halobetasolpropionatsalve stikking eller brenning hos 1,6% av pasientene. Mindre hyppig rapporterte bivirkninger var pustulasjon, erytem, hudatrofi, leukoderma, akne, kløe, sekundær infeksjon, telangiektasi, urtikaria, tørr hud, miliaria, parestesi og utslett.
følgende tilleggsbivirkninger er sjelden rapportert med topikale kortikosteroider, og de kan forekomme oftere med høypotente kortikosteroider, slik Som Halobetasol Propionat Salve. Disse reaksjonene er listet opp i tilnærmet synkende rekkefølge: follikulitt, hypertrikose, akneiform utslett, hypopigmentering, perioral dermatitt, allergisk kontaktdermatitt, sekundær infeksjon, striae og miliaria.
for å rapportere MISTENKTE BIVIRKNINGER, kontakt Teligent Pharma, Inc. på 1-856-697-1441, ELLER FDA på 1-800-FDA-1088 eller www.fda.gov / medwatch.
Overdosering
Topisk påført, Halobetasol Propionat Salve kan absorberes i tilstrekkelige mengder til å produsere systemiske effekter (se FORHOLDSREGLER)h
Halobetasol Propionat Salve Dosering og Administrasjon
Påfør et tynt lag Av Halobetasol Propionat Salve til den berørte huden en eller to ganger daglig, som anvist av legen din, Og gni forsiktig og helt.
Halobetasol Propionat Salve er en super – høy styrke aktuell kortikosteroid; derfor bør behandlingen begrenses til to uker, og mengder større enn 50 g / wk bør ikke brukes. Som med andre kortikosteroider, bør behandlingen seponeres når kontroll oppnås. Hvis ingen forbedring ses innen 2 uker, kan det være nødvendig å revurdere diagnosen.
Halobetasol Propionat Salve skal ikke brukes med okklusive dressinger.
Hvordan Leveres Halobetasol Propionat Salve
Halobetasol Propionat Salve, 0,05% leveres i følgende rørstørrelser:
50 g (NDC 63739-998-67)
LAGRING
Lagre Halobetasol Propionat Salve mellom 15°C og 30°c (59°F og 86°F).
Produsert av:
Teligent Pharma, Inc.
Buena, NJ 08310
Distribuert av:
McKesson Corporation
dba Sky Emballasje
4971 Southridge Blvd., Suite 101
Memphis, TN 38141
PI-073-00
C101430 Rev 02/2020
PAKKEETIKETT.HOVEDSKJERM 50 gram Kartong
NDC 63739-998-67
Halobetasol Propionate
Salve, 0,05%
Kun til utvortes bruk.
Ikke til bruk i øynene.
Netto Wt. 50 grams
Rx Only

| HALOBETASOL PROPIONATE Halobetasol Propionate Ointment |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – McKesson Corporation (140529962)
Registrant – Teligent Pharma, Inc. (011036910)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Teligent Pharma, Inc. | 011036910 | manufacture(63739-998) | |
Frequently asked questions
- Halobetasol vs. clobetasol – how do they compare?
- Kan dette brukes til poison ivy?
- Kan den brukes i hodebunnen?
Mer om halobetasol aktuell
- Bivirkninger
- Under Graviditet eller Amming
- Doseringsinformasjon
- Legemiddelinteraksjoner
- Sammenlign Alternativer
- Priser& Kuponger
- 25 Anmeldelser
- Legemiddelklasse: topical steroids
Consumer resources
- Patient Information
- Halobetasol Topical application (Advanced Reading)
Professional resources
- Prescribing Information
- Halobetasol (FDA)
- Halobetasol Cream (FDA)
- Halobetasol Foam (FDA)
Other brands Ultravate, Lexette, Bryhali, Halonate
Related treatment guides
- Plaque Psoriasis
- Eczema
- Psoriasis
- Atopic Dermatitis
- Granuloma Annulare
- Dermatitis
Medical Disclaimer
Leave a Reply