Organisk Kjemi II

Eksperimentelt observeres det imidlertid at Det er en signifikant barriere for rotasjon om c2-C3-bindingen, og at hele molekylet er plan. I Tillegg er C2-C3-bindingen 148 pm lang, kortere enn en typisk karbon-karbon enkeltbinding (ca 154 pm), men lengre enn en typisk dobbeltbinding (ca 134 pm).Molekylær orbitalteori står for disse observasjonene med begrepet delokaliserte pi-bindinger. I dette bildet kombinerer de fire 2p-atomorbitalene matematisk for å danne fire pi-molekylorbitaler med økende energi. To av disse-bonding pi orbitaler – er lavere i energi enn p atomorbitaler som de er dannet, mens to-antibonding pi * orbitaler – er høyere i energi.

den laveste energien molekylorbital, pi1, har bare konstruktiv interaksjon og null noder. Høyere i energi, men fortsatt lavere enn de isolerte p orbitaler, pi2 orbital har en node, men to konstruktive interaksjoner – dermed er det fortsatt en binding orbital samlet. Ser på de to antibonding orbitaler, pi3* har to noder og en konstruktiv interaksjon, mens pi4 * har tre noder og null konstruktive interaksjoner. Ved aufbau-prinsippet plasseres de fire elektronene fra de isolerte 2pz-atomorbitalene i bindingene pi1 og pi2 MO. Fordi pi1 inkluderer konstruktiv interaksjon Mellom C2 Og C3, er det en grad i 1,3-butadienmolekylet av pi-bindingsinteraksjon mellom disse to karbonene, som står for sin kortere lengde og barrieren for rotasjon. Valensbindingsbildet av 1,3-butadien viser de to pi-bindingene som isolert fra hverandre, med hvert par pi-elektroner ‘fast’ i sin egen pi-binding. Molekylorbitalteorien forutsier imidlertid (nøyaktig) at de fire pi-elektronene til en viss grad er delokalisert, eller ‘spredt ut’, over hele pi-systemet.

1,3-butadien er det enkleste eksempelet på et system med konjugerte pi-bindinger. For å bli vurdert konjugert, må to eller flere pi-bindinger separeres med bare en enkeltbinding – med andre ord kan det ikke være et mellomliggende sp3-hybridisert karbon, fordi dette vil bryte opp det overlappende systemet av parallelle p-orbitaler. I forbindelsen nedenfor er for Eksempel c1-C2 og c3-C4 dobbeltbindinger konjugert, Mens c6-C7 dobbeltbindingen isoleres fra de andre to pi-bindingene ved sp3-hybridisert C5.

et veldig viktig konsept å huske på er at det er en iboende termodynamisk stabilitet forbundet med konjugering. Denne stabiliteten kan måles eksperimentelt ved å sammenligne varmen av hydrogenering av to forskjellige diener. (Hydrogenering er en reaksjonstype som vi vil lære mye mer om i kapittel 15: i hovedsak er det prosessen med å legge til et hydrogenmolekyl-to protoner og to elektroner – til en p-binding). Når de to konjugerte dobbeltbindingene av 1,3-pentadien er ‘hydrogenert’ for å produsere pentan, frigjøres omtrent 225 kJ per mol pentan dannet. 250 kJ / mol frigjøres når de to isolerte dobbeltbindingene i 1,4-pentadien hydrogeneres, og danner også pentan.
dannelsen av syntetiske polymerer fra diener som 1,3-butadien og isopren er omtalt I Avsnitt 18.5. Syntetiske polymerer er store molekyler som består av mindre repeterende enheter. Du er sannsynligvis noe kjent med en rekke av disse polymerene; for eksempel polyetylen, polypropylen, polystyren og poly(vinylklorid).

Figur 13.6: energidiagram for hydrogenering av 1,3-butadien (ikke å skalere).
da hydrogeneringen av 1,3-butadien frigjør mindre enn den forventede mengden energi, må energiinnholdet i 1,3-butadien være lavere enn vi kunne ha forventet. Med andre ord er 1,3-butadien mer stabil enn formelen antyder.
den konjugerte dien er lavere i energi: med andre ord er den mer stabil. Generelt er konjugerte pi-bindinger mer stabile enn isolerte pi-bindinger.Her er et energidiagram som sammenligner ulike typer bindinger med deres hydrogeneringsvarmer (per mol) for å vise relativ stabilitet for hvert molekyl (1 kcal = 4,18 kJ). (Jo lavere varmen av hydrogenering (per pi-binding) , jo mer stabil er strukturen.)
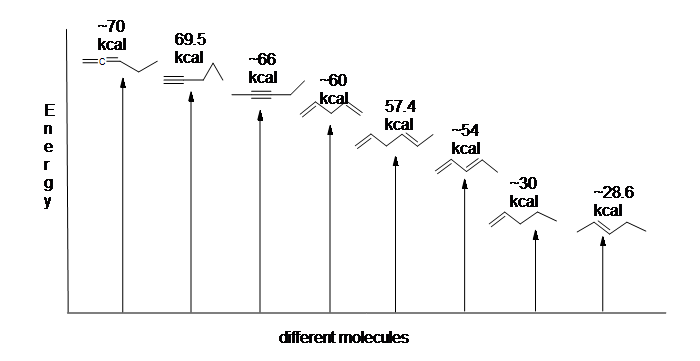
stabiliseringen av diener ved konjugering er mindre dramatisk enn den aromatiske stabiliseringen av benzen. Likevel kan lignende resonans-og molekylorbitale beskrivelser av konjugasjon skrives.
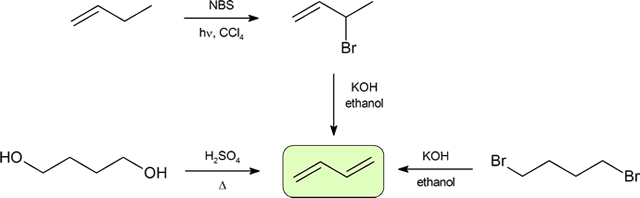
Syntese av diener
de to hyppigste måtene å syntetisere konjugerte diener er dehydrering av alkoholer og dehydrohalogenering av organohalider, som ble introdusert i fremstillingen av alkener (Avsnitt 9.9). Følgende skjema illustrerer noen av rutene for å forberede en konjugert dien.
Konjugerte pi-systemer kan involvere oksygen-og nitrogenatomer så vel som karbon. I metabolismen av fettmolekyler involverer noen av nøkkelreaksjonene alkener som er konjugert til karbonylgrupper.

mo-teorien er veldig nyttig for å forklare hvorfor organiske molekyler som inneholder utvidede systemer av konjugerte pi-bindinger ofte har særegne farger. betakaroten, forbindelsen som er ansvarlig for gulrotens oransje farge, har et utvidet system med 11 konjugerte pi-bindinger.

Øvelser
Øvelse 2.9: Identifiser alle konjugerte og isolerte dobbeltbindinger i strukturene nedenfor. For hvert konjugert pi-system angir du antall overlappende p-orbitaler, og hvor mange pi-elektroner deles mellom dem.

Øvelse 2.10: Identifiser alle isolerte og konjugerte pi-bindinger i lykopen, den rødfargede forbindelsen i tomater. Hvor mange pi-elektroner finnes i det konjugerte pi-systemet?
Leave a Reply