Viral Latency: Ned, Men ikke ut
når du forestiller deg at virus gjemmer seg fra immunsystemet ditt, kan du tenke på herpes simplex-viruset, som er ansvarlig for forkjølelsessår og kjønnsherpes, eller varicella-zoster-viruset, som forårsaker helvetesild. Disse virusene kan vedvare i flere tiår i en dvalelignende tilstand kjent som latens og unngå deteksjon av vårt immunsystem (Kennedy et al., 2015). Latente virus kan noen ganger vekke og begynne å replikere igjen, forårsaker symptomer og sprer infeksjon (Lieberman, 2016).
det humane immunsviktviruset (HIV) er på samme måte en mesterfluktartist. Det danner et latent reservoar tidlig i infeksjon, slik at viruset unngår immunsystemet og overlever på lang sikt. Personer som lever MED HIV ta daglige medisiner kjent som kombinasjon antiretroviral terapi (ELLER ART) for å hindre at viruset replikerer. ART er imidlertid ikke en kur, da DEN ikke retter seg mot virus som allerede er latente. Disse stoffene er derfor gitt for en persons levetid: å stoppe behandlingen, selv i noen uker, vil tillate latente virus å reaktivere og gjenopplive aktiv infeksjon. PERSONER MED HIV kan forvente å ha lange, sunne liv PÅ GRUNN AV ART, men latente virus vil alltid være til stede i kroppen.
Å Finne en kur mot HIV krever å kunne eliminere eller kontrollere det latente virale reservoaret. Imidlertid må noen viktige spørsmål fortsatt tas opp for å nå dette målet. Hvordan, når OG hvor ETABLERER HIV latens? Hva er størrelsen på latent reservoar, og den beste måten å måle den på? Hva utløser latente virus for å reaktivere? Nå, I eLife, Miles Davenport, Brandon Keele og kolleger Fra University Of New South Wales og Frederick National Laboratory For Cancer Research – inkludert Mykola Pinkevych som første forfatter – rapporterer når latent reservoar er etablert i EN ikke-menneskelig primatmodell AV HIV og hvor mye av reservoaret kan reaktiveres (Pinkevych et al ., 2019).i denne studien infiserte teamet rhesusmakaker med simian immunodeficiency virus (SIV), et forløpervirus som er endemisk hos Afrikanske aper og genetisk lik HIV (Williams Og Burdo, 2009). PÅ et tidspunkt i løpet AV det 20. århundre hoppet SIV fra ikke-menneskelige primater til mennesker; denne overføringshendelsen, kombinert med rask utvikling, tillot viruset å spre seg effektivt i mennesker og for å skape den pågående HIV-pandemien (Keele et al., 2006).
Pinkevych et al. begynte med å infisere rhesusmakaker med en konstruert SIV som inneholder over 10.000 unike randomiserte sekvenser AV DNA; når sekvensert, tillater disse strekkodene individuelle virus å bli identifisert (Fennessey et al., 2017). Apene ble deretter behandlet med antiretroviral behandling 4, 10 eller 27 dager etter infeksjon. Disse intervallene simulerer akutt (4 dager), tidlig (10 dager) eller sen intervensjon (27 dager) MED ART hos mennesker. Legemidlene ble gitt i omtrent et år, og viruset ble fullstendig undertrykt hos alle dyr. Behandlingen ble deretter stoppet og det latente viruset fikk lov til å reaktivere. Ved hjelp av genetisk sekvensering og matematisk modellering bestemte teamet størrelsen på det latente reservoaret TIL SIV og hvordan DET ville reaktivere.
hos apene blokkerte behandlingsstart fire dager etter infeksjon ikke dannelsen av det latente reservoaret, men reduserte størrelsen med omtrent 100 ganger sammenlignet med SENERE ART-initiering. På samme måte har folk som begynner ART innen dager ETTER å skaffe SEG HIV, et ekstremt lite reservoar sammenlignet med de som starter behandling senere (Luzuriaga et al., 2015; Henrich et al., 2017). Til tross for disse store forskjellene i total reservoarstørrelse, når ART ble stoppet, reaktiverte de latente virusene med lignende hastigheter hos akutte, tidlige og senbehandlede dyr (Figur 1). Pinkevych et al. derfor konkluderer med at flertallet av virus som har potensial til å reaktivere, etablerer latens tidlig etter infeksjon.
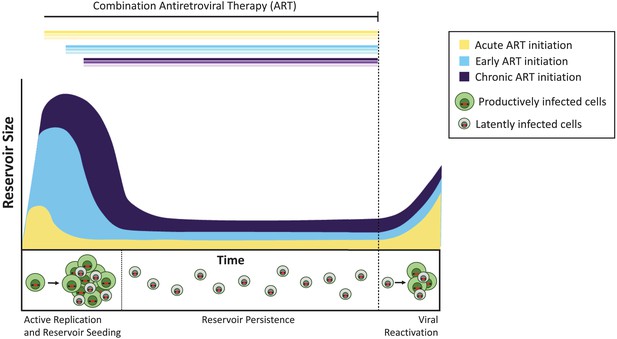
tidspunktet for antiretroviral behandling påvirker størrelsen på det latente reservoaret.
uten behandling, celler infisert med aktivt replikerende virus (produktivt infiserte celler, vist i grønt) skape smittsomme virus. Et mindretall av infiserte celler inneholder virus som kan vedvare på ubestemt tid som et latent reservoar( latent infiserte celler, vist i grått), og disse virusene kan potensielt reaktiveres på et senere tidspunkt. Behandling administrert i den akutte infeksjonsfasen (dvs. i løpet av dager eller uker etter primær infeksjon, gul kurve) resulterer i et mindre latent reservoar enn når behandling initieres tidlig (innen seks måneder etter infeksjon, lyseblå) eller ved kronisk infeksjon (mer enn 6 måneder siden infeksjon, fiolett). Hvis behandlingen stanses (stiplet linje), reaktiveres viruset fra disse reservoarene på samme nivå som å tenne aktiv infeksjon og så det latente reservoaret på nytt.
for å undersøke hvorfor tidspunktet for behandlingen ikke syntes å påvirke reaktiveringshastigheten, målte teamet nivået av genetiske mutasjoner i latente virus. Hvis virus akkumulerer mer skadelige mutasjoner jo lenger de aktivt replikerer i kroppen, vil dette tyde på at dyr som mottar forsinket ART, kan bære en større andel latente virus som er defekte og ikke kan gjenoppvåke. Teamet fant imidlertid at flertallet av virus (mer enn 80%) var genetisk intakte på tvers av alle dyr, uavhengig av når behandlingen startet. DETTE er ganske annerledes enn HVA som skjer MED HIV-infeksjon hos mennesker, hvor de fleste latente virusene inneholder store genetiske mutasjoner og slettinger, og gir bare en liten brøkdel (mellom 2% og 11%) som er i stand til reaktivering (Ho et al., 2013; Bruner et al., 2019).En nylig studie, som evaluerte dynamikken TIL HIV-reservoaret hos mennesker på stabil ART, identifiserte en annen avvik mellom DENNE SIV-modellen og HIV-latens hos mennesker. Til tross for pågående ART, kan latent HIV noen GANGER spontant reaktivere og virusene blir detekterbare i blodet i en kort stund. Hos mennesker er disse virale ‘blips’ fylogenetisk knyttet til et viralt reservoar etablert ikke bare ved første infeksjon, men over år med ubehandlet infeksjon (Jones et al., 2018). Årsakene til disse forskjellene er ikke godt forstått og representerer viktige områder for pågående forskning.
Til tross for forskjeller mellom ikke-menneskelige primatmodeller og human HIV-infeksjon, Arbeidet Av Pinkevych et al. bekrefter at viral latens er etablert ekstremt tidlig etter infeksjon. Disse resultatene indikerer at antiretroviral behandling bør startes så snart som mulig for å kontrollere HIV-infeksjon og redusere latent reservoarstørrelse. Mye er fortsatt ukjent om HVORDAN HIV latens er etablert og opprettholdt, spesielt under behandling; MEN SIV modeller vil fortsatt være et viktig verktøy for å forstå hvordan å utrydde latent reservoaret.
Leave a Reply