7.2: chymotrypsine
Inleiding
chymotrypsine is een van de meest bestudeerde enzymen vanwege zijn tweefasige kinetiek: pre-steady-state en steady-state. De studie van deze twee kinetische toestanden geeft bewijs van het” pingpong ” mechanisme, de vorming van covalente complexen die tot covalente hydrolysereacties leiden, en de snelheid van de gekatalyseerde reacties. Synthese van chymotrypsine komt voornamelijk voor in de alvleesklier. In plaats van de actieve vorm, echter, wordt het geproduceerd als inactieve zymogen genoemd chymotrypsinogen om zijn protease activiteit te verhinderen van het verteren van de alvleesklier. Bij secretie in het lumen van de dunne darm, wordt het omgezet in zijn actieve vorm door een ander enzym genoemd trypsine. Deze afhankelijkheid van een ander enzym voor de activering van een protease is een veel voorkomende manier voor het lichaam om de vertering van organen en andere schadelijke enzymatische bijwerkingen te voorkomen.
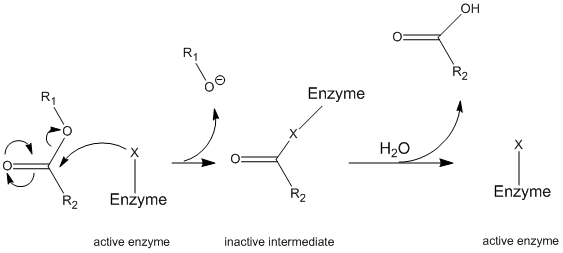
chymotrypsine werkt via een algemeen mechanisme dat bekend staat als het pingpongmechanisme (figuur \(\Paginindex{1}\)) waarbij het enzym reageert met een substraat om een enzymmedium te vormen. Dit tussenproduct heeft andere eigenschappen dan het aanvankelijke enzym, dus om de aanvankelijke enzymatische activiteit te regenereren, moet het met een secundair substraat reageren. Dit proces wordt hieronder geïllustreerd:

meer specifiek werkt chymotrypsine via een bepaald type pingpongmechanisme dat covalente hydrolyse wordt genoemd. Dit betekent dat het enzym eerst een covalente band met het doelsubstraat vormt, die het stabielere deel in oplossing verplaatsen. Dit enzym-substraatcomplex wordt het enzymmedium genoemd. De tussenpersoon reageert dan met water, dat het resterende deel van het aanvankelijke substraat verplaatst en het aanvankelijke enzym hervormt.
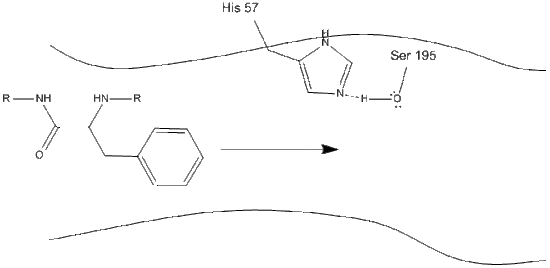
chymotrypsine is, net als de meeste enzymen, specifiek in de soorten substraten waarmee het reageert. Als protease, splitst het polypeptiden, en zijn inherente specificiteit staat het toe om slechts op de carboxy-terminal van aromatische residuen in te werken. Het is een enigszins ingewikkeld mechanisme, en kan het best worden uitgelegd in een reeks stappen.
1. Het doel gaat de actieve plaats van chymotrypsine in, en het wordt daar gehouden door hydrophobic interactie tussen blootgestelde apolaire groepen enzymresiduen en de apolaire aromatische zijketen van het substraat. Het is belangrijk om de waterstofbinding tussen de Schiff-stikstof op histidine-57 en de zuurstofzijketen van serine-195 op te merken.
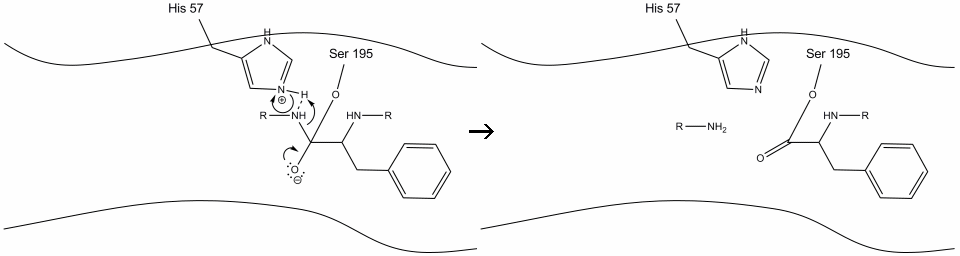
2. Geholpen door de histidine-serine waterstofbinding, voert de hydroxylgroep op serine-195 een nucleofiele aanval uit op de carbonylkoolstof van een Aromatisch aminozuur terwijl tegelijkertijd de hydroxylhydrogeen wordt overgebracht naar de histidine Schiff-stikstof. Deze aanval duwt de PI-carbonylelektronen op de carbonylzuurstof en vormt een kortlevend tussenproduct bestaande uit een C-eindkoolstof met vier enkelvoudige bindingen: een zuurstofanion, de beta-koolstof van het aromatische aminozuur, het n-eindpunt van het daaropvolgende aminozuur van het substraateiwit en de serine-195 zijketenszuurstof.
.gif?revision=1&size=bestfit&width=720&height=192)
3. Dit tussenproduct is van korte duur, aangezien de oxyanionelektronen de pi-band met het c-Eindpunt van het aromatische aminozuur hervormen. De band tussen het carboxy-eindpunt van het aromatische aminozuur en het n-eindpunt van het volgende residu wordt gesplitst, en zijn elektronen worden gebruikt om de waterstof van de geprotoneerde Schiff-stikstof op histidine-57 te extraheren. De bindingen tussen de carbonylkoolstof en de serine-195 zuurstof blijven in een esterconfiguratie. Dit wordt het acyl-enzym tussenproduct genoemd. De C-eindzijde van het polypeptide is nu vrij om van de actieve plaats van het enzym te scheiden.
4. De watermoleculen kunnen nu aan actieve plaats ingaan en binden door waterstofbindingen tussen de waterstofatomen van water en de histidine-57 schiffstikstof.
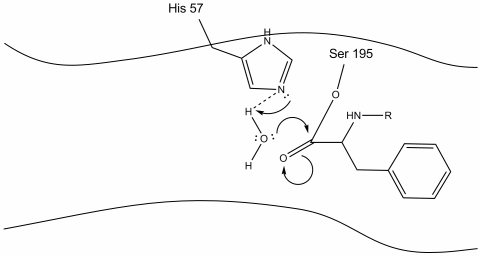
5. De waterzuurstof maakt nu een nucleofiele aanval op de carbonylkoolstof van het acyl-enzymmedium, waardoor de pi-elektronen van de carbonylkoolstof op de carbonylkoolstof worden geduwd, terwijl histidine-57 één proton uit water haalt. Dit vormt een andere quaternaire koolstof covalent gebonden met serine, een hydroxyl, een oxyanion, en het aromatische aminozuur. Het proton op de recent geprotoneerde histidine-57 is nu in staat om een waterstofbinding aan te maken met de serine zuurstof.
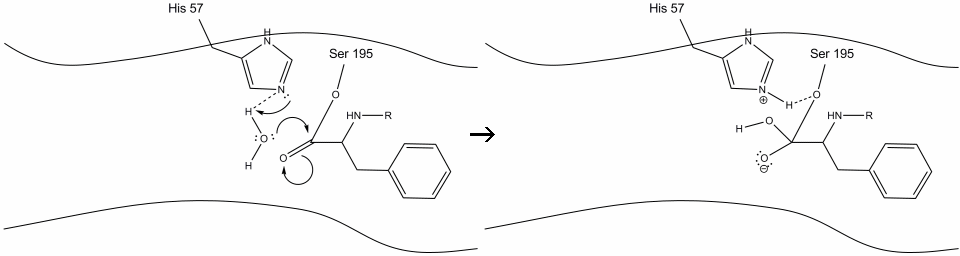
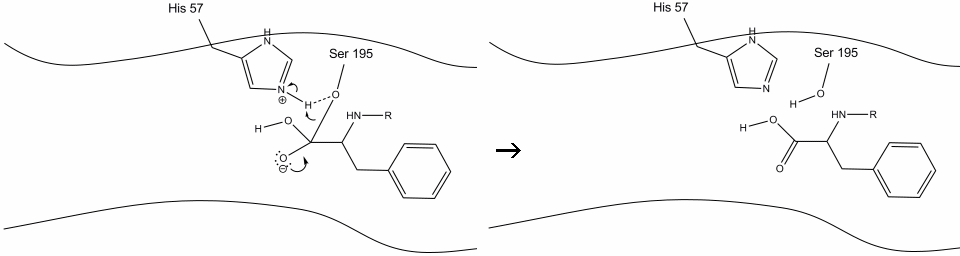
6. De oxyanion-elektronen vormen de carbonyl-pi-binding en splitsen de binding tussen de carbonylkoolstof en de serinehydroxyl. De elektronen in deze binding worden door de serine zuurstof gebruikt om de histidine Schiff stikstof te deprotoneren en het originele enzym te hervormen. Het substraat heeft geen affiniteit meer voor de actieve site, en het distantieert zich al snel van het complex.
Leave a Reply