Fosfofructokinase (PFK)
inhoud
- 1 Inleiding
- 2 rol in glycolyse
- 3 mechanisme en regulatie van Fosfofructokinase
- 4 Regulatie
- 5 conformationele veranderingen in een dimere eenheid van PFK
- 6 de belangrijkste conformationele veranderingen in een subeenheid van PFK.
- 7 Site-Directed mutagenese
- 8 ziekte
- 9 3D-structuren van PFK
Inleiding
Fosfofructokinase-1 (PFK-1) is een glycolytisch enzym dat de overdracht van een fosforylgroep katalyseert van naar opbrengst en . Zie Glycolyse Enzymen. Mg2+ is ook belangrijk in deze reactie (). Phosphofructokinase-2 (PFK-2) handelt op dezelfde substraten om ADP en op te leveren . . De PFK-reactie is sterk exergonisch (onomkeerbaar) onder fysiologische omstandigheden en vandaar is één van de tariefbepalende stappen van de glycolytische weg. In de meeste organismen/weefsels is PFK het belangrijkste fluxregulerende enzym van de glycolytische route; zijn activiteit wordt gecontroleerd door de concentraties van een ongewoon groot aantal metabolieten waaronder ATP, ADP, AMP, PEP en fructose-2,6-bisfosfaat.
is een tetrameer van identieke 320-residu-subeenheden. Het is een allosteric enzym dat wordt beschreven gebruikend het symmetriemodel van allosterism waarbij er een gecoördineerde overgang van zijn hoog-activiteitsstaat R naar zijn laag-activiteitsstaat T is. De Röntgenstructuren van zowel R als T-toestanden van het enzym zijn gemeld. De binding van één molecuul van zijn substraat F6P, dat met hoge affiniteit aan het enzym van de R-toestand bindt, maar met lage affiniteit aan het enzym van de T-toestand, veroorzaakt dat PFK de R-toestand opneemt, die op zijn beurt de bindingsaffiniteit van het enzym voor extra F6P (een homotroop effect) verhoogt. De activatoren, zoals ADP en AMP binden aan zogenaamde allosteric plaatsen, bindende plaatsen verschillend van de actieve plaats, waar zij eveneens de vorming van de staat R vergemakkelijken en vandaar het enzym activeren (een heterotroop effect; ADP, die een product van de PFK-reactie zijn, bindt ook aan de actieve plaats van het enzym). Evenzo, binden de inhibitors zoals PEP aan allosteric plaatsen (die in het geval van PFK de activerende allosteric plaats overlapt) waar zij de vorming van de T-staat bevorderen, waardoor het enzym wordt geremd.
twee van de actieve plaatsen van het enzym bevinden zich op het raakvlak van de actieve plaatsinterfaces in magenta met de substraten in cyaan. Twee meer actieve sites bevinden zich op de interface van subeenheden B (groen) en C (roze). Een close-up van subeenheid d (geel) toont aan dat de aminozuren van beide subeenheden a (lichtblauw) en D (geel) tot de band van F6P bijdragen. twee van allosteric plaatsen worden gevestigd bij de interface van en twee bij de interface van subeenheden C en D. opnieuw zijn de interfaces magenta met allosteric ligand in cyaan. Een close-up van de van subeenheid A toont bijdragen van beide subeenheden aan de binding van ADP. De conformationele veranderingen in het gaan tussen de R en T Staten van PFK worden hieronder geïllustreerd.
de atomaire Coördinaten voor R state PFK werden verkregen van 4pfk; die voor T state PFK werden verkregen van Philip Evans, MRC Laboratory of Molecular Biology, Cambridge, U. K. maar zijn nu beschikbaar als 6pfk.
rol in de glycolyse
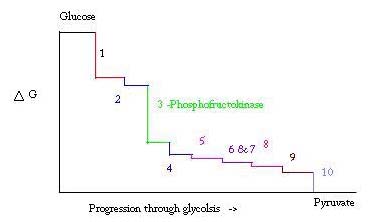
glycolyse is het proces voor het bereiden en afbreken van glucose om pyruvinezuur te maken, dat wordt gebruikt bij anaërobe ademhaling of als een van de startreagentia in de citroenzuurcyclus. Drie punten in het proces van glycolyse komen voor met een grote negatieve vrije energie en zijn daarom onomkeerbaar. Deze drie punten zijn hexokinase, fosfofructokinase, en pyruvaatkinase; van deze drie wordt PFK beschouwd als het belangrijkste regelgevend punt voor glycolyse in spier met een ΔG= -25,9 kJ/mol.
mechanisme en regulatie van Fosfofructokinase
Fosfofructokinase bindt zowel Mg2+-ATP als fructose-6-fosfaat (F6P) om fructose-1,6-bisfosfaat en Mg2+-ADP te maken. Hoewel het beeld met beide producten is niet bepaald, gebonden aan het enzym is geweest. Er zijn drie ligand bindingsplaatsen per subeenheid. Twee maken omhoog de actieve plaats, die F6P en ATP bindt, terwijl de derde een allosteric bandplaats is. Enkele voorgestelde residuen die betrokken zijn op de actieve plaats omvatten . PFK bestaat in twee conformationele toestanden, beide en die in evenwicht zijn. ATP bindt zowel actieve als allosteric plaatsen in beide conformations. Terwijl ATP de actieve plaats even goed bindt, bindt het bij voorkeur de allosteric plaats van de staat van T deze preferentiële band veroorzaakt een verschuiving van evenwicht van de twee staten, aan een grotere hoeveelheid staat van T , die de affiniteit voor F6P vermindert. bindt ook aan allosteric plaats om de verhouding van de staat van R phosphofructokinase te verhogen. Samen met ADP,AMP en F2, 6P remmen de regelgevende rol van ATP. De PFK Km voor ATP is .020mM en .
regulering
glycolyse is een essentieel metabolisch proces voor overleving. Daarom moet het in zijn activering en onderdrukking sterk worden geregeld. Drie punten in het proces van glycolyse komen voor met een grote negatieve vrije energie en zijn daarom onomkeerbaar. Deze drie punten zijn hexokinase, phosphofructokinase, en pyruvate kinase. Deze drie reacties zijn kandidaten om de belangrijkste punten van Regulatie te zijn vanwege hun hoge negatieve vrije energieën. Van de drie, wordt PFK beschouwd als het belangrijkste regelgevende punt voor glycolyse (#3 in de afbeelding hieronder) in spier, met een ΔG= -25.9 kJ/mol, omdat het een geëngageerde stap is. Zodra PFK F6P converteert naar F1,6P, zal de reactie niet gemakkelijk worden omgekeerd vanwege de hoge hoeveelheid energie die moet worden overwonnen om terug te gaan. . Deze energiebarrière is zinvol aangezien pyruvaatkinase de definitieve reactie (#10) katalyseert en hexokinase (#1) helemaal niet betrokken is bij glycolyse wanneer het proces van glycogeen wordt begonnen.
PFK wordt gereguleerd door ATP, AMP en ADP. Terwijl ATP bij de actieve plaats even goed in zowel de Staten van R als van T bindt, bindt het bij voorkeur de allosteric plaats van de staat van T deze preferentiële band veroorzaakt een verschuiving van evenwicht van de twee staten, aan een grotere hoeveelheid staat van T , die de affiniteit voor F6P vermindert. Allosteric activator ADP bindt ook aan de allosteric plaats om de verhouding van phosphofructokinase van de staat van R te verhogen. Zoals blijkt uit de onderstaande grafiek, zijn de plots voor de activiteit van PFK sigmoïdaal. Dit toont verder de coöperatieve aard van het enzym aan. De initiële binding van substraat aan het enzym is moeilijk, maar zodra het gebonden is en de verandering in toestand van T -> R dwingt, binden de andere substraten veel gemakkelijker. De grafiek laat ook zien dat het toevoegen van ATP beweegt de plot rechts (dwz vermindert affiniteit voor F6P), terwijl het toevoegen van AMP beweegt naar links.
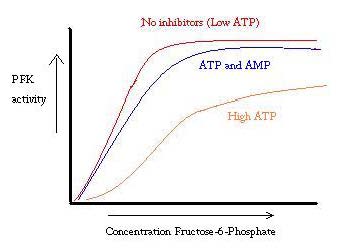
het regulatiesysteem komt goed overeen met de functie van PFK. Wanneer PFK actief is, wordt ATP downstream uit het geproduceerd, omdat verdere producten vollediger worden afgebroken. Aldus, wanneer ATP niveaus laag zijn en meer moet worden gemaakt, zal de activiteit van PFK worden verhoogd, omdat ADP in hoge concentratie zal zijn. Het tegenovergestelde geldt ook, omdat de hoge ATP concentratie eiwitactiviteit remt. En toch kan deze verklaring niet volledig verantwoordelijk zijn voor de regulering van PFK, omdat de niveaus van ATP niet sterk genoeg variëren tussen actieve en rustende spieren. Er moet een ander middel voor allosterische regulering worden gevonden.
PFK ‘ s Km voor ATP is .020mM en .032mM.
deze Kinemage-oefening bestaat uit twee kinemage-scènes die enkele allosterisch geïnduceerde conformationele veranderingen illustreren die optreden in PFK van Bacillus stearothermophilus.
conformationele veranderingen in een dimere eenheid van PFK
Deze kinemage toont de twee subeenheden van het tetrameer waarvan de interface twee actieve sites bevat. (KineMage op dit moment niet ondersteund) de eerste weergave, 1: PFK dimeer, toont de twee subeenheden in hun R toestand conformatie zoals weergegeven door hun CA backbones met subeenheid 1 in roze tint en subeenheid 2 in roze. In elke subeenheid worden twee zijketens weergegeven, die van Glu 161 (rood) en Arg 162 (cyaan), die respectievelijk deel uitmaken van de F6P-bindingsplaats in de T-en R-toestand(zie hieronder). Een F6P (hotpink) en een ADP (groen; “ADP-actief”) zijn gebonden in de actieve site van elke subeenheid. Een extra ADP (geel; “ADP-allo”) is gebonden in een aparte zogenaamde allosterische site van elke subeenheid. De ADPs hebben elk een geassocieerde Mg2+, die hier wordt vertegenwoordigd door een bal van dezelfde kleur als de ADP waaraan het bindt.
klik op de “ANIMATE” knop om het dimeer tussen zijn R en T toestanden te schakelen. In de T-toestand is subeenheid 1 bluetint en subeenheid 2 hemelsblauw. De zijketens van Glu 161 en Arg 162 in beide subeenheden zijn rood en cyaan zoals voorheen (alleen de CA-en Cb-atomen van de Arg 162 zijketting in subeenheid 1 worden waargenomen in de Röntgenstructuur van de T-toestand; die van subeenheid 2 worden allemaal waargenomen). Het enzym van de staat t bindt inhibitor 2-phosphoglycolate (goud; “PGC”), een niet-fysiologische analogon van glycolytic intermediaire phosphoenolpyruvate (PEP). Merk op dat de bindingsplaats van PGC in de T-toestand de allosterische bindingsplaats van ADP in de R-toestand overlapt (“ADP-allo”) en dat hun binding daarom wederzijds exclusief is. De T-status actieve sites, die geen F6P bevatten, worden gemarkeerd door “ghost” F6Ps (grijs; “F6P site”), die dezelfde posities hebben als de F6Ps in het R-status enzym.
de tweede weergave, 2: Allo / Act Sites, is een close-up van het bovenste gedeelte van de eerste weergave die zowel de actieve site als de allosterische site in deze regio toont. Merk op dat de actieve plaats zich op de interface tussen twee subeenheden bevindt en dat de allosteric plaats direct met de actieve plaats op de aangrenzende subeenheid samenwerkt. Vergelijk de R-status en T-status conformaties door beide tegelijk weer te geven of te klikken op “ANIMATE”. Kunt u het Mg2+ – ion identificeren dat geassocieerd is met elk van de ADP ‘ s die gebonden zijn aan het enzym in de R-toestand? Welke ADP-atomen coördineren deze Mg2 + – ionen?
de fosfaatgroep van PGC bindt aan de allosterische locatie in de T-toestand in vrijwel dezelfde positie als de bètafosfaatgroep van “ADP-allo” bindt aan de allosterische locatie in de R-toestand; beide fosfaatgroepen binden aan de zijketens van dezelfde drie residuen (2 arg en 1 Lys; niet getoond).
In de hoogactieve R-toestand vormt de positief geladen zijketen van Arg 162 een waterstofgebonden zoutbrug met de negatief geladen 6-fosfaatgroep van F6P (witte gestippelde lijnen), een interactie die vermoedelijk de R-toestand ten opzichte van de T-toestand stabiliseert en daarom gedeeltelijk verantwoordelijk is voor het homotrope effect van F6P.
de belangrijkste conformationele veranderingen in een subeenheid van PFK.
Deze KINEMAGE toont die segmenten in de buurt van de allosterische site (residuen 53-60 worden hier niet weergegeven). Net als in KINEMAGE 1 wordt het polypeptide vertegenwoordigd door zijn ca-keten met R-toestandsubeenheden 1 en 2 in redtint en pink, en T-toestandsubeenheden 1 en 2 in bluetint en skyblue. (KineMage momenteel niet ondersteund)KINEMAGE 2 komt in beeld 1: de allosterische plaats, in de R-staat die de fosfaatgroep van F6P (hotpink) in actieve plaats van het enzym in een waterstof gebonden zoutbrug (gestippelde witte lijnen) met de zijketen van Arg 162 (cyaan) toont. Een ADP (geel; “ADP-allo”) bezet de aangrenzende allosterische site. Klik eenmaal op “ANIMATE” om over te schakelen naar de T-status. Dit vervangt ADP in de allosteric plaats van de staat R met de inhibitor en PEP analoge PGC (goud). F6P bezet niet langer de actieve site, maar zijn positie in de R staat wordt aangegeven door de” ghost “F6P (grijs; bekeken door te klikken op”F6P site”).
Wat gebeurt er met het centrale spiraalvormige segment van polypeptiden (residuen 149-164) in de overgang van R naar T? Wat doet dit met de relatieve posities van de negatief geladen Glu 161 en de positief geladen Arg 162? Klik op “F6P site”. Welke invloed zou het ontbreken van de positieve lading van Arg 162 hebben op de binding van F6P? Verklaart dit, althans gedeeltelijk, waarom de staat PFK weinig affiniteit heeft voor F6P? Ga naar Weergave 2: close-up, voor een close-up van de F6P-sidechain interacties. Centreer de moleculen door “pickcenter” te kiezen uit het menu “tools” en te klikken op het atoom dat je in het midden wilt hebben. Schuif de “zoom” schuifregelaar om het uitzicht te vergroten.
Site-Directed mutagenese
op een gegeven moment werd aangenomen dat de negatieve lading van Glu 161 een negatief effect had op de F6P-binding in de T-toestand. Dit idee is niet ondersteund door site-directed mutagenese experimenten. Verschillende mutanten PFK ‘ s zijn gemaakt, waaronder R162A, e161a en r162a/e161a. de r162a mutatie veroorzaakte een 30-voudige afname in F6P binding. De e161a-mutatie had echter weinig effect op de capaciteit van PEP om de F6P-binding te remmen.
ziekte
erfelijke erytrocyten PFK-deficiëntie wordt geassocieerd met myopathie en hemolyse (ziekte van Tarui).
3D-structuren van PFK
Fosfofructokinase 3D-structuren
Leave a Reply