grenzen in de oncologie
Inleiding
ongeveer 25% van de patiënten met vroege borstkanker ervaart nog steeds lokaal recidief en ontwikkelt verre metastasen na actieve behandeling (1), en bijna 10% van de patiënten bevindt zich bij de eerste diagnose in stadium IV van de ziekte in de ontwikkelde wereld, die de novo metastatische borstkanker (MBC) (2) wordt genoemd. Ondanks de vooruitgang van de behandeling blijft MBC ongeneeslijk en tot 70-80% van de MBC-patiënten sterft binnen 5 jaar aan kanker (2). Als gevolg van de heterogeniteit van MBC, worden meerdere prognostische modellen op basis van prognostische factoren of scores ontwikkeld om hun klinische resultaten te voorspellen en clinici de juiste therapeutische beslissingen te laten nemen (3-5). Verder zijn er ook verschillende prognostische modellen voor borstkanker met hersenmetastase (bcbm) voor artsen om de overleving bij deze patiënten nauwkeurig te voorspellen (6, 7).
borstkanker kan overal in het lichaam metastaseren, maar voornamelijk metastaseert naar de longen, het bot, de lever, niet-axillaire lymfeklieren en de hersenen (8). Met name levermetastase (LM) is niet alleen een veel voorkomende gemetastaseerde plaats, maar ook geassocieerd met een significant verhoogd sterfterisico vergelijkbaar met hersenmetastase, een onevenredig hogere mortaliteit in vergelijking met long-of botmetastasen (5, 8). Aangezien graded prognostic assessment (GPA) algemeen geaccepteerd wordt bij bcbm patiënten, stimuleren de bovengenoemde prognostische modellen ons om een praktisch model voor BCLM (3-7) voor te stellen. Ons doel was om een betrouwbaar en gebruiksvriendelijk prognostisch model voor BCLM te construeren en de concordantie en nauwkeurigheid ervan te evalueren door het zowel intern als extern te valideren. Het prognostische model kan artsen helpen om het overlijdensrisico van BCLM-patiënten in te schatten en een optimale behandeling te selecteren.
patiënten en methoden
selectie van patiënten
deze studie werd goedgekeurd door de onafhankelijke ethische commissies van FUSCC. Opeenvolgende MBC-patiënten gediagnosticeerd bij FUSCC van januari 2007 tot December 2018 werden geïdentificeerd (n = 9.062). De subsidiabiliteitscriteria waren als volgt:: (1) histologisch bevestigde borstkanker, (2) vrouwelijke patiënten, (3) de lever als de eerste plaats van gemetastaseerde ziekte bij de novo gemetastaseerde of recidiverende borstkanker, en (4) volledige en gedetailleerde verslagen. Patiënten met bilaterale borstkanker, andere invasieve neoplasmata of met onbekende follow-up werden uitgesloten. Ten slotte werden 1.022 patiënten geselecteerd die in aanmerking kwamen voor verdere analyse. De volledige stappen van de selectie worden weergegeven in Figuur S1.
onderzoek naar Variabelen en selectie van Cut-Offwaarden
informatie werd verzameld over de volgende klinisch-pathologische variabelen: leeftijd, moleculaire subtypes, informatie over eerdere behandeling (chirurgie en systemische chemotherapie), MFI, plaatsen van extrahepatische metastase (hersenen, long, bot en lymfeklieren), kenmerken van levermetastase (distributie, aantal, maximale diameter), hemoglobine (HB), leverfunctietesten en overlevingstijd. Moleculaire subtypes omvatten hormoonreceptor (HR) en humane epidermale groeifactor receptor 2 (HER2) status. We definieerden MFI als het interval tussen de datum van diagnose van primaire borstkanker en de datum van de eerste verre metastase. De in deze studie gebruikte afsluitpunten van MFI waren 3 en 24 maanden volgens referentie (9). Daarom konden patiënten worden onderverdeeld in drie groepen: patiënten met de novo MBC (MFI < 3 maanden), patiënten met een korte MFI (≤ 24 maanden) en patiënten met een lange MFI > 24 maanden. Verre lymfeknoopmetastase werd gedefinieerd als metastase uit ipsilaterale axillaire, supraclaviculaire, infraclaviculaire of interne borstklieren. De diagnose van LM was gebaseerd op radiografische beeldvorming of pathologisch bewijs. Kenmerken van levermetastase werden geëvalueerd met behulp van abdominale computertomografie (CT), magnetic resonance imaging (MRI), of chirurgische resectie specimens. In deze studie werden ook leverfunctietests geanalyseerd, waaronder totaal bilirubine, alanineaminotransferase (ALT), aspartaataminotransferase (AST), alkalische fosfatase (ALP), lactaatdehydrogenase (LDH) en γ-glutamyltransferase / albumine ratio (GAR). Binnen 1 week na de diagnose LM werden bloedmonsters genomen voor laboratoriumtests. Classificaties van distributie, Aantal of maximale diameter van levermetastasen en LDH waren gebaseerd op andere studies (10-13). De cut-offwaarden voor HB, totaal bilirubine, ALAT, ASAT en ALP werden bepaald volgens de Common Terminology Criteria for Adverse Events (CTCAE) omdat matige of Graad II afwijkingen in hemoglobinespiegels of leverfunctie therapeutische keuzes kunnen beïnvloeden (14). De waarde van GAR werd gedefinieerd als een eenvoudige verhouding tussen het serumy-glutamyltransferase (GGT, U/L) – gehalte en het serumalbumine (ALB g/L) – gehalte. OS vanaf het moment van metastase werd gemeten vanaf de datum van diagnose van LM tot de dood voor elke oorzaak. De laatste follow-up periode was November 2019 met een mediane follow-up tijd van 18,63 maanden. Als patiënten werden verloren aan de follow-up, werd het gecensureerd op de laatste dag van de follow-up.
statistische analyse
patiënten werden verdeeld in de training (2007-2016, n = 715) en validatie (2016-2018, n = 307) vastgesteld op een ratio van 7:3. De optimale cutoff waarde voor GAR werd gekozen door de berekening van de Youden index en receiver operating characteristic curve (ROC) analyse (figuur S2). Pearson chi-kwadraat test of Fisher ‘ s exacte test werd gebruikt om een vergelijking tussen categorische variabelen te maken. Cox proportionele risico ’s regressiemodellen met de achterwaartse selectie methode werden gebruikt voor multivariate analyse en om hazard ratio’ s te berekenen. De regressiecoëfficiënten werden berekend door middel van multivariate regressieanalyse en vervolgens vermenigvuldigd met 10 en afgerond om de uiteindelijke prognostische scores weer te geven. Bootstrapping werd gebruikt voor interne validatie. Vervolgens werden tijdafhankelijke ROC-curven en kalibratiepercelen gebruikt om discriminatie en kalibratie van dit prognostische model in de validatieset te beoordelen. De cutoff waarden van risicogroepen werden bepaald door X-tile percelen (15). Overlevingsanalyse werd uitgevoerd met behulp van Kaplan-Meier-survivalcurves en log-rank-tests werden gebruikt om overlevingscurves te vergelijken. Alle P-waarden waren tweezijdig en waarden van P < 0,05 werden statistisch significant geacht. Statistische analyse werd uitgevoerd met behulp van SPSS-software (SPSS 20, Chicago, IL, USA) en R-software Versie 4.0.1.
resultaten
kenmerken en relatie met risicostratificatie
in totaal werden 1.022 patiënten geselecteerd in deze studie verdeeld in trainingssets (n = 715) en validatiesets (n = 307). Een beschrijving van de clinicopathologische kenmerken wordt gegeven in Tabel 1 en tabel S1. In de trainingsgroep waren 126 patiënten (17,6%) gediagnosticeerd met de novo MBC en 589 patiënten (82,4%) met recidiverende MBC, waarvan 297 patiënten (50,4%) een korte MFI hadden en 292 patiënten (49,6%) een lange MFI. De mediane leeftijd bij de diagnose LM was 50 (bereik 21-87)jaar met 617 patiënten (86.3%) jonger dan 60 jaar. Van deze patiënten was het aandeel HR-positieve en HER2-positieve patiënten respectievelijk 62,2 en 38,0%. Onder recidiverende MBC-patiënten ondergingen bijna alle patiënten een operatie aan de primaire tumor (584, 99,2%) en kregen (neo)adjuvante chemotherapie (569, 96,6%). Patronen van verre metastase toonden aan dat de meest voorkomende plaats van extrahepatische metastase bot was (42,7%) gevolgd door verre lymfeklieren (36,1%), longen (25,6%) en hersenen (2,9%). Levermetastase werd gekarakteriseerd door diffuse distributie en kleine knobbeltjes, waarvan de meerderheid multipele (≥3 metastasen, 77,3%) maar kleine knobbeltjes (≤3 cm, 59,4%) waren waarbij rechter-en linkerkwabben betrokken waren (74,4%). In het vroege stadium van LM was de leverfunctie in verschillende mate verminderd, maar over het algemeen mild. De stijging van LDH (36,1%) en GAR (35,9%) leek gevoelige indicatoren voor leverdysfunctie te zijn, en matige of meer afwijkingen in HB (2,9%), totaal bilirubine (2,7%), ALT (3,6%), AST (9,5%) en ALP (3,9%) waren ongewoon volgens CTCAE. Vergeleken met de laagrisicogroep, presenteerde de Midden-en hoogrisicogroep een hoger percentage HR – en HER2-negativiteit, een korte MFI, extrahepatische metastase, levermetastase tumorbelasting en afwijkingen in hemoglobinespiegels of leverfunctie (alle PS ≤ 0,001), wat erop wijst dat deze factoren de prognose van BCLM kunnen beïnvloeden.
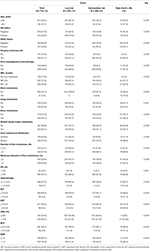
Tabel 1. Basiskenmerken en de relatie ervan met de risicostratificatie van de trainingsset.
prognostisch Model en validatie
in het multivariate Cox-regressiemodel werden moleculaire subtypes (HR-en HER2-status), MFI, plaatsen van extrahepatische metastase (hersenmetastase, long-en botmetastase) en leverfunctietests (totaal bilirubine, LDH en GAR) geassocieerd met OS (Tabel 2). Specifiek nam het overlijdensrisico van HR–negatief (HR 1,740, 95% BI 1,424–2,127, P < 0,001) en HER2-negatief (HR 1,615, 95% BI 1,316-1,983, P < 0,001) patiënten toe vergeleken met HR of HER2-positieve tegenhangers. De lengte van de MFI had ook een significante invloed op de overleving van BCLM–patiënten, en daarom werd de overleving van patiënten met een lange MFI (HR 1,612, 95% BI 1,195–2,174, P < 0,001) verkort in vergelijking met patiënten met de novo MBC, en patiënten met een korte MFI (HR 2,563, 95% BI 1,904-3.449, P < 0,001)) had meer dan twee keer het risico van overlijden ten opzichte van hen. Daarnaast waren de aanwezigheid van extrahepatische metastase (hersenen, longen en botmetastase) en abnormale leverfunctie (totaal bilirubine, LDH en GAR) allemaal gecorreleerd met een ongunstig prognostisch effect op de OS. Dit prognostische model had het gebied onder de curve (AUC) van tijdsafhankelijke ROC bij 1 jaar OS met 0,78 in de trainingsset en 0,80 in de validatieset, wat aangeeft dat dit model een goede discriminatie had (figuur 1). De bootstrapping methode werd gebruikt om de stabiliteit van ons prognostisch model in de trainingsset te bevestigen, en de eindresultaten waren vrij robuust (tabel S2). Kalibratiecurven van het prognostische model voor OS van 1 jaar en 3 jaar in de trainingsset en OS van 1 jaar in de validatieset toonden een goede overeenstemming (Figuur 2).

Tabel 2. Multivariate Cox regressiemodel (trainingsset).
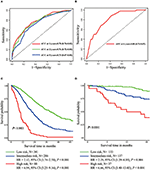
figuur 1. Tijdsafhankelijke ROC-curven van het prognostische model in de Opleidingsset (A) en de validatieset (B). Totale overleving van metastase van de drie prognostische groepen in de training (C) en validatieset (D).
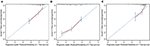
Figuur 2. De kalibratiecurve voor het voorspellen van de overleving van de patiënt na 1 jaar (A) en 3 jaar (B) in de trainingsset en na 1 jaar (C) in de validatieset.
risicostratificatie en overleving

Tabel 3. Berekening van de score en cutoff punten van de prognostische groepen.
discussie
in de huidige analyse van 1.022 patiënten die in onze instelling werden behandeld tussen 2007 en 2018, hebben we aangetoond dat moleculaire subtypes (HR-en HER2-status), MFI, plaatsen van extrahepatische metastase (hersenmetastase, long-en botmetastase), leverfunctietesten (totaal bilirubine, LDH en GAR) onafhankelijke prognostische factoren waren bij BCLM-patiënten. Daarom werd een prognostisch model voor BCLM-patiënten geconstrueerd met behulp van prognostische factoren.
met betrekking tot moleculaire subtypes kan HR-positief erop wijzen dat de groei en proliferatie van borstkanker nog steeds worden gereguleerd door hormonen, die hormoonafhankelijke tumoren worden genoemd. Tegelijkertijd heeft endocriene therapie voordelen, waaronder weinig bijwerkingen en langdurige effecten, die vaak langetermijnvoordelen kunnen opleveren voor HR-positieve patiënten. Daarom is HR-positief beschouwd als een belangrijke factor die een gunstige prognose suggereert bij vroege en gemetastaseerde borstkanker (1, 3-5, 8-10, 16). Hoewel HER2-versterking en overexpressie wordt beschouwd als een voorspeller van een risico op verre metastase en borstkanker–gerelateerde dood, hebben later ontwikkelde anti-HER2-middelen de overleving van HER2-positieve borstkankerpatiënten opmerkelijk verbeterd (2, 9, 17). In het tijdperk van gerichte therapie bleek uit een studie in Zuidoost-Nederland dat het sterfterisico van HER2–negatieve patiënten was verhoogd met 44% (95% BI 1,13-1,83, P = 0,003) in vergelijking met HER2-positieve patiënten (9). In onze studie nam het overlijdensrisico van HR-negatieve en HER2-negatieve patiënten toe in vergelijking met HR-of HER2-positieve tegenhangers, in overeenstemming met deze observaties. Patiënten met een korte MFI, gewoonlijk gedefinieerd als ≤24 maanden, hadden een slechtere prognose (3, 5, 9). Verder leken de novo MBC-patiënten een significant betere prognose te hebben ten opzichte van recidiverende MBC-patiënten, hoewel dit verschil geleidelijk werd verminderd met de verlenging van het ziektevrije interval (DFI) of MFI (9, 18, 19). Lobbyzoo et al. bleek dat patiënten met MFI ≤24 maanden significant kortere overlevingstijd hadden (9,1 vs.29.4 maanden, P < 0,001) dan die met de novo stadium IV ziekten, maar patiënten met een langere MFI (>24 maanden) hadden een vergelijkbare prognose (27,9 vs.29,4 maanden, P = 0,73) (9). De mogelijke reden voor dit fenomeen is dat patiënten met recidiverend MBC die eerder systematische therapie ondergingen resistenter kunnen zijn tegen chemotherapie dan therapienaïeve patiënten met de novo MBC, maar verder onderzoek is gerechtvaardigd (9, 18, 19). Deze studie bevestigde dat de overlevingstijd van patiënten met een lange MFI verkort was in vergelijking met de novo MBC, waarbij patiënten met een korte MFI een significant slechter resultaat hadden.
MBC overleving verschilde significant naargelang de metastaseplaatsen en patiënten met viscerale metastase werden geassocieerd met een verhoogd risico op mortaliteit in vergelijking met patiënten met niet-viscerale metastase (3-5, 9, 18). Bovendien had de aanwezigheid van hersenmetastase een grotere impact op de overleving dan enige andere metastatische plaatsen (3, 5, 9, 18). Het was niet verwonderlijk dat meerdere metastasen een meer ongunstige invloed hadden op de prognose (3, 5, 9, 17, 18). In deze analyse kan extrahepatische metastase, met uitzondering van metastase op afstand van lymfeklieren, leiden tot een verkorte overleving, waarschijnlijk omdat levermetastase de kritisch levensbedreigende factor was in vergelijking met metastase op de lymfeklieren.
Er moet worden opgemerkt dat patiënten met hogere bilirubinespiegels een veel lager risico hadden op verschillende ziekten, deels via de antioxidante en ontstekingsremmende eigenschappen (20). Een recente studie meldde ook dat een vermindering van bijna 40% van het overlijdensrisico werd aangetoond bij vroege borstkankerpatiënten met een hoger totaal bilirubinegehalte (21). Hyperbilirubinemie werd echter geassocieerd met een slechte prognose bij BCLM-patiënten (22). Het is mogelijk dat, in tegenstelling tot relatief hogere totale bilirubine bij niet-gemetastaseerde borstkankerpatiënten, een verhoogd bilirubine 1,5 keer meer dan de bovengrens van normaal (ULN) bij BCLM-patiënten ernstige leverbeschadiging kan voorspellen en aldus kan bijdragen tot het stopzetten van het geneesmiddel of hepatische encefalopathie.
het Warburg-effect zorgt ervoor dat kankercellen afhankelijk zijn van aërobe glycolyse, zelfs wanneer de zuurstoftoevoer voldoende is, wat het kenmerk is van het kankermetabolisme in tegenstelling tot normale weefsels (23). LDH speelt een onmisbare rol in glycolyse vanwege zijn vermogen om pyruvaat om te zetten in lactaat tijdens anaërobe omstandigheden (24). Gedereguleerde niveaus van LDH kunnen een hogere tumorlast, slechtere behandelingsrespons en prognose weerspiegelen, die eerder in meerdere tumoren waren gemeld (21, 24-26). Een meta-analyse van het prognostische effect van LDH bij borstkankerpatiënten toonde aan dat hogere LDH-spiegels resulteerden in onbevredigende OS en progressievrije overleving, waaronder 11 onderzoeken met 6 102 patiënten (27).
GGT, de belangrijkste endogene antioxidant, maakt voorloper aminozuren geassimileerd en is betrokken bij de glutathionsynthese (28). GGT in tumors laat cellen toe om glutathione snel aan te vullen na het ontvangen van pro-oxidant therapie tegen kanker en, daarom, is gecorreleerd met drugweerstand en slechte overleving (29). Interessant, Fentiman et al. gemeld dat een significant positief verband werd vastgesteld tussen verhoogd GGT en risico op borstkanker (30). ALB gesynthetiseerd door de lever functioneert als een antioxidant, transporter van voedingsstoffen, en heeft deelname aan signaalwegen vanwege zijn unieke structurele eigenschappen (31). Hypoalbuminemie komt meestal voor bij gevorderde kankerpatiënten en wordt toegeschreven aan verschillende mechanismen, waaronder verminderde leversynthese, verhoogd katabolisme en cachexie (21, 31). Hypoalbuminemie is een onafhankelijke indicator van slechte prognose van verschillende tumoren (21, 22, 32, 33). In tegenstelling tot verlaagde serumalbumine spiegels, serum GGT spiegels hebben de neiging om te worden verhoogd wanneer de leverfunctie is verminderd. Daarom kan GAR op basis van de bovenstaande twee parameters het voordeel hebben om de leverreservecapaciteit weer te geven en de prognose te voorspellen (32, 33). In de huidige studie waren abnormale leverfunctie (totaal bilirubine, LDH en GAR) allemaal gecorreleerd met een ongunstig prognostisch effect op de OS.
na analyse van de prognose van 123 BCLM-patiënten, Duan et al. gevonden dat patiënten met drie of meer levermetastasen 2.26 maal verhoogd risico op overlijden ten opzichte van patiënten met <3 levermetastasen in multivariate analyse (10). Kenmerken van levermetastase in deze studie bleken echter geen verschil te maken. Er zijn twee mogelijke redenen die aan deze discrepantie bijdragen. Allereerst waren de verdeling, het aantal en de maximale diameter van levermetastasen significant verschillend in de drie risicogroepen, wat aangeeft dat het risico op mortaliteit toenam met de uitbreiding van levermetastase in univariate analyse. Daarna, abnormale leverfunctie was nauw gerelateerd aan de tumorlast van levermetastase, het aanpassen van de rol van deze factoren in multivariate analyse.
Er zijn vele studies uitgevoerd naar prognostische factoren in de setting van BCLM. Een analyse van 145 BCLM-patiënten toonde aan dat hypoalbuminemie, hogere leeftijd en ER-negativiteit onafhankelijke voorspellers waren van slechte overleving (22). Een Griekse registeranalyse leverde vergelijkbare resultaten op, waarbij HR-positiviteit, lage histologische graad, afwezigheid van extrahepatische metastase en goede prestatiestatus significante prognostische factoren waren voor een gunstige prognose in univariate analyse (34). Een recente populatie-gebaseerde studie met meer dan 4.000 patiënten met de novo BCLM heeft demografische en sociaaleconomische factoren, pathologische graad, totaal aantal extrahepatische metastase, behandeling, en moleculaire subtype geïdentificeerd als parameters die de totale overleving significant beïnvloeden (17). Regierer et al. ontwikkelde een prognostische score voor MBC op basis van HR-status, MFI, en locaties van metastasen om hun prognose te voorspellen en een optimale behandeling te individualiseren, die intern en extern werd gevalideerd (5). Helaas werd de HER2-status niet opgenomen in de prognostische score en beperkte daarom de toepasbaarheid ervan. De gewijzigde Borst-GPA voor BCBM-patiënten die vier eenvoudige klinische parameters integreerden, had een directe rol bij het voorspellen van hun overleving, maar was niet van toepassing op BCLM-patiënten (7). Voor zover wij weten, is er geen prognostisch model dat deze prognostische factoren voor BCLM patiënten integreert, dus Ons model is pragmatisch zinvol.
Er waren ook enkele beperkingen in dit onderzoek. Ten eerste, een single-center en retrospectieve studie resulteerde onvermijdelijk in selectie bias hoewel ons prognostisch model intern en extern werd gevalideerd. Ten tweede werden patiënten die later in het ziekteverloop levermetastase ontwikkelden uitgesloten, zodat we deze patiënten niet konden evalueren. Ten derde was er in deze studie geen gedetailleerde informatie beschikbaar over de prestatiestatus en de behandeling.
conclusies
ondanks deze beperkingen kan dit onderzoek een eenvoudig en betrouwbaar prognostisch model opleveren. Het grote voordeel van onze studie is de integratie van gemakkelijk toegankelijke parameters in de klinische praktijk op basis van de grote steekproef van BCLM-patiënten. Afgezien van uitstekende classificatie van tumoren volgens de volgende generatie sequencing methoden, Ons model kan helpen bij het identificeren van subgroepen met verschillende prognose en begeleiden van de daaropvolgende therapie.
Gegevensbeschikbaarheidsverklaring
de oorspronkelijke bijdragen in de studie zijn opgenomen in het artikel/aanvullend materiaal, verder onderzoek kan worden gericht aan de corresponderende auteur/S.
ethische verklaring
deze studie werd goedgekeurd door de onafhankelijke ethische commissies van FUSCC. De patiënten / deelnemers hebben hun schriftelijke geïnformeerde toestemming gegeven om deel te nemen aan deze studie.
Auteursbijdragen
LJ stelde de studie voor. XZ en YG verzamelden de gegevens. LJ en LF analyseerden de gegevens en schreven de eerste versie. ZW heeft het manuscript kritisch bekeken. Alle auteurs hebben bijgedragen aan het artikel en de ingediende versie goedgekeurd.
belangenconflict
De auteurs verklaren dat het onderzoek werd uitgevoerd zonder enige commerciële of financiële relatie die als een potentieel belangenconflict kon worden opgevat.
bevestigingen
We erkennen Lei Cheng voor het uitvoeren van data-analyse.
aanvullend materiaal
Afkortingen
BCLM, borstkanker met levermetastase; FUSCC, Fudan University Shanghai Cancer Center; ROC, receiver operating characteristic curve; door MFI ‘ s, metastase-vrij interval; HR hazard ratio; CI, met een betrouwbaarheidsinterval van; OS, algehele overleving; MBC, uitgezaaide borstkanker; BCBM, borstkanker met hersenen metastase; LM, lever metastase; GPA, graded prognostic assessment; HB, hemoglobine; HR -, hormoon-receptor; HER2, human epidermal growth factor receptor 2; CT, computertomografie; MRI, magnetic resonance imaging; ALT, alanineaminotransferase; ASAT, aspartaat aminotransferase; ALP, alkalische fosfatase; LDH, lactaat dehydrogenase; GAR, γ-glutamyl transferase aan albumine ratio; GGT, γ-glutamyltransferase; ALB, albumine; CTCAE, Common Terminology Criteria for Adverse Events; ULN, upper limit of normal.
4. Puente J, Lopez-Tarruella S, Ruiz A, Lluch A, Pastor M, Alba E, et al. Praktische prognostische index voor patiënten met gemetastaseerde recidiverende borstkanker: retrospectieve analyse van 2.322 patiënten uit het geicam Spaanse El Alamo Register. Borstkanker Res Behandelen. (2010) 122:591–600. doi: 10.1007/s10549–009-0687–4
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Regierer AC, Wolters R, Ufen MP, Weigel A, Novopashenny I, Kohne CH, et al. An internally and externally validated prognostic score for metastatic breast cancer: analysis of 2269 patients. Ann Oncol. (2014) 25:633–8. doi: 10.1093/annonc/mdt539
PubMed Abstract | CrossRef Full Text
6. Marko NF, Xu Z, Gao T, Kattan MW, Weil RJ. Voorspellen van overleving bij vrouwen met borstkanker en hersenmetastase: een nomogram presteert beter dan de huidige overlevingsvoorspellingsmodellen. Kanker. (2012) 118:3749–57. doi: 10.1002 / cncr.26716
PubMed Abstract / CrossRef Full Text / Google Scholar
7. Subbiah IM, Lei X, Weinberg JS, Sulman EP, Chavez-MacGregor M, Tripathy D, et al. Validatie en ontwikkeling van een aangepaste borstgraded prognostische beoordeling als een hulpmiddel voor overleving bij patiënten met borstkanker en hersenmetastasen. J Clin Oncol. (2015) 33:2239–45. doi: 10.1200 / JCO.2014.58.8517
PubMed Abstract | CrossRef Full Text/Google Scholar
9. Lobbezoo DJ, Van Kampen RJ, Voogd AC, Dercksen MW, van den Berkmortel F, Smilde TJ, et al. Prognose van gemetastaseerde borstkanker: zijn er verschillen tussen patiënten met de novo en terugkerende gemetastaseerde borstkanker? Br J Cancer. (2015) 112:1445–51. doi: 10.1038/bjc.2015.127
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Duan XF, Dong NN, Zhang T, Li Q. The prognostic analysis of clinical breast cancer subtypes among patients with liver metastases from breast cancer. Int J Clin Oncol. (2013) 18:26–32. doi: 10.1007/s10147–011-0336-x
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dueck AC, Mendoza TR, Mitchell SA, Reeve BB, Castro KM, Rogak LJ, et al. Validity and Reliability of the US National Cancer Institute ‘ s Patient-Reported Outcomes Version of the Common Terminology Criteria for Adverse Events (PRO-CTCAE). JAMA Oncol. (2015) 1:1051–9. doi: 10.1001 / jamaoncol.2015.2639
PubMed Abstract | CrossRef Full Text/Google Scholar
17. Xie J, Xu Z. een populatie-gebaseerde studie naar levermetastasen bij vrouwen met nieuw gediagnosticeerde borstkanker. Kanker Epidemiol Biomarkers Vorige (2019) 28:283–92. doi: 10.1158/1055–9965.EPI-18–0591
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Dawood S, Broglio K, Ensor J, Hortobagyi GN, Giordano SH. Survival differences among women with de novo stage IV and relapsed breast cancer. Ann Oncol. (2010) 21:2169–74. doi: 10.1093/annonc/mdq220
PubMed Abstract | CrossRef Full Text
19. den Brok WD, Speers CH, Gondara L, Baxter E, Tyldesley SK, Lohrisch CA. Overleving met gemetastaseerde borstkanker gebaseerd op initiële presentatie, de novo versus recidiverend. Borstkanker Res Behandelen. (2017) 161:549–56. doi: 10.1007 / s10549–016-4080–9
PubMed Abstract | CrossRef Full Text/Google Scholar
20. Fujiwara R, Haag M, Schaeffeler E, nies AT, Zanger UM, Schwab M. Systemic regulation of bilirubin homeostasis: potential benefits of hyperbilirubinemia. Hepatologie. (2018) 67:1609–19. doi: 10.1002/hep.29599
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Liu X, Meng QH, Ye Y, Hildebrandt MAT, Gu J, Wu X. Prognostic significance of pretreatment serum levels of albumin, LDH and total bilirubin in patients with non-metastatic breast cancer. Carcinogenesis. (2015) 36:243–8. doi: 10.1093/carcin/bgu247
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Vander Heiden MG, Cantley LC, Thompson CB. Inzicht in het Warburg-effect: de metabolische vereisten van celproliferatie. Wetenschap. (2009) 324:1029–33. doi: 10.1126 / wetenschap.1160809
PubMed Abstract | CrossRef Full Text/Google Scholar
24. Mishra D, Banerjee D. Lactaatdehydrogenases als metabole verbindingen tussen tumor en stroma in het tumormicromilieu. Kanker. (2019) 11:750. doi: 10.3390/cancers11060750
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Pelizzari G, Basile D, Zago S, Lisanti C, Bartoletti M, Bortot L, et al. Lactate dehydrogenase (ldh) response to first-line treatment predicts survival in metastatic breast cancer: first clues for a cost-effective and dynamic biomarker. Cancers. (2019) 11:1243. doi: 10.3390/cancers11091243
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Hopkins AM, Rowland A, McKinnon RA, Sorich MJ. Predictors of long-term disease control and survival for HER2-positive advanced breast cancer patients treated with pertuzumab, trastuzumab, and docetaxel. Front Oncol. (2019) 9:789. doi: 10.3389/fonc.2019.00789
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Pentheroudakis G, Fountzilas G, Bafaloukos D, Koutsoukou V, Pectasides D, Skarlos D, et al. Gemetastaseerde borstkanker met levermetastasen: een registeranalyse van clinicopathologische, management-en outcome-kenmerken van 500 vrouwen. Borstkanker Res Behandelen. (2006) 97:237–44. doi: 10.1007 / s10549–005-9117–4
PubMed Abstract / CrossRef Full Text / Google Scholar
Leave a Reply