grenzen in farmacologie
introductie
liposomen zijn een type nanocarrier dat op grote schaal is onderzocht met het oog op de toediening van geneesmiddelen. Ze zijn samengesteld uit fosfolipide bilagen die een aparte waterige ruimte omsluiten, waardoor inkapseling van zowel hydrofiele als hydrofobe verbindingen mogelijk is (metselaar and Storm, 2005). Liposomen kunnen therapeutische samenstellingen stabiliseren en barrières voor cellulaire en weefselbegrijpen overwinnen (Ding et al., 2006; Hua en Wu, 2013). Dit stelt hen in staat om het richten van verbindingen naar plaatsen van ziekte te verbeteren en bijgevolg accumulatie in niet-doelorganen te verminderen (Bakker-Woudenberg et al., 1994; Mastrobattista et al., 1999; Hua, 2013; Hua et al., 2015; Sercombe et al., 2015; Zununi Vahed et al., 2017). Er zijn vier belangrijke die types van liposomes op hun oppervlaktekenmerken worden gebaseerd-conventionele liposomes, gepegyleerde liposomes, ligand-gerichte liposomes, en theranostic liposomes (figuur 1; Sercombe et al., 2015). Ligand-gerichte liposomen verstrekken het potentieel voor plaats-Specifieke Levering van drugs aan bepaalde weefsels of organen die selectief gerichte ligand uitdrukken (Willis en Forssen, 1998; Bendas, 2001; Sawant en Torchilin, 2012), terwijl gepegyleerde liposomen sterische belemmering verlenen om de omloop halveringstijd van het leveringssysteem na systemisch beleid te verbeteren (Torchilin, 1994; Wang et al., 2015). Liposomes die een combinatie van de diverse leveringsplatforms integreren kunnen de levering van ingekapselde samenstellingen, afhankelijk van de route van beleid en plaats van ziekte verder verbeteren.
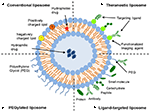
figuur 1. Schematische weergave van de verschillende soorten liposomale geneesmiddelenafgiftesystemen – (a) conventioneel liposoom, (B) gepegyleerd liposoom, (C) Ligand-gericht liposoom, en (D) Theranostisch liposoom (Sercombe et al., 2015).
na het fabricageproces worden liposomen gekarakteriseerd om homogeniteit te garanderen over een aantal parameters, waaronder geneesmiddelafsluiting, ligandconjugatie, lipidesamenstelling, oppervlaktelading en morfologische eigenschappen (bijvoorbeeld grootte, vorm en aantal lamellen) (Kuntsche et al., 2011). Deze kenmerken zijn belangrijk aangezien zij een belangrijke invloed op het gedrag van liposomes zowel in vitro als in vivo kunnen hebben (Sawant en Torchilin, 2012; Sercombe et al., 2015). Erkenning en klaring van liposomen door de afweer van het lichaam, met inbegrip van het reticulo-endotheliaal systeem (RES) en adsorptie van opsoninen met daaropvolgende opname door het mononucleaire fagocytaire systeem, zijn belangrijke bijdragen aan de klaring en degradatie van liposomen (Senior, 1987; Cullis et al., 1998; Ishida et al., 2001). Daarom, is het kunnen de fysicochemische eigenschappen van vervaardigde liposomes bepalen belangrijk om een formulering voor verdere Vertalende evaluatie te optimaliseren.
een belangrijk aspect in de fysisch-chemische beoordeling van liposomen is het visualiseren van de morfologie van de nanodeeltjes met behulp van microscopie. Er zijn een aantal technieken beschikbaar voor weergave liposomes en andere nanoparticles die in het algemeen in licht, elektron, of atomisch-krachtmicroscopie kunnen worden gecategoriseerd (Bibi et al., 2011). Elke techniek heeft zijn eigen voordelen en beperkingen, die zouden moeten worden overwogen wanneer het evalueren van studies op nanoparticle-gebaseerde systemen van de druglevering (Tabel 1). Dit overzicht zal elke weergavetechniek evalueren die wordt gebruikt om de morfologische kenmerken van liposomen te beoordelen.

tabel 1. Samenvatting van huidige weergavetechnieken voor het karakteriseren van liposome morfologie.
lichtmicroscopie
licht of optische microscopie verwijst naar microscopen die zichtbaar licht en een opstelling van lenzen gebruiken om een gezichtsveld te vergroten (Murphy and Davidson, 2012c). De basis lichte microscopie zelf is niet in staat om uitvoerige informatie over de lipide bilayer in vergelijking met het detail te verstrekken dat door andere microscopietechnieken wordt aangeboden. Het kan echter worden gebruikt om snel een beeld van blaasjes te verkrijgen met behulp van basislaboratoriumapparatuur (Bibi et al., 2011). Deze techniek kan bijzonder nuttig zijn wanneer het verzamelen van algemene informatie over de grootte, vorm, homogeniteit, en de mate van samenvoeging van een liposoomsteekproef (Nallamothu et al., 2006). Lichtmicroscopen hebben een uiteindelijke resolutie van ∼250 nm (beheerst door de kleinste diffractie-beperkte vlekgrootte die door het instrument kan worden bereikt) en, als zodanig, zijn typisch niet in staat om gedetailleerde informatie betreffende de structuren van kleine unilamellar blaasjes (SUV ‘ s) en de lamellariteit van blaasjes (Bibi et al., 2011). Over het algemeen, kan de lichtmicroscopie significante informatie over reuze unilamellar blaasjes (GUVs) slechts verstrekken, die van enige tot honderden micrometers in diameter kunnen variëren (Bagatolli, 2009). De integratie van fluorescente sondes, polarisatietechnieken, en de toepassing van confocale microscopie met hoge resolutie kunnen meer informatie over de 3D structuur en lamellariteit van de blaasjes verstrekken (Bagatolli, 2009).
Polarisatiemicroscopie
Dit type lichtmicroscopie maakt gebruik van de unieke mogelijkheid van gepolariseerd licht om te interageren met polariseerbare bindingen van geordende moleculen (Murphy and Davidson, 2012d). Verbeterde lichtabsorptie komt voor wanneer de moleculaire dipolen in de steekproef met de polarisatie vector van de invallende lichte golf worden uitgelijnd; resulterend in faseverschillen tussen de bemonstering van lichtstralen, die op hun beurt interferentieafhankelijke veranderingen in de amplitude in het beeldvlak veroorzaken (Murphy en Davidson, 2012d). Beeldcontrast ontstaat dan niet alleen door de effecten van interferentie en diffractie, maar ook door de aanwezigheid van geordende moleculaire arrangementen (Murphy and Davidson, 2012d). Het kan worden gebruikt om de vorm en dynamiek van vele geordende cellulaire structuren, met inbegrip van lipide bilagen van plasmamembranen (Bibi et al., 2011; Murphy and Davidson, 2012d). Afbeeldingen kunnen worden verkregen in monochroom of kleur. Deze techniek verstrekt een alternatieve methode om liposomes te visualiseren, in het bijzonder om de vorming van blaasjes te bevestigen. Het geeft geen sluitende waarnemingen met betrekking tot de bilaagkarakteristieken of lamellariteit van de blaasjes (Bibi et al., 2011). Bovendien wordt de polarisatiemicroscopie ook beperkt door de grootte van de blaasjes die, met grote blaasjes in de micrometerwaaier kunnen worden gevisualiseerd die de optimale duidelijkheid hebben. Deze techniek verstrekt geen duidelijke beelden van deeltjes in de nanometerwaaier.
fluorescentiemicroscopie
fluorescentiemicroscopie of “epifluorescentiemicroscopie” is een speciale vorm van lichtmicroscopie die gebruik maakt van het vermogen van fluorochromen om licht uit te zenden nadat het is opgewekt met licht van een bepaalde golflengte (Murphy and Davidson, 2012b). Deze techniek wordt veel gebruikt in de biofysica om essentiële informatie te verschaffen over de structuur en dynamiek van membraancomponenten (Bouvrais et al., 2010). In deze studies, worden de fluorescente sondes specifiek opgenomen in het membraan in onderzoek, toelatend visualisatie van de structuur. Een grote waaier van fluorescente kleurstoffen met diverse chemische en fotonische eigenschappen zijn commercieel beschikbaar, die aan een verscheidenheid van onderzoeksvragen richten. Bijvoorbeeld, kunnen bepaalde fluorescente kleurstoffen de voorkeur geven aan specifieke membraanomgevingen die verschillende regelingen en laterale verpakking vertonen (Bouvrais et al., 2010). Als zodanig, staat de fluorescentiemicroscopie voor het potentieel toe om veelvoudige sondes binnen een steekproef gelijktijdig toe te passen om informatie over de membraanstructuur zelf te verstrekken. De fluorescente sondes kunnen binnen het watercompartiment evenals de lipide bilayer van liposomen worden geplaatst (Bibi et al., 2011). Deze regeling kan vooral nuttig zijn bij het bekijken van Guv ‘ s, waar informatie kan worden verkregen over de vorm, grootte en vloeibaarheid van de lipide blaasjes (Klymchenko et al., 2009; Bouvrais et al., 2010). Incorporatie van sondes, zoals rhodamine-geëtiketteerde lipiden, direct in de lipide bilayer kan ook visualisatie van de lamellariteit van liposomen (Bibi et al., 2011).
het nadeel van fluorescerende microscopie is dat de toevoeging van sondes en kleurstoffen aan een membraansysteem mogelijk de eigenschappen van het liposomale toedieningssysteem kan beïnvloeden (Bouvrais et al., 2010; Bibi et al., 2011; Murphy and Davidson, 2012b). Het gebruik van lage kleurstofconcentraties (≤1 mol%) heeft echter een minimale impact op de fysische eigenschappen van het membraan (Bouvrais et al., 2010). Het is ook belangrijk op te merken dat de keuze van fluorescente kleurstof een kritieke stap is, aangezien sommige kleurstoffen grote veranderingen in het gastheermembraan kunnen veroorzaken en/of experimentele artefacten kunnen veroorzaken, resulterend in onnauwkeurige gegevensinterpretatie (Bouvrais et al., 2010). Bovendien kan foto-geïnduceerde lipideperoxidatie ook leiden tot domeinvorming, zelfs in eenvoudige kleurstofsystemen. Dit proces kan resulteren in de vorming van grote vlotten en spontane facetvorming (Bouvrais et al., 2010). Langdurige blootstelling aan fluorescerend licht kan ook resulteren in bleken en verlies van fluorescentieintensiteit. Daarom zijn de keuze van fluorescente kleurstof en de ontwikkeling van nieuwe membraansondes belangrijke overwegingen bij het gebruik van fluorescentiemicroscopie (Klymchenko et al., 2009).
confocale microscopie
confocale scanmicroscopie is een vooruitgang op het gebied van de fluorescentiemicroscopie. In plaats van de volledige steekproef te verlichten, wordt een beeld gebouwd door één (of meer) geconcentreerde bundels van licht over de steekproef te scannen. Licht dat van het verlichte Monster terugkeert, gaat door een opening die buiten beeld licht van boven en onder het betrokken vlak afwijst; ervoor te zorgen dat alleen beelden van een kleine scherptediepte worden verkregen, sterk verbeteren van de out-of-plane resolutie (Bibi et al., 2011; Murphy and Davidson, 2012a). Met behulp van deze techniek, wordt een “z-stack” van beelden verzameld, vanaf de bovenkant van het blaasje gevolgd door beelden die in gedefinieerde z-stappen tot de bodem van het monster worden genomen, resulterend in een samengesteld 3D beeld van het monster (Bibi et al., 2011; Murphy and Davidson, 2012a). Confocal het aftastenmicroscopie is een aantrekkelijkere techniek over epifluorescent lichte microscopen toe te schrijven aan zijn superieure beeldhelderheid geworden. In het geval van GUVs, is deze techniek in staat om de interne structuur van de lipidesystemen te visualiseren, wat vaak niet mogelijk is met andere microscopiemethoden (Ruozi et al., 2011; Mertins and Dimova, 2013). Bijvoorbeeld, scheiding van de waterige en lipide bilayer fase kan duidelijk worden gevisualiseerd in grotere blaasjes (Mertins en Dimova, 2013). Nochtans, is de confocale microscopie diffractie-beperkt en, daarom, niet in staat om high-definition beelden van SUV ‘ s of oligolamellar liposomen (Ruozi et al., 2011).
elektronenmicroscopie technieken
elektronenmicroscopie is een methode voor het visualiseren van blaasjes onder zeer hoge vergroting (Henry, 2005). Het wordt wijd gebruikt in de karakterisering van lipideblaasjes aangezien de elektronengolflengte (en vandaar diffractie-beperkte resolutie), vele orden van grootte lager is dan dat van optische microscopie, en daarom super-resolutie voor duidelijke visualisatie van kleine liposomes verstrekt (Bibi et al., 2011; Ruozi et al., 2011). Deze techniek gebruikt een bundel elektronen die op de oppervlakte van de steekproef door diverse elektromagnetische lenzen worden geconcentreerd. De elektronen worden dan verspreid door de steekproef, en worden dan opnieuw gericht en vergroot door een verdere reeks elektromagnetische lenzen in de weergavekolom om een geprojecteerd beeld te produceren (Henry, 2005). Er zijn een aantal verschillende types van elektronenmicroscopen, die elk een verschillende methode van de steekproefvoorbereiding vereisen.
Scanning Electron Microscopy (SEM)
Scanning electron microscopen (SEMs) maken gebruik van een elektronenbundel die over of over een monster wordt gescand (in plaats van door een monster) om een vergroot beeld van een object te produceren (Adler and Schiemann, 1985). Alder et al. eerst geprobeerd om SEM te gebruiken om liposomen in 1984 te karakteriseren (Adler en Schiemann, 1985). Zij toonden aan dat het gebruik van de vriesdroogmethode om de liposoommonsters voor SEM voor te bereiden, resulteerde in een groot deel van zichtbare klontjes en korstmateriaal (Adler en Schiemann, 1985). Meer recente studies hebben aangetoond dat de liposoomstructuur zelf verstoringen kan lijden als gevolg van de hoog-vacuüm Voorwaarden en kleuring processen vereist voor deze bereidingstechniek (Ruozi et al., 2011). SEM wordt nu niet algemeen gebruikt voor het analyseren van liposomen omdat het vereist dat de steekproef vóór weergave wordt gedroogd of wordt bevestigd (Ruozi et al., 2011). SEM kan echter algemene informatie verschaffen over de concentrische structuur van de verschillende lipidenlagen, evenals details geven over de grootte en de sferische morfologie van een preparaat (Nirale et al., 2009).Transmission Electron microscopy (tem) Transmission electron microscopy (tem) is de meest gebruikte beeldvormingsmethode voor de evaluatie van de structuur van nanodeeltjes (Henry, 2005; Kuntsche et al., 2011). Het gaat om de bereiding van een dun Monster (<100 nm dik) dat in een vacuümkamer wordt geplaatst. De elektronenstraal kruist de steekproef, waar het dan door de objectieve lens wordt geconcentreerd om een beeld te vormen. Tem kan gemakkelijk soft-matter monsters met een ruimtelijke resolutie tot ver onder 1 nm in grootte (Henry, 2005; Kuntsche et al ., 2011; Ruozi et al., 2011). Deze techniek kan verder worden gecategoriseerd op basis van de gebruikte steekproef-bereidingsmethode – in het bijzonder, negatief bevlekken, vorst–breuk en cryogene TEM. Het kan informatie over oppervlaktewijzigingen van nanoparticles verstrekken aangezien het beter contrast en contour van beelden dan andere microscopietechnieken verstrekt. Bijvoorbeeld, toonde de vervoeging van transferrin aan de oppervlakte van dspc/cholesterolliposomen een corpusculaire oppervlaktedeklaag met negatief-vlek TEM, die in de niet-geconjugeerde liposome voorbereidingen afwezig was (Anabousi et al., 2005). In een afzonderlijk experiment werden vóór de negatieve vlekprocedure specifieke antilichamen tegen humane transferrine toegevoegd om de identiteit van de coating van het deeltjesoppervlak te bevestigen (Anabousi et al., 2005). Daarom verstrekt TEM de mogelijkheid om veel-betere resolutie te bereiken wanneer het beoordelen van de vervoeging van ligands aan de oppervlakte van liposomes.
negatieve kleuring techniek
bij de monstervoorbereiding met negatieve kleuring wordt een kleine hoeveelheid gehydrateerd monster op een rooster geplaatst. Aangezien de blaasjes in direct contact zijn met het raster, kunnen hun oriëntatie en morfologie worden beïnvloed, en daarom moet hiermee rekening worden gehouden (Bibi et al., 2011). Het is ook noodzakelijk om de liposomen in te bedden in een geschikt elektron-dichte materiaal (bijv., zware metalen zouten zoals uranyl acetaat of fosfotungstic acid) dat zorgt voor een hoog contrast, zodat blaasjes kunnen worden bekeken tegen een donkere gekleurde achtergrond (Ruozi et al., 2011). De negatief-kleurende techniek is relatief snel en eenvoudig; nochtans, is het getoond om veranderingen in de originele liposoomstructuur te veroorzaken en kan tot de verwezenlijking van lichte en donkere franjes leiden die voor lamellaire structuren kunnen worden verward (Bibi et al., 2011; Ruozi et al., 2011). Bovendien kan het plaatsen van het monster onder vacuüm verdere uitdroging van het monster veroorzaken, wat opnieuw veranderingen in de structuur van de blaasjes kan veroorzaken (Bibi et al., 2011). Terwijl de negatief-vlek tem techniek veel hogere vergroting voor weergave nanoparticles kan verstrekken, maakt de schade aan de liposome structuur het moeilijk om de morfologische kenmerken van de steekproef nauwkeurig te evalueren. Daarom worden andere weergavetechnieken over het algemeen vereist om resultaten te bevestigen.
Vriesfractuur techniek
De vriesfractuur techniek vereist geen droogproces en kan aanvullende informatie verschaffen over de interne structuur van nanodeeltjes (Kuntsche et al., 2011). Deze methode houdt in het plaatsen van een monster op een tem raster dat is ingeklemd tussen twee koper of goud houders (Severs, 2007). Het monster wordt verglaasd via snel invriezen, meestal met vloeibaar propaan of vloeibare stikstof, alvorens te worden gebroken langs gebieden van het monster met zwakke moleculaire interacties. Dit breukvlak kan verder geëtst en geschaduwd worden met een dunne platina-of koolstoflaag om een “negatieve” replica van het breuksteekplaatsvliegvlak te verschaffen (Severs, 2007; Kuntsche et al., 2011). De replica wordt dan gereinigd met een organisch oplosmiddel om alle residuen vóór visualisatie onder een tem microscoop te verwijderen. Omdat deze replica ‘ s zo stabiel zijn, kunnen ze later worden opgeslagen en bekeken (Kuntsche et al., 2011). Het belangrijkste voordeel van deze techniek is dat de replica ‘ s nauw de inheemse staat van de steekproef weerspiegelen, en gedetailleerde informatie over de 3D structuur van de blaasjes en de bilayer organisatie (Bibi et al., 2011; Kuntsche et al., 2011). Deze informatie omvat de multilamellaire constructie en de bilaagverpakking van multilamellaire blaasjes. Deze techniek kan gezamenlijke grootte ook beoordelen en kan bijzonder nuttig zijn voor het onderzoeken van de interactie van kationische liposomen met DNA (Bibi et al., 2011). Artefacten kunnen echter nog steeds voorkomen in het monster tijdens de bereiding als gevolg van onvoldoende vriessnelheid, herdepositie van oplosmiddelmoleculen en / of mechanische belasting (Severs, 2007; Kuntsche et al., 2011). Bijvoorbeeld, een “kabbelende effect” kan optreden op de SUV ‘ s in het monster (Bibi et al., 2011). Dit is een gemeenschappelijke dubbellagige misvorming die te wijten is aan een wanorde in de overgangen van de acylketens voorafgaand aan het bevriezen. Incuberen blaasjes tussen de pre-overgang en de werkelijke overgangstemperatuur kan ook rimpelingen veroorzaken (Bibi et al., 2011). Interessant, kan dit worden gebruikt om informatie in de overgangen van de lipidefase te verstrekken die met de variërende aard van lipiden voorkomen die voor liposomale voorbereidingen worden gebruikt (Bibi et al., 2011).
cryogene tem
cryogene tem (cryo-TEM) is een variatie op tem waarbij dunne waterige gehydrateerde films die in vloeibaar ethaan worden verglaasd, worden gebruikt voorafgaand aan beeldvorming. Deze techniek staat voor de analyse van liposomes in hun meest inheemse staat toe, en is een waardevol hulpmiddel om de grootte, vorm, interne structuur, en lamellariteit van liposomes te bepalen (Weisman et al., 2004; Bibi et al., 2011; Kuntsche et al., 2011). Het belangrijkste voordeel van het snel bevriezen van liposome steekproeven is het minimaliseren van de vorming van ijskristallen en het bewaren van proteã nen of andere materialen (Bibi et al., 2011; Kuntsche et al., 2011). Dit is gunstig wanneer de proteã nen of DNA binnen de nanoparticles zijn ingekapseld (Weisman et al., 2004; Kuntsche et al., 2011). Cryo-TEM is de nuttigste vorm van microscopie momenteel beschikbaar om liposomen te bestuderen, aangezien het problemen met chemische fixatie, uitdroging, knipsel en het bevlekken vermijdt-die allen de morfologie van blaasjes kunnen beà nvloeden (Bibi et al., 2011). De resolutie bereik is ∼5 tot 500 nm, zoals gedefinieerd door de dikte van de film (Almgren et al., 2000). Nochtans, zouden verscheidene beperkingen met deze techniek, met inbegrip van het feit moeten worden opgemerkt dat slechts een 2D beeld van 3D voorwerpen wordt verkregen (die over het algemeen ook op de meeste andere microscopietechnieken van toepassing is). Om deze beperking te overwinnen, reconstructie van 3D-vormen uit een voldoende groot aantal 2D-beelden van willekeurig georiënteerde niet-bolvormige deeltjes is mogelijk (Orlova et al., 1999), evenals het bekijken van het monster onder verschillende kantelhoeken om informatie te verkrijgen over 3D-vorm (van Antwerpen en Gilkey, 1994). Cryogene elektronentomografie (cryo-ET) kan in plaats daarvan ook worden gebruikt om 3D-beelden te verkrijgen (Le Bihan et al., 2009). Cryo-TEM gebruikt ook lagere doses elektronen, wat betekent dat het vaak een lagere resolutie heeft in vergelijking met andere methoden (Bibi et al., 2011; Kuntsche et al., 2011). Artefacten zijn nog steeds mogelijk als gevolg van de vorming van een dunne film van amorf ijs en het gebruik van bevlekken op het monster toe te passen afschuifkrachten tijdens de filmvorming (Almgren et al., 2000; Bibi et al., 2011).
Milieuscanning-elektronenmicroscopie (Esem)
Milieuscanning-elektronenmicroscopie (Esem) is een beeldvormingssysteem dat het gebruik van fixatie, kleuring of bevriezing van blaasjes niet vereist en dat dynamische veranderingen van natte systemen kan weergeven zonder voorafgaande monstervoorbereiding (Muscariello et al., 2005; Ruozi et al., 2011). Het belangrijkste kenmerk van ESEM is de aanwezigheid van waterdamp in de microscoopkamer. Het vermogen om een waterhoudende atmosfeer rond het monster te behouden die gedeeltelijk of zelfs volledig gehydrateerd kan zijn, wordt mogelijk gemaakt door het gebruik van een vacuümsysteem met meerdere diafragma ‘ s waarmee de beeldvormingskamer kan worden gehandhaafd bij druk tot 55 hPa (Bibi et al., 2011; Ruozi et al., 2011). De primaire elektronenstraal kan secundaire elektronen produceren die dan dampmolecules tegenkomen, die tot een cascade versterking van het signaal leiden alvorens de detector te bereiken. Hierdoor vereist ESEM geen monstervoorbereiding (Muscariello et al., 2005). Deze techniek zorgt voor variatie in de monsteromgeving door middel van een reeks druk, temperatuur en gassamenstellingen (Mohammed et al., 2004), die nuttig is bij het bepalen hoe milieuveranderingen de blaasjes beà nvloeden. Dit is van toepassing op nanofarmaceutische formulering en stabiliteit studies (Bibi et al., 2011). ESEM is ook gebruikt om druglading in het dubbellaag van liposomen te analyseren (Mohammed et al., 2004), evenals het bepalen van de grootte en vorm van blaasjes. Een beperking van ESEM is dat het geen gedetailleerde informatie kan verstrekken over de lamellariteit en interne architectuur van de nanoschaal structuren (Ruozi et al., 2011).
Atomic Force microscopy (AFM)
Atomic force microscopy (AFM), ook bekend als scanning-force microscopy (SFM), is een type scanning probe microscopie techniek. Het werkt door het uitvoeren van een scherpe punt bevestigd aan een cantilever en sensor over het oppervlak van een monster en het meten van de oppervlaktekrachten tussen de sonde en het monster (Sitterberg et al., 2010). Aangezien de cantilever langs de steekproefoppervlakte loopt, beweegt het op en neer toe te schrijven aan de oppervlakteeigenschappen en de cantilever buigt dienovereenkomstig af. Deze afbuiging wordt meestal gekwantificeerd met behulp van een optische sensor, waarbij de laserstraal wordt gereflecteerd op de achterkant van de cantilever op de lichtdetector (Sitterberg et al., 2010). AFM hoeft niet in een vacuüm te werken en kan in de omgevingslucht of onder vloeistof werken; daarom wordt het steeds meer gebruikt om biologische monsters en nanodeeltjes in beeld te brengen (Liang et al., 2004a, b; Ruozi et al., 2005, 2009). AFM heeft opmerkelijke resolutie in de Orde van fracties van een nanometer en kan een 3D beeld van liposomen samen met details over morfologie, grootteverdeling, homogeniteit, en stabiliteit verstrekken (Liang et al., 2004a, b; Ruozi et al., 2005, 2007, 2009). Belangrijk, kan AFM worden gebruikt om de oppervlaktewijzigingen van liposomes te karakteriseren en ligands (b.v., antilichamen en polymeren) te ontdekken vervoegd bij de Liposomal membraanoppervlakte (Bendas et al., 1999; Moutardier et al., 2003; Anabousi et al., 2005; Liang et al., 2005). Bijvoorbeeld, Bendas et al. gebruikte AFM om de Liposomal membraangrens te vergroten en aan beeldtrimeric structuren, ongeveer 8-10 nm in diameter, die de koppeling van antilichamen IgG aan de liposome oppervlakte (Bendas et al vertegenwoordigde., 1999). De bevindingen toonden aan dat de doeltreffendheid van de techniek hoogst afhankelijk was van de gebruikte vervoegingsmethode, met antilichamen die direct aan de liposomale oppervlakte worden vervoegd die zichtbaar zijn met AFM (beperkte eiwitmobiliteit), in vergelijking met antilichamen in bijlage aan PEGKETENS. Het was suggestief dat de PEG-ketens een hoge eiwitmobiliteit veroorzaakten en daarom niet konden worden gescand (Bendas et al., 1999). Omgekeerd, toonden Anabousi et al aan dat de opname van gepegyleerde lipiden in de liposomen een sterische stabilisatie met liposomen veroorzaakte die een sferische vorm handhaven (Anabousi et al., 2005). De beelden van AFM van de oppervlakte van unconjugated liposomes waren vlot en geen structuren konden worden waargenomen, terwijl de vervoeging van transferrin aan de oppervlakte van gepegyleerde liposomes als kleine bolvormige structuren werden gevisualiseerd (Anabousi et al., 2005). Op dezelfde manier, Moutardier et al vervaardigd liposomen met polymere kernen (LSP) die bestond uit geneesmiddelen geladen in polymere deeltjes die de kern van lipide blaasjes vormden (Moutardier et al., 2003). Beelden genomen met behulp van AFM toonde de aanwezigheid van een polymeer netwerk op het buitenoppervlak, die suggereerde dat de collageen polymere kern uitgestraald en vormde een oppervlaktelaag op de LSP (Moutardier et al., 2003). Naast oppervlaktestructuurdetails kan de AFM door krachtmetingen informatie verschaffen over de mechanische en chemische eigenschappen van een monsteroppervlak (Ruozi et al., 2007). Bijvoorbeeld, Mao et al. gebruikte deze techniek om de elasticiteit en klevende eigenschappen van liposomen (Mao et al., 2004). Een beperking van de AFM is de noodzaak om nanodeeltjes te adsorberen op draagvlakken, zoals mica of silicium wafers. De adsorptie van liposomes op een stevig substraat heeft het potentieel om de grootte en vorm van de blaasjes te wijzigen, en hun het afvlakken veroorzaken. (Ruozi et al., 2007). Bovendien kan het periodieke contact van het indringende uiteinde liposomes slepen aangezien het zich over de blaasjes in een steekproef beweegt (Jass et al., 2000). Ondanks dit, is AFM nog een nuttig hulpmiddel in de evaluatie van liposomes.
conclusie
Er is een breed scala van beeldvormingstechnieken beschikbaar voor het evalueren van de morfologie van liposomen, met elk zijn eigen voor-en nadelen. De lichte microscopie kan algemene details betreffende de grootte en de vorm van Grotere blaasjes en de homogeniteit van een steekproef op een vrij snelle manier verstrekken. Omgekeerd, is TEM de meest meestal gebruikte techniek om de morfologie van liposomes in veel meer detail te onderzoeken; bij de interpretatie van de resultaten moet echter rekening worden gehouden met de mogelijkheid van structurele veranderingen bij elk tem-subtype als gevolg van kleuring en/of blootstelling aan vacuümomstandigheden. ESEM is het nuttigst wanneer het bepalen van liposomal veranderingen in reactie op het milieu, terwijl AFM als nuttige methode in de morfologische analyse van nanoparticles tevoorschijn komt en maximumresolutie van de Liposomal oppervlakte verstrekt. Zowel AFM als TEM zijn geschikt voor weergave ligands die aan de oppervlakte van liposomes worden vervoegd en verstrekken aanvullende informatie over oppervlaktewijzigingen. Over het geheel genomen is de keuze van de techniek afhankelijk van welke morfologische kenmerken en mate van detail vereist zijn. Bovendien, is het begrijpen van de potentiële gevolgen van de methode van de steekproefvoorbereiding van elke weergavetechniek belangrijk in het selectieproces.
Auteursbijdragen
redactie van manuscript: A-LR en SH. Herziening van het artikel kritisch voor belangrijke intellectuele inhoud: SH, PD, JF, WP, AM, DS en AW.
belangenconflict verklaring
De auteurs verklaren dat het onderzoek werd uitgevoerd zonder enige commerciële of financiële relatie die als een potentieel belangenconflict kon worden opgevat.de auteurs danken De Pharmacy Research Trust of New South Wales, De Rebecca L. Cooper Medical Research Foundation, De Gladys M. Brawn Fellowship, de Ausee Research Foundation en de Universiteit van Newcastle voor hun financiële steun aan ons onderzoek.
Adler, K., and Schiemann, J. (1985). Karakterisatie van liposomen door scanning elektronenmicroscopie en de bevriezen-breuk techniek. Micron Microsc. Acta 16, 109-113. doi: 10.1016/0739-6260(85)90039-5
CrossRef Full Text / Google Scholar
Almgren, M., Edwards, K., and Karlsson, G. (2000). Cryo transmissie elektronenmicroscopie van liposomen en verwante structuren. Colloïden Surfen. Een Fysicochem. Eng. ASP. 174, 3–21. doi: 10.1016/S0927-7757(00)00516-1
CrossRef Full Text/Google Scholar
Anabousi, S., Laue, M., Lehr, C. M., Bakowsky, U., and Ehrhardt, C. (2005). Beoordeling van transferrin modificatie van liposomen door atomaire krachtmicroscopie en transmissie elektronenmicroscopie. Euro. J. Pharm. Biopharm. 60, 295–303. doi: 10.1016 / j.ejpb.2004.12.009
PubMed Abstract / CrossRef Full Text / Google Scholar
Bagatolli, L. A. (2009). Membranen en fluorescentiemicroscopie. Beoordelingen in fluorescentie 2007. New York, NY: Springer, 33-51. doi: 10.1007 / 978-0-387-88722-7_2
CrossRef Full Text / Google Scholar
Bakker-Woudenberg, I. A., Storm, G., and Woodle, M. C. (1994). Liposomen bij de behandeling van infecties. J. Drug Doelwit. 2, 363–371. doi: 10.3109 / 10611869408996811
PubMed Abstract / CrossRef Full Text / Google Scholar
Bendas, G. (2001). Immunoliposomes: een veelbelovende benadering van het richten van kankertherapie. BioDrugs 15, 215-224. doi: 10.2165 / 00063030-200115040-00002
CrossRef Full Text / Google Scholar
Bendas, G., Krause, A., Bakowsky, U., Vogel, J., and Rothe, U. (1999). Targetability van nieuwe immunoliposomen bereid door een nieuwe antilichaamconjugatietechniek. Int. J. Pharm. 181, 79–93. doi: 10.1016 / S0378-5173 (99)00002-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Bibi, S., Kaur, R., Henriksen-Lacey, M., McNeil, S. E., Wilkhu, J., Lattmann, E., et al. (2011). Microscopie beeldvorming van liposomen: van coverslips aan milieu SEM. Int. J. Pharm. 417, 138–150. doi: 10.1016 / j. ijpharm.2010.12.021
PubMed Abstract / CrossRef Full Text / Google Scholar
Bouvrais, H., Pott, T., Bagatolli, L. A., Ipsen, J. H., and Meleard, P. (2010). Effect van membraan-verankerde fluorescente sondes op de mechanische eigenschappen van lipide bilagen. Biochim. Biophys. Acta 1798, 1333-1337. doi: 10.1016 / j. bbamem.2010.03.026
PubMed Abstract / CrossRef Full Text / Google Scholar
Cullis, P. R., Chonn, A., and Semple, S. C. (1998). Interacties van liposomen en op lipiden gebaseerde dragersystemen met bloedeiwitten: relatie tot klaringsgedrag in vivo. ADV. Drug Deliv. Rev. 32, 3-17. doi: 10.1016 / S0169-409X (97) 00128-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Ding, B. S., Dziubla, T., Shuvaev, V. V., Muro, S., and Muzykantov, V. R. (2006). Geavanceerde geneesmiddelenafgiftesystemen die gericht zijn op het vasculaire endotheel. Mol. Interv. 6, 98–112. doi: 10.1124 / mi.6.2.7
PubMed Abstract / CrossRef Full Text / Google Scholar
Henry, C. R. (2005). Morfologie van ondersteunde nanodeeltjes. Prog. Surf. Sci. 80, 92–116. doi: 10.1016 / j.progsurf.2005.09.004
CrossRef Full Text/Google Scholar
Hua, S. (2013). Het richten van plaatsen van ontsteking: intercellulaire adhesiemolecuul-1 als doel voor nieuwe inflammatoire therapieën. Voorkant. Farmacol. 4:127. doi: 10.3389 / fphar.2013.00127
PubMed Abstract / CrossRef Full Text / Google Scholar
Hua, S., Marks, E., Schneider, J. J., and Keely, S. (2015). Vooruitgang in orale Nano-delivery systemen voor colon gerichte drug levering in inflammatoire darmziekte: selectief gericht op ziek versus gezond weefsel. Nanomedicine 11, 1117-1132. doi: 10.1016 / j. nano.2015.02.018
PubMed Abstract / CrossRef Full Text / Google Scholar
Hua, S., and Wu, S. Y. (2013). Het gebruik van op lipide-gebaseerde nanocarriers voor gerichte pijntherapieën. Voorkant. Farmacol. 4:143. doi: 10.3389 / fphar.2013.00143
PubMed Abstract / CrossRef Full Text / Google Scholar
Ishida, T., Harashima, H., and Kiwada, H. (2001). Interacties van liposomen met cellen in vitro en in vivo: opsonins and receptors. Curr. Drug Metab. 2, 397–409. doi: 10.2174/1389200013338306
PubMed Abstract | CrossRef Full Text | Google Scholar
Jass, J., Tjarnhage, T., and Puu, G. (2000). From liposomes to supported, planar bilayer structures on hydrophilic and hydrophobic surfaces: an atomic force microscopy study. Biophys. J. 79, 3153–3163. doi: 10.1016/S0006-3495(00)76549-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Klymchenko, A. S., Oncul, S., Didier, P., Schaub, E., Bagatolli, L., Duportail, G., et al. (2009). Visualisatie van lipidendomeinen in gigantische unilamellaire blaasjes met behulp van een omgevingsgevoelige membraansonde op basis van 3-hydroxyflavon. Biochim. Biophys. Acta 1788, 495-499. doi: 10.1016 / j. bbamem.2008.10.019
PubMed Abstract / CrossRef Full Text / Google Scholar
Kuntsche, J., Horst, J. C., and Bunjes, H. (2011). Cryogene transmissie elektronenmicroscopie (cryo-TEM) voor het bestuderen van de morfologie van colloïdale systemen van de druglevering. Int. J. Pharm. 417, 120–137. doi: 10.1016 / j. ijpharm.2011.02.001
PubMed Abstract / CrossRef Full Text / Google Scholar
Le Bihan, O., Bonnafous, P., Marak, L., Bickel, T., Trepout, S., Mornet, S., et al. (2009). Cryo-elektron tomografie van nanoparticle transmigratie in liposome. J. Struct. Biol. 168, 419–425. doi: 10.1016 / j.jsb.2009.07.006
PubMed Abstract / CrossRef Full Text / Google Scholar
Liang, X., Mao, G., and Ng, K. Y. (2004a). Mechanische eigenschappen en stabiliteitsmeting van cholesterol-bevattende liposoom op mica door atomaire krachtmicroscopie. J. Colloid Interface Sci. 278, 53–62.
PubMed Abstract / Google Scholar
Liang, X., Mao, G., and Ng, K. Y. (2005). Effect van kettinglengtes van PEO-PPO-PEO op kleine unilamellaire liposoommorfologie en stabiliteit: een onderzoek van de AFM. J. Colloid Interface Sci. 285, 360–372. doi: 10.1016 / j. jcis.2004.11.042
PubMed Abstract / CrossRef Full Text / Google Scholar
Liang, X., Mao, G., and Simon Ng, K. Y. (2004b). Het onderzoeken van kleine unilamellaire Eierpc blaasjes op mica oppervlak door atomic force microscopy. Colloïden Surfen. B Biointerfaces 34, 41-51.
PubMed Abstract / Google Scholar
Mao, G., Liang, X., and Ng, K. Y. S. (2004). Encyclopedia of Nanoscience and nanotechnologie. New York, NY: Marcel Dekker.
Google Scholar
Mastrobattista, E., Koning, G. A., and Storm, G. (1999). Immunoliposomes voor de gerichte levering van antitumordrugs. ADV. Drug Deliv. Rev. 40, 103-127. doi: 10.1016/S0169-409X (99)00043-5
CrossRef Full Text | Google Scholar
Mertins, O., and Dimova, R. (2013). Inzichten over de interacties van chitosan met fosfolipide blaasjes. Deel II: membraanstijfheid en porievorming. Langmuir 29, 14552-14559. doi: 10.1021 / la4032199
PubMed Abstract | CrossRef Full Text/Google Scholar
metselaar, J. M., and Storm, G. (2005). Liposomen bij de behandeling van inflammatoire aandoeningen. Expert Opin. Drug Deliv. 2, 465–476. doi: 10.1517 / 17425247.2.3.465
PubMed Abstract / CrossRef Full Text / Google Scholar
Mohammed, A. R., Weston, N., Coombes, A. G., Fitzgerald, M., and Perrie, Y. (2004). Liposoomformulering van slecht in water oplosbare geneesmiddelen: optimalisatie van het laden van geneesmiddelen en Esem-analyse van de stabiliteit. Int. J. Pharm. 285, 23–34. doi: 10.1016 / j. ijpharm.2004.07.010
PubMed Abstract / CrossRef Full Text / Google Scholar
Moutardier, V., Tosini, F., Vlieghe, P., Cara, L., Delpero, J. R., and Clerc, T. (2003). Biologische beschikbaarheid in modellen voor orale toediening. Int. J. Pharm. 260, 23–38. doi: 10.1016 / S0378-5173 (03)00231-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Murphy, D. B., and Davidson, M. W. (2012a). Confocale Laserscanning Microscopie. De lichtmicroscopie en elektronische beeldvorming, 2nd Edn. Hoboken, NJ: John Wiley & Sons, 265-305. doi: 10.1002 / 9781118382905. ch13
CrossRef Full Text / Google Scholar
Murphy, D. B., and Davidson, M. W. (2012b). Fluorescentiemicroscopie. Grondbeginselen van lichtmicroscopie en elektronische weergave. Weinheim: John Wiley & Sons, 199-231. doi: 10.1002 / 9781118382905. ch11
CrossRef Full Text / Google Scholar
Murphy, D. B., and Davidson, M. W. (2012c). Grondbeginselen van lichtmicroscopie en elektronische weergave. Hoboken, NJ: John Wiley & Sons, 1-19. doi: 10.1002 / 9781118382905
CrossRef Full Text / Google Scholar
Murphy, D. B., and Davidson, M. W. (2012d). Polarisatie Microscopie. Grondbeginselen van lichtmicroscopie en elektronische weergave. Hoboken, NJ: John Wiley & Sons, 153-171. doi: 10.1002 / 9781118382905. ch9
CrossRef Full Text / Google Scholar
Muscariello, L., Rosso, F., Marino, G., Giordano, A., Barbarisi, M., Cafiero, G., et al. (2005). Een kritisch overzicht van Esem-toepassingen op biologisch gebied. J. Cell. Fysiol. 205, 328–334. doi: 10.1002 / jcp.20444
PubMed Abstract / CrossRef Full Text / Google Scholar
Nallamothu, R., Wood, G. C., Pattillo, C. B., Scott, R. C., Kiani, M. F., Moore, B. M., et al. (2006). Een tumor vasculature gericht liposoom levering systeem voor combretastatine A4: ontwerp, karakterisering, en in vitro evaluatie. AAPS PharmSciTech 7: E32. doi: 10.1208 / pt070232
PubMed Abstract / CrossRef Full Text / Google Scholar
Nirale, N. M., Vidhate, R. D., and Nagarsenker, M. S. (2009). Fluticasonpropionaat liposomen voor pulmonale levering. Indian J. Pharm. Sci. 71, 709–711.
Google Scholar
Orlova, E. V., Sherman, M. B., Chiu, W., Mowri, H., Smith, L. C., and Gotto, A. M. Jr. (1999). Three-dimensional structure of low density lipoproteins by electron cryomicroscopy. Proc. Natl. Acad. Sci. U.S.A. 96, 8420–8425. doi: 10.1073/pnas.96.15.8420
CrossRef Full Text | Google Scholar
Ruozi, B., Belletti, D., Tombesi, A., Tosi, G., Bondioli, L., Forni, F., et al. (2011). AFM, ESEM, TEM, and CLSM in liposomal characterization: a comparative study. Int. J. Nanomedicine 6, 557–563. doi: 10.2147/IJN.S14615
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruozi, B., Tosi, G., Forni, F., Fresta, M., and Vandelli, M. A. (2005). Atomaire krachtmicroscopie en foton correlatie spectroscopie: twee technieken voor snelle karakterisering van liposomen. Euro. J. Pharm. Sci. 25, 81–89. doi: 10.1016 / j. ejps.2005.01.020
PubMed Abstract / CrossRef Full Text / Google Scholar
Ruozi, B., Tosi, G., Leo, E., and Vandelli, M. A. (2007). Toepassing van de atoomkrachtmicroscopie om liposomes als drug en gendragers te karakteriseren. Talanta 73, 12-22. doi: 10.1016 / j.talanta.2007.03.031
PubMed Abstract / CrossRef Full Text / Google Scholar
Ruozi, B., Tosi, G., Tonelli, M., Bondioli, L., Mucci, A., Forni, F., et al. (2009). AFM faseweergave van zacht-gehydrateerde steekproeven: een veelzijdig hulpmiddel om de chemisch-fysische studie van liposomen te voltooien. J. Liposome Res. 19, 59-67. doi: 10.1080 / 08982100802584071
PubMed Abstract / CrossRef Full Text / Google Scholar
Sawant, R. R., and Torchilin, V. P. (2012). Uitdagingen in de ontwikkeling van gerichte liposomale therapieën. AAPS J. 14, 303-315. doi: 10.1208 / s12248-012-9330-0
PubMed Abstract | CrossRef Full Text/Google Scholar
Senior, J. H. (1987). Lot en gedrag van liposomes in vivo: een overzicht van het controleren van factoren. Crit. Eerwaarde Ther. Drug Drager Syst. 3, 123–193.
PubMed Abstract/Google Scholar
Sercombe, L., Veerati, T., Moheimani, F., Wu, S. Y., Sood, A. K., en Hua, S. (2015). Vooruitgang en uitdagingen van liposome assisted drug delivery. Voorkant. Farmacol. 6:286. doi: 10.3389 / fphar.2015.00286
CrossRef Full Text | Google Scholar
Severs, N. J. (2007). Freeze-fracture electron microscopy. Nat. Protoc. 2, 547–576. doi: 10.1038/nprot.2007.55
PubMed Abstract | CrossRef Full Text | Google Scholar
Sitterberg, J., Ozcetin, A., Ehrhardt, C., and Bakowsky, U. (2010). Utilising atomic force microscopy for the characterisation of nanoscale drug delivery systems. Eur. J. Pharm. Biopharm. 74, 2–13. doi: 10.1016/j.ejpb.2009.09.005
PubMed Abstract / CrossRef Full Text / Google Scholar
Torchilin, V. P. (1994). Immunoliposomen en gepegyleerde immunoliposomen: mogelijk gebruik voor gerichte levering van beeldvormende agenten. Immunomethods 4, 244-258. doi: 10.1006 / immu.1994.1027
PubMed Abstract / CrossRef Full Text / Google Scholar
van Antwerpen, R., and Gilkey, J. C. (1994). Cryo-elektronenmicroscopie onthult menselijke lage dichtheidslipoproteã ne substructuur. J. Lipid Res. 35, 2223-2231.
PubMed Abstract | Google Scholar
Wang, X., Song, Y., Su, Y., Tian, Q., Li, B., Quan, J., et al. (2015). Are PEGylated liposomes better than conventional liposomes? A special case for vincristine. Drug Deliv. 29, 1–9. doi: 10.3109/10717544.2015.1027015
PubMed Abstract | CrossRef Full Text | Google Scholar
Weisman, S., Hirsch-Lerner, D., Barenholz, Y., and Talmon, Y. (2004). Nanostructure of cationic lipid-oligonucleotide complexes. Biophys. J. 87, 609–614. doi: 10.1529/biophysj.103.033480
PubMed Abstract / CrossRef Full Text / Google Scholar
Willis, M., and Forssen, E. (1998). Ligand-gerichte liposomen. ADV. Drug Deliv. Rev. 29, 249-271. doi: 10.1016/S0169-409X(97)00083-5
CrossRef Full Text/Google Scholar
Zununi Vahed, S., Salehi, R., Davaran, S., and Sharifi, S. (2017). Op liposoom-gebaseerde systemen van de drugcolevering in kankercellen. Takel. Sci. Eng. C Takel. Biol. Appl. 71, 1327–1341. doi: 10.1016/j.msec.2016.11.073
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply