Organische Chemie II

experimenteel wordt echter waargenomen dat er een significante rotatiebarrière is rond de C2-C3 binding, en dat het volledige molecuul vlak is. Daarnaast is de C2-C3 binding 148 pm lang, korter dan een typische koolstof-koolstof enkele binding (ongeveer 154 pm), hoewel langer dan een typische dubbele binding (ongeveer 134 pm).
moleculaire orbitaaltheorie verklaart deze waarnemingen met het concept van gedelokaliseerde pi-bindingen. In dit plaatje combineren de vier 2P atomaire orbitalen wiskundig tot vier pi moleculaire orbitalen van toenemende energie. Twee van deze – de bonding pi orbitalen – zijn lager in energie dan de P atomaire orbitalen waaruit ze worden gevormd, terwijl twee – de antibonding pi* orbitalen-hoger in energie zijn.

De laagste energie moleculaire orbitaal, pi1, heeft alleen constructieve interactie en nul knopen. Hoger in energie, maar nog steeds lager dan de geïsoleerde p orbitalen, heeft de pi2 orbitaal één knoop maar twee constructieve interacties – dus het is nog steeds een bindende orbitaal in het algemeen. Kijkend naar de twee antibondende orbitalen, pi3* heeft twee knopen en één constructieve interactie, terwijl pi4* drie knopen en nul constructieve interacties heeft.
volgens het aufbau principe worden de vier elektronen van de geïsoleerde 2PZ atomaire orbitalen in de binding pi1 en pi2 MO ‘ s geplaatst. Omdat pi1 constructieve interactie tussen C2 en C3 omvat, is er in het 1,3-butadieenmolecuul een graad van pi-binding interactie tussen deze twee koolstofatomen, die verantwoordelijk is voor de kortere lengte en de barrière tegen rotatie. Het beeld van de valentiebinding van 1,3-butadieen laat zien dat de twee pi-bindingen geïsoleerd zijn van elkaar, waarbij elk paar pi-elektronen in zijn eigen pi-bindingen ‘vastzitten’. De moleculaire orbitale theorie voorspelt echter (accuraat) dat de vier pi-elektronen tot op zekere hoogte zijn gedelokaliseerd, of ‘verspreid’, over het hele pi-systeem.

1,3-butadieen is het eenvoudigste voorbeeld van een systeem van geconjugeerde pi-bindingen. Om als geconjugeerd te worden beschouwd, moeten twee of meer pi – bindingen worden gescheiden door slechts één enkele binding-met andere woorden, er kan geen tussenliggende sp3-gehybridiseerde koolstof zijn, omdat dit het overlappende systeem van parallelle p-orbitalen zou verbreken. In de samenstelling hieronder worden bijvoorbeeld de C1-C2-en C3-C4-dubbele bindingen geconjugeerd, terwijl de C6-C7-dubbele bindingen geïsoleerd worden van de andere twee pi-bindingen door SP3-gehybridiseerde C5.

een zeer belangrijk concept om in gedachten te houden is dat er een inherente thermodynamische stabiliteit geassocieerd is met conjugatie. Deze stabiliteit kan experimenteel worden gemeten door de hydrogeneringswarmte van twee verschillende dienenen te vergelijken. (Hydrogenering is een reactietype waarover we veel meer zullen leren in hoofdstuk 15: in wezen is het het proces van het toevoegen van een waterstofmolecuul – twee protonen en twee elektronen – aan een P-binding). Wanneer de twee geconjugeerde dubbele bindingen van 1,3-pentadieen worden ‘gehydrogeneerd’om pentaan te produceren, komt er ongeveer 225 kJ vrij per mol gevormd pentaan. Vergelijk dat met de ongeveer 250 kJ / mol die vrijkomt wanneer de twee geïsoleerde dubbele bindingen in 1,4-pentadieen worden gehydrogeneerd, waardoor ook pentaan wordt gevormd.
de vorming van synthetische polymeren uit dienenen zoals 1,3-butadieen en isopreen wordt besproken in Paragraaf 18.5. Synthetische polymeren zijn grote moleculen die bestaan uit kleinere herhalende eenheden. U bent waarschijnlijk enigszins bekend met een aantal van deze polymeren; bijvoorbeeld polyethyleen, polypropyleen, polystyreen en poly(vinylchloride).

figuur 13.6: energiediagram voor de hydrogenering van 1,3-butadieen (niet op schaal).
aangezien de hydrogenering van 1,3-butadieen minder uitstoot dan de voorspelde hoeveelheid energie, moet de energie-inhoud van 1,3-butadieen lager zijn dan we hadden verwacht. Met andere woorden, 1,3-butadieen is stabieler dan de formule suggereert.
het geconjugeerde dieen is lager in energie: met andere woorden, het is stabieler. Over het algemeen zijn geconjugeerde pi-bindingen stabieler dan geïsoleerde pi-bindingen.
Hier is een energiediagram dat verschillende soorten bindingen vergelijkt met hun hydrogeneringswarmte (per mol) om de relatieve stabiliteit van elk molecuul te laten zien (1 kcal = 4,18 kJ). (Hoe lager de warmte van hydrogenering (per pi-binding), hoe stabieler de structuur is.)
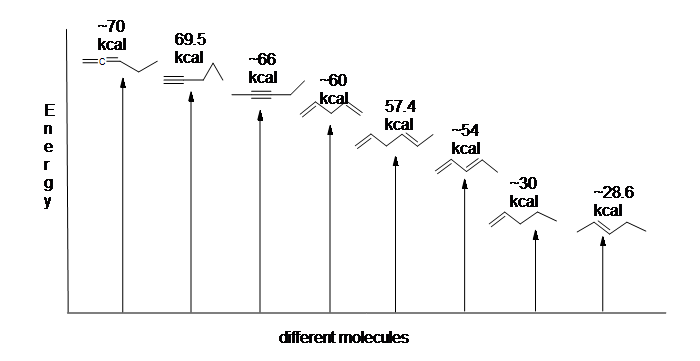
De stabilisatie van dienes door conjugatie is minder dramatisch dan de aromatische stabilisatie van benzeen. Niettemin kunnen soortgelijke resonantie-en moleculaire orbitale beschrijvingen van conjugatie worden geschreven.
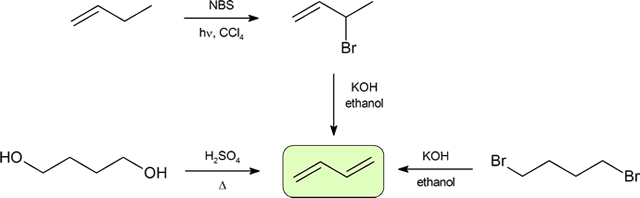
synthese van diënen
de twee meest voorkomende manieren om geconjugeerde diënen te synthetiseren zijn dehydratie van alcoholen en dehydrohalogenatie van organohaliden, die werden geïntroduceerd bij de bereiding van alkenen (paragraaf 9.9). Het volgende schema illustreert enkele van de routes naar het bereiden van een geconjugeerde diene.
geconjugeerde pi-systemen kunnen zowel zuurstof-en stikstofatomen als koolstof omvatten. In het metabolisme van vetmoleculen, impliceren enkele belangrijke reacties alkenen die aan carbonylgroepen worden geconjugeerd.

MO-theorie is zeer nuttig om uit te leggen waarom organische moleculen die uitgebreide systemen van geconjugeerde pi-bindingen bevatten vaak onderscheidende kleuren hebben. beta-caroteen, de verbinding die verantwoordelijk is voor de oranje kleur van wortelen, heeft een uitgebreid systeem van 11 geconjugeerde pi-bindingen.

oefeningen
oefening 2.9: Identificeer alle geconjugeerde en geïsoleerde dubbele bindingen in de onderstaande structuren. Specificeer voor elk geconjugeerd pi-systeem het aantal overlappende p-orbitalen en hoeveel pi-elektronen er onder worden gedeeld.
oefening 2.10: identificeer alle geïsoleerde en geconjugeerde pi-bindingen in lycopeen, de roodkleurige verbinding in tomaten. Hoeveel pi-elektronen zitten er in het geconjugeerde pi-systeem?

Leave a Reply