Virale latentie: Down but not out
wanneer u zich voorstelt dat virussen zich verbergen voor uw immuunsysteem, kunt u denken aan het herpes simplex virus, verantwoordelijk voor koortsblaasjes en genitale herpes, of het varicella-zoster virus, dat gordelroos veroorzaakt. Deze virussen kunnen tientallen jaren aanhouden in een winterslaap-achtige toestand die bekend staat als latentie en detectie door ons immuunsysteem vermijden (Kennedy et al., 2015). Latente virussen kunnen soms ontwaken en opnieuw beginnen te repliceren, symptomen veroorzaken en infectie verspreiden (Lieberman, 2016).
het humaan immunodeficiëntievirus (HIV) is eveneens een meester ontsnappingsartiest. Het vormt een latent reservoir vroeg in infectie, waardoor het virus om het immuunsysteem te ontwijken en te overleven op lange termijn. Mensen met HIV nemen dagelijks geneesmiddelen die bekend staan als antiretrovirale combinatietherapie (of ART) om te voorkomen dat het virus zich vermenigvuldigt. Kunst is echter geen remedie, omdat het zich niet richt op virussen die al latent zijn. Deze geneesmiddelen worden daarom gegeven voor het leven van een individu: het stoppen van de behandeling, zelfs voor een paar weken, zal de latente virussen in staat stellen om actieve infectie te reactiveren en opnieuw aan te wakkeren. Mensen met HIV kunnen verwachten een lang, gezond leven te hebben als gevolg van kunst, maar latente virussen zullen altijd aanwezig zijn in hun lichaam.
het vinden van een geneesmiddel voor HIV vereist de mogelijkheid om het latente virale reservoir te elimineren of onder controle te houden. Om dit doel te bereiken moeten echter nog enkele belangrijke kwesties worden aangepakt. Hoe, wanneer en waar stelt HIV latentie vast? Wat is de grootte van het latente reservoir, en de beste manier om het te meten? Wat activeert latente virussen om te reactiveren? Nu, in eLife, Miles Davenport, Brandon Keele en collega ‘ s van de Universiteit van New South Wales en het Frederick National Laboratory for Cancer Research – met inbegrip van Mykola Pinkevych als eerste auteur – verslag wanneer het latente reservoir is gevestigd in een niet-menselijke primaat model van HIV en hoeveel van het reservoir kan worden gereactiveerd (Pinkevych et al., 2019).
in dit onderzoek infecteerde het team resusapen met simian immunodeficiency virus (SIV), een voorloper virus dat endemisch is bij Afrikaanse apen en genetisch vergelijkbaar is met HIV (Williams and Burdo, 2009). Op een gegeven moment tijdens de 20e eeuw, SIV sprong van niet-menselijke primaten in de mens; deze cross-species overdracht gebeurtenis, in combinatie met een snelle evolutie, kon het virus efficiënt te verspreiden in mensen en de aanhoudende HIV pandemie te creëren (Keele et al., 2006).
Pinkevych et al. begon met het infecteren van resusapen met een ontworpen SIV die meer dan 10.000 unieke gerandomiseerde sequenties van DNA bevat; eenmaal gesequenced, laten deze ‘barcodes’ individuele virussen toe om te worden geïdentificeerd (Fennessey et al., 2017). De apen werden daarna 4, 10 of 27 dagen na de infectie met antiretrovirale therapie behandeld. Deze intervallen simuleren acute (4 dagen), vroege (10 dagen) of late interventie (27 dagen) met ART bij de mens. De medicijnen werden ongeveer een jaar gegeven en het virus werd bij alle dieren volledig onderdrukt. De behandeling werd daarna gestopt en het latente virus kon opnieuw activeren. Met behulp van genetische sequencing en wiskundige modellering, bepaalde het team de grootte van het latente reservoir van SIV en hoe het zou reactiveren.
bij de apen blokkeerde het starten van de behandeling vier dagen na de infectie de vorming van het latente reservoir niet, maar verminderde de grootte ervan met ongeveer 100-voudig in vergelijking met latere ART-initiatie. Evenzo, mensen die kunst beginnen binnen enkele dagen na het verwerven van HIV hebben een extreem klein reservoir in vergelijking met degenen die later beginnen met de behandeling (Luzuriaga et al., 2015; Henrich et al., 2017). Ondanks deze grote verschillen in totale reservoirgrootte, reactiveerden de latente virussen na stopzetting van ART in gelijke mate bij acute, vroeg-en laatbehandelde dieren (figuur 1). Pinkevych et al. concludeer daarom dat de meerderheid van virussen die het potentieel hebben om te reactiveren latency vroeg na besmetting vestigen.
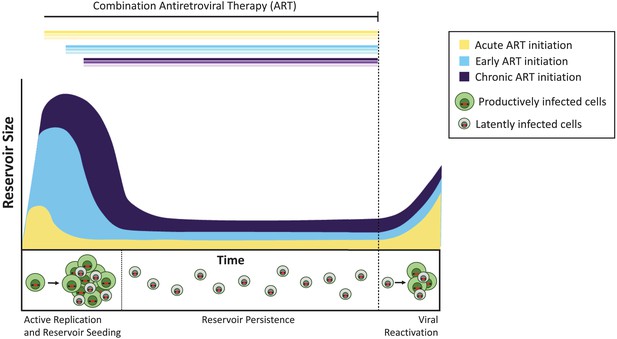
het tijdstip van antiretrovirale therapie beïnvloedt de grootte van het latente reservoir.
zonder behandeling creëren cellen die zijn geïnfecteerd met actief replicerend virus (productief geïnfecteerde cellen; weergegeven in groen) infectieuze virussen. Een minderheid van geïnfecteerde cellen bevat virussen die voor onbepaalde tijd als latent reservoir (latent geïnfecteerde cellen; getoond in grijs) kunnen blijven bestaan, en deze virussen kunnen potentieel op een later tijdstip worden gereactiveerd. Behandeling toegediend tijdens de acute fase van de infectie (dat wil zeggen, binnen dagen of weken na de primaire infectie; gele curve) resulteert in een kleiner latent reservoir dan wanneer de behandeling vroeg wordt gestart (binnen zes maanden na de infectie, lichtblauw) of tijdens chronische infectie (meer dan 6 maanden na de infectie, violet). Als de behandeling wordt gestopt (stippellijn), reactiveert het virus vanuit deze reservoirs op vergelijkbare niveaus om actieve infectie weer aan te wakkeren en het latente reservoir opnieuw te zaaien.
om te onderzoeken waarom het tijdstip van de behandeling De snelheid van reactivering niet leek te beïnvloeden, heeft het team het niveau van genetische mutaties in de latente virussen gemeten. Als virussen zich ophopen meer schadelijke mutaties hoe langer ze actief repliceren in het lichaam, dit zou suggereren dat dieren die vertraagde ART kunnen dragen een groter aandeel van latente virussen die defect zijn en niet kunnen ontwaken. Het team vond echter dat de meerderheid van de virussen (meer dan 80%) genetisch intact waren bij alle dieren, ongeacht wanneer de behandeling begon. Dit is heel anders dan wat er gebeurt met HIV-infectie bij de mens, waar de meeste van de latente virussen bevatten belangrijke genetische mutaties en deleties, waardoor slechts een kleine fractie (tussen 2% en 11%) die in staat zijn om reactivatie (Ho et al., 2013; Bruner et al., 2019).
een recente studie, die de dynamiek van het HIV-reservoir evalueerde bij mensen met stabiele ART, identificeerde een andere discrepantie tussen dit SIV-model en HIV-latentie bij mensen. Ondanks de voortdurende ART, kan latente HIV soms spontaan reactiveren en de virussen worden detecteerbaar in het bloed voor een korte tijd. Bij de mens zijn deze virale ‘blips’ fylogenetisch gekoppeld aan een viraal reservoir dat niet alleen bij de eerste infectie is vastgesteld, maar over jaren van onbehandelde infectie (Jones et al., 2018). De redenen die aan deze verschillen ten grondslag liggen worden niet goed begrepen en vormen belangrijke gebieden voor lopend onderzoek.
ondanks verschillen tussen niet-humane primatenmodellen en menselijke HIV-infectie, is het werk van Pinkevych et al. bevestigt dat virale latentie zeer vroeg na infectie wordt vastgesteld. Deze resultaten wijzen erop dat antiretrovirale therapie zo snel mogelijk moet worden gestart om de HIV-infectie onder controle te houden en de omvang van het latente reservoir te verminderen. Er is nog veel onbekend over hoe HIV-latentie wordt vastgesteld en gehandhaafd, vooral tijdens de behandeling; SIV-modellen zullen echter een belangrijk hulpmiddel blijven om te begrijpen hoe het latente reservoir kan worden uitgeroeid.
Leave a Reply