7.2: chymotrypsyna
wprowadzenie
chymotrypsyna jest jednym z najlepiej przebadanych enzymów ze względu na jej dwufazową kinetykę: pre-steady-state i steady state. Badanie tych dwóch stanów kinetycznych daje dowody na mechanizm „Ping-ponga”, powstawanie kompleksów kowalencyjnych prowadzących do reakcji hydrolizy kowalencyjnej oraz szybkość reakcji katalizowanych. Synteza chymotrypsyny zachodzi głównie w trzustce. Zamiast aktywnej postaci jest jednak wytwarzany jako nieaktywny zymogen zwany chymotrypsynogenem, aby zapobiec trawieniu trzustki przez aktywność proteazy. Po wydzielaniu do światła jelita cienkiego jest przekształcany do swojej aktywnej postaci przez inny enzym zwany trypsyną. Ta zależność od innego enzymu do aktywacji proteazy jest powszechnym sposobem dla organizmu, aby zapobiec trawieniu narządów i innym szkodliwym enzymatycznym skutkom ubocznym.
chymotrypsyna działa poprzez ogólny mechanizm znany jako mechanizm pingpongowy (rysunek \(\PageIndex{1}\)), w którym enzym reaguje z substratem tworząc enzym pośredni. Ten związek pośredni ma inne właściwości niż enzym początkowy, więc aby zregenerować początkową aktywność enzymatyczną, musi reagować z wtórnym substratem. Proces ten jest zilustrowany poniżej:

dokładniej rzecz ujmując, chymotrypsyna działa poprzez szczególny rodzaj mechanizmu pingpongowego zwanego hydrolizą kowalencyjną. Oznacza to, że enzym najpierw tworzy wiązanie kowalencyjne z docelowym substratem, wypierając bardziej stabilną cząsteczkę do roztworu. Ten kompleks enzymatyczno-substratowy nazywany jest enzymem pośrednim. Półprodukt reaguje następnie z wodą, która wypiera pozostałą część początkowego substratu i reformuje początkowy enzym.
chymotrypsyna, podobnie jak większość enzymów, jest specyficzna w rodzajach substratów, z którymi reaguje. Jako proteaza rozszczepia polipeptydy, a jej wrodzona swoistość pozwala jej działać tylko na karboksy-końcowy koniec reszt aromatycznych. Jest to dość skomplikowany mechanizm, który najlepiej wyjaśnić w szeregu kroków.
1. Cel wchodzi do aktywnego miejsca chymotrypsyny i jest tam utrzymywany przez hydrofobowe interakcje między odsłoniętymi niepolarnymi grupami reszt enzymatycznych i niepolarnym aromatycznym łańcuchem bocznym substratu. Ważne jest, aby zwrócić uwagę na wiązanie wodorowe między azotem Schiff na histydynie-57 a łańcuchem bocznym tlenu seryny-195.
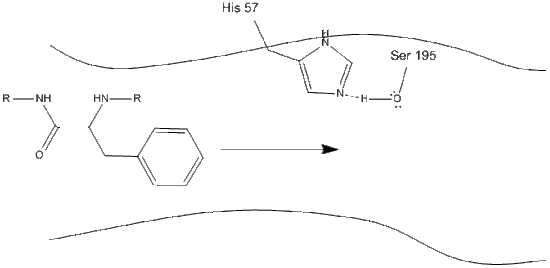
2. Wspomagany przez wiązanie wodorowe histydyna-seryna, grupa hydroksylowa na serynie-195 wykonuje atak nukleofilowy na węgiel karbonylowy aminokwasu aromatycznego, jednocześnie przenosząc Wodór hydroksylowy do azotu histydyny Schiff. Ten atak popycha elektrony karbonylowe pi na karbonylowy tlen, tworząc krótkotrwały związek pośredni składający się z C-końcowego węgla z czterema pojedynczymi wiązaniami: anion tlenowy, beta-węgiel aminokwasu aromatycznego, N-koniec kolejnego aminokwasu białka substratu i tlen łańcucha bocznego seryny-195.
.gif?revision=1&size=bestfit&width=720&height=192)
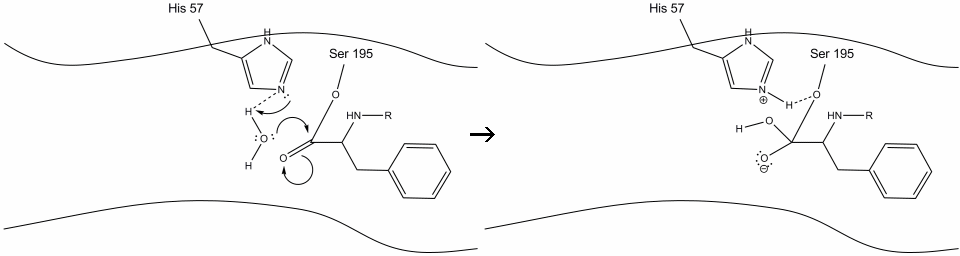
3. Ten związek pośredni jest krótkotrwały, ponieważ elektrony oksyanionowe reformują Wiązanie pi z C-końcem aminokwasu aromatycznego. Wiązanie między karboksy-końcem aminokwasu aromatycznego a n-końcem późniejszej reszty jest rozszczepiane, a jego elektrony są używane do ekstrakcji wodoru protonowanego azotu Schiffa na histydynie-57. Wiązania między węglem karbonylu a tlenem seryny-195 pozostają w konfiguracji estrowej. Nazywa się to acyl-enzym pośredni. C-końcowa strona polipeptydu może teraz swobodnie dysocjować z miejsca aktywnego enzymu.

4. Cząsteczki wody są teraz w stanie wejść i związać się z miejscem aktywnym poprzez wiązanie wodorowe między atomami wodoru w wodzie a azotem schiffowym histydyny-57.

5. Tlen w wodzie powoduje atak nukleofilowy na węgiel karbonylowy pośredniego enzymu acylowego, spychając elektrony pi karbonylu na węgiel karbonylu, ponieważ histydyna-57 ekstrahuje jeden proton z wody. Tworzy to inny czwartorzędowy węgiel kowalencyjnie związany z seryną, hydroksylem, oksyanionem i aminokwasem aromatycznym. Proton niedawno protonowanej histydyny-57 jest teraz w stanie wytworzyć wiązanie wodorowe z tlenem seryny.
6. Elektrony oksyanionowe reformują Wiązanie karbonylowe pi, rozszczepiając wiązanie między węglem karbonylowym a hydroksylem serynowym. Elektrony w tym wiązaniu są wykorzystywane przez tlen serynowy do deprotonacji histydyny azotu Schiff i reformowania pierwotnego enzymu. Substrat nie ma już powinowactwa do miejsca aktywnego i wkrótce oddziela się od kompleksu.

Leave a Reply