Chemia organiczna II

eksperymentalnie jednak obserwuje się, że istnieje znacząca bariera dla rotacji wokół wiązania C2-C3 i że cała cząsteczka jest planarna. Ponadto Wiązanie C2 – C3 ma długość 148 pm, jest krótsze niż typowe Wiązanie pojedyncze węgiel-węgiel (około 154 pm), choć dłuższe niż typowe wiązanie podwójne (około 134 pm).
teoria orbitali molekularnych opisuje te obserwacje z koncepcją zdelokalizowanych wiązań pi. Na tym zdjęciu cztery orbitale atomowe 2P łączą się matematycznie tworząc cztery orbitale cząsteczkowe pi o rosnącej energii. Dwa z nich-wiązające się orbitale pi-mają mniejszą energię niż orbitale atomowe P, z których są utworzone, podczas gdy dwa – antybondujące orbitale pi* – mają wyższą energię.

najniższy energetyczny orbital molekularny, pi1, ma tylko konstruktywne oddziaływanie i zerowe węzły. Wyższy pod względem energii, ale wciąż niższy od izolowanych orbitali p, orbital pi2 ma jeden węzeł, ale dwa konstruktywne oddziaływania-jest więc nadal orbitalem wiążącym. Patrząc na dwa antybondujące orbitale, pi3 * ma dwa węzły i jedną konstruktywną interakcję, podczas gdy pi4 * ma trzy węzły i zero konstruktywnych interakcji.
zgodnie z zasadą aufbau cztery elektrony z izolowanych orbitali atomowych 2PZ są umieszczone w wiązaniu pi1 i pi2 MO. Ponieważ pi1 zawiera konstruktywną interakcję między C2 i C3, w cząsteczce 1,3-butadienu istnieje stopień interakcji wiązania pi między tymi dwoma węglami, co stanowi jego krótszą długość i barierę dla rotacji. Obraz wiązania walencyjnego 1,3-butadienu pokazuje dwa wiązania pi jako izolowane od siebie, przy czym każda para elektronów pi „utknęła” w swoim wiązaniu pi. Jednak teoria orbitali molekularnych przewiduje (dokładnie), że cztery elektrony pi są do pewnego stopnia zdelokalizowane lub „rozłożone” w całym układzie pi.

1,3-butadien jest najprostszym przykładem układu sprzężonych wiązań pi. Aby można je było uznać za sprzężone, dwa lub więcej wiązań pi musi być oddzielonych tylko jednym wiązaniem – innymi słowy, nie może istnieć interferencyjny węgiel hybrydyzowany sp3, ponieważ rozbiłoby to nakładający się układ równoległych orbitali P. W związku poniżej, na przykład, podwójne wiązania C1-C2 i C3-C4 są sprzężone, podczas gdy podwójne wiązanie C6-C7 jest izolowane z pozostałych dwóch wiązań pi przez hybrydyzację C5 sp3.

bardzo ważną koncepcją, o której należy pamiętać, jest to, że istnieje nieodłączna stabilność termodynamiczna związana z koniugacją. Stabilność tę można zmierzyć eksperymentalnie, porównując ciepło uwodornienia dwóch różnych dienów. (Uwodornienie jest typem reakcji, o którym dowiemy się więcej w rozdziale 15: zasadniczo jest to proces dodawania cząsteczki wodoru – dwóch protonów i dwóch elektronów – do wiązania p). Gdy Dwa sprzężone wiązania podwójne 1,3-pentadienu są „uwodornione” w celu wytworzenia pentanu, uwalniane jest około 225 kJ na mol powstałego pentanu. Porównaj to z około 250 kJ / mol uwolnionym, gdy dwa izolowane wiązania podwójne w 1,4-pentadienu są uwodornione, tworząc również pentan.
tworzenie syntetycznych polimerów z dienów, takich jak 1,3-butadien i izopren omówiono w sekcji 18.5. Polimery syntetyczne to duże cząsteczki złożone z mniejszych powtarzalnych jednostek. Prawdopodobnie jesteś nieco zaznajomiony z wieloma tymi polimerami; na przykład polietylen, polipropylen, polistyren i poli(chlorek winylu).

rysunek 13.6: schemat energetyczny uwodornienia 1,3-butadienu (bez skali).
ponieważ uwodornienie 1,3-butadienu uwodornia mniej niż przewidywana ilość energii, zawartość energii 1,3-butadienu musi być niższa niż mogliśmy się spodziewać. Innymi słowy, 1,3-butadien jest bardziej stabilny niż sugeruje jego formuła.
sprzężony Dien ma mniejszą energię: innymi słowy jest bardziej stabilny. Ogólnie rzecz biorąc, sprzężone wiązania pi są bardziej stabilne niż izolowane wiązania pi.
oto schemat energetyczny porównujący różne typy wiązań z ich ciepłem uwodornienia (na mol), aby pokazać względną stabilność każdej cząsteczki (1 kcal = 4,18 kJ). (Im niższe ciepło uwodornienia (na Wiązanie pi), tym bardziej stabilna jest struktura.)
stabilizacja dienów przez koniugację jest mniej dramatyczna niż stabilizacja aromatyczna benzenu. Niemniej jednak można napisać podobne rezonansowe i molekularne opisy orbitali koniugacji.
synteza dienów
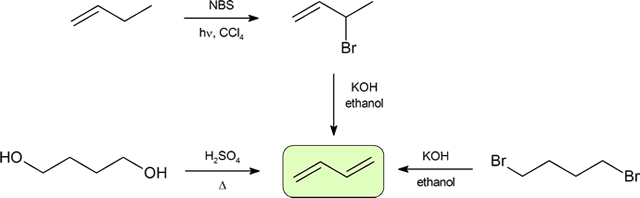
dwa najczęstsze sposoby syntezy sprzężonych dienów to odwodnienie alkoholi i dehydrohalogenacja metalohalidów, które zostały wprowadzone do wytwarzania alkenów (Punkt 9.9). Poniższy schemat ilustruje niektóre ze sposobów wytwarzania sprzężonego dienu.
sprzężone układy pi mogą obejmować atomy tlenu i azotu, a także węgiel. W metabolizmie cząsteczek tłuszczu, niektóre z kluczowych reakcji obejmują alkenów, które są sprzężone z grupami karbonylowymi.

teoria MO jest bardzo przydatna w wyjaśnianiu, dlaczego cząsteczki organiczne zawierające rozszerzone układy sprzężonych wiązań pi często mają charakterystyczne kolory. beta-karoten, związek odpowiedzialny za pomarańczowy kolor marchwi, ma rozszerzony system 11 sprzężonych wiązań pi.

ćwiczenia
ćwiczenie 2.9: Zidentyfikuj wszystkie sprzężone i izolowane wiązania podwójne w poniższych strukturach. Dla każdego sprzężonego układu pi określ liczbę nakładających się orbitali p i ile elektronów pi jest dzielonych między nimi.

ćwiczenie 2.10: zidentyfikuj wszystkie wyizolowane i sprzężone wiązania pi w likopenie, czerwonym związku w pomidorach. Ile elektronów pi jest zawartych w sprzężonym układzie pi?
Leave a Reply