co wpływa na wielkość grup, w których naczelne wybierają życie?

jednym z głównych teoretycznych wkładów dokonywanych przez badania naczelnych jest zrozumienie tego, co wpływa na naturę złożonej zmienności w strukturze społecznej i organizacji. Podstawą tego jest zestaw teoretycznych osiągnięć badających, dlaczego zwierzęta żyją w grupach w pierwszej kolejności i dlaczego grupy są określonej wielkości. Tutaj skupiamy się na pytaniu: „co wpływa na wielkość grup naczelnych, które wybierają do życia?”
naczelne są szczególnie przydatnymi taksonami do rozwiązania tego problemu, ponieważ ich wielkość grup jest bardzo zmienna, nie tylko wewnątrz, ale także między gatunkami. Wewnątrzspecyficzna wielkość grupy dla colobus (Procolobus rufomitratus), na przykład, waha się między 12 A 150 członków (Chapman & Chapman 2000A). Zmienność międzygatunkowa waha się od pojedynczego osobnika, jak widać u orangutanów (Pongo sp.) (van Schaik 1999), do ponad 800 członków w mandrylach (Mandrillus sphinx) (Abernethy et al. 2002). Ponadto w obrębie niektórych gatunków grupy społeczne wielokrotnie dzielą się i ponownie łączą w podgrupy o różnych rozmiarach i kombinacjach w czasie(np. rozszczepienie-fuzja społeczna małp pająków (Ateles sp.) i szympansy (Pan troglodytes), lub wielopoziomowa organizacja gelada (Theropithecus gelada)i pawiany Hamadryas (Papio hamadryas, Aureli et al. 2008). Ta zmienność stanowi podstawę dla naukowców do opracowania modeli w celu zbadania zarówno ekologicznych i społecznych czynników wielkości grupy.
grupowanie jest korzystne na kilka sposobów. Uważa się, że osoby w większych grupach mają zmniejszone ryzyko drapieżnictwa (Hamilton 1971), mogą być lepiej zdolne do znajdowania i obrony zasobów żywności (Cody 1971, Wrangham 1980) i mogą być chronione przed szczególnym zagrożeniem, takim jak dzieciobójstwo przez mężczyzn spoza grupy (Wrangham 1979). Różni badacze sugerują, że grupowanie daje takie przewidywalne korzyści (Alexander 1974, van Schaik 1983), że różnice w wielkości grupy można wyjaśnić wadami (Wrangham et al. 1993). Uważa się, że najbardziej powszechnie akceptowanym potencjalnym kosztem grupowania jest zmniejszenie wydajności żerowania. Przebywanie z innymi osobnikami o tych samych wymaganiach żywieniowych oznacza, że zwierzęta albo walczą o jedzenie (konkurs konkursowy), albo jedno zwierzę w grupie bije drugie z jedzeniem, więc kiedy drugie zwierzę przychodzi na obszar, po prostu nie ma już jedzenia (scramble competition, Janson & van Schaik 1988). W obu tych sytuacjach uważa się, że konkurencja o jedzenie prowadzi do tego, że zwierzęta muszą podróżować dalej. Logika tego argumentu jest stosunkowo prosta. Zwierzęta muszą żerować na obszarze, który może spełnić ich wymagania energetyczne i żywieniowe. Wynika z tego, że zwiększenie liczebności grupy zwiększy obszar, który musi zostać objęty, aby znaleźć odpowiednie zapasy żywności. Tak więc osoby muszą podróżować dalej i zużywać więcej energii, jeśli są w dużej grupie, niż Jeśli żerują w mniejszej grupie. Wraz ze wzrostem czasu spędzonego na podróżowaniu dochodzi do punktu, w którym energia zużywana w podróży jest zbyt kosztowna, a mniejsze grupy stają się korzystne. W ten sposób czynniki ekologiczne mogą wpływać na wzorce ruchu i wydajność żerowania, ograniczając tym samym wielkość grup, które mogą efektywnie wykorzystywać dostępne zasoby żywności. Koncepcje te zostały sformalizowane w modelu ograniczeń ekologicznych (Chapman & Chapman 2000B, Ganas & Robbins 2005, Snaith & Chapman 2007, Teichroeb & Sicotte 2009).
podstawowym elementem modelu ograniczeń ekologicznych jest to, że wzrost wielkości grupy musi prowadzić do wzrostu konkurencji w zakresie żywienia wewnątrz grupy. Można sobie wyobrazić, że działa to w nieco inny sposób w zależności od rodzaju zasobów wykorzystywanych przez poszczególne gatunki. W przypadku owocożernych i prawdopodobnie wielu liściastych naczelnych, które żywią się oddzielnymi łatami-zazwyczaj drzewami zawierającymi Artykuły spożywcze lub kępy drzew-dodatkowi członkowie grupy mogą szybciej wyczerpywać łatki i prowadzić do zwiększenia dziennych zakresów (Chapman 1988, Snaith & Chapman 2005). W przypadku bardziej owadożernych gatunków, których zasoby mogą nie występować w postaci dyskretnych plam, ciągła podróż przez baldachim w poszukiwaniu owadów z dodatkowymi członkami grupy może prowadzić do zwiększenia nakładania się poszczególnych pól wyszukiwania, zmniejszając na mieszkańca odsetek spotkań z żywnością, a tym samym zwiększając obszar, który musi być przeszukany (van Schaik et al. 1983).
więc model ograniczeń ekologicznych sugeruje, że te czynniki, które wpływają na odległość, którą podróżują zwierzęta, powinny również wpływać na wielkość grupy. Dla tych zwierząt, które zazwyczaj żywią się owocami lub liśćmi, które mogą być uszczuplone, wielkość plastra określiłaby, jak długo grupa o danej wielkości może pozostać i żerować. Duża grupa spędzałaby mniej czasu w plastrze o danym rozmiarze niż mniejsza grupa, ponieważ szybciej wyczerpuje łatkę-duża grupa po prostu ma więcej ust do wykarmienia. Jeśli zwierzęta podróżują między plastrami po ich wyczerpaniu, gęstość i rozmieszczenie plastrów determinują poniesione koszty podróży. Gdy łaty zasobów są w dużej gęstości lub w rozproszeniu zbiorczym, odległość do następnej łaty jest niewielka, koszty podróży są niskie,a zatem zwierzęta mogą tworzyć duże grupy. W takich momentach wszelkie dodatkowe koszty związane z byciem członkiem dużej grupy, takie jak konieczność odwiedzenia wielu łatek, można łatwo odzyskać. W przeciwieństwie do tego, gdy łatki zasobów występują przy niskiej gęstości, odległość do następnej łatki jest zazwyczaj duża, koszty podróży są wysokie, a zwierzęta nie mogą sobie pozwolić na szybkie wyczerpanie łatek, dlatego zwierzęta tworzą małe grupy.
rozszczepienie-fuzja społeczna organizacja małp pająków, szympansów i kilku innych naczelnych (Rysunek 1) oferuje użyteczne testy modelu ograniczeń ekologicznych, ponieważ można próbować przewidzieć czasowe zmiany wielkości podgrup na podstawie bezpośrednich miar wielkości, gęstości i rozkładu zasobów żywności (Chapman 1990, Chapman et al. 1995). W przypadku małp pająków i szympansów opracowano model wielokrotnej regresji, aby pokazać, że rozmiar, gęstość i rozmieszczenie plam pokarmowych mierzonych każdego miesiąca były dobrym wskaźnikiem wielkości podgrup. Trudno jest wizualnie przedstawić wielokrotną regresję, ale metody, które zostały użyte dla małp pająków, są przedstawione na rysunku 2. Pajęczaki mają bardzo elastyczny typ organizacji społecznej, a w Parku Narodowym Santa Rosa w Kostaryce liczebność podgrupy może wynosić od 1 do 35 osobników, ale średnio około 5 osobników podróżuje razem. Dla tej populacji 50% wariancji średniej miesięcznej wielkości podgrupy można przewidzieć na podstawie stosunkowo surowych miar wielkości, gęstości i dystrybucji plastrów pokarmowych (Chapman 1990).

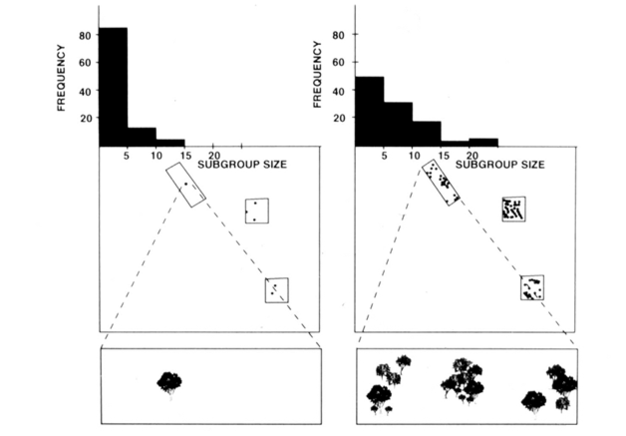
oprócz gatunków wymienionych powyżej, zastosowanie modelu ograniczeń ekologicznych zostało ogólnie poparte badaniami pochodzącymi z różnych gatunków (Snaith & Chapman 2005) i sytuacji (np. ogólne modele, Wrangham et al. 1993, oraz mixed species associations, Chapman & Chapman 2000C). Uważamy, że biorąc pod uwagę szerokie poparcie, jakie otrzymał ten model, nadszedł czas, aby rozsądnie było zasugerować, że gatunki powinny zazwyczaj odpowiadać oczekiwaniom modelu ograniczeń ekologicznych. Nie oznacza to, że wszystkie gatunki będą zgodne, a tym samym staje się ekscytującym czasem dla badań w tej dziedzinie, ponieważ badacze mogą szukać wyjątków od modelu. Podejrzewamy, że gatunki, które nie są zgodne, zrobią to, ponieważ przyjęły strategie społeczne, które są sprzeczne z oczekiwaniami ekologicznymi. Stanowi to „kryterium” oceny potencjalnego znaczenia różnych strategii społecznych (tj. im bardziej odbiega ona od oczekiwań modelu ekologicznego, tym ważniejsza jest społeczna presja selektywna).
przytoczmy pokrótce dwa przykłady z naszych poprzednich badań. Samice szympansów były bardziej samotne niż samice małp pająków, jednak obie mają podobne organizacje społeczne. Ponadto, chociaż mogliśmy dokładnie przewidzieć liczbę samców i subadult szympansów w podgrupie w oparciu o warunki ekologiczne, nie byliśmy w stanie przewidzieć liczby samic szympansów w tych podgrupach (Chapman et al. 1995). Nawet gdy zasoby były bardzo obfite i prawie wszystkie samce znajdowały się w jednej dużej podgrupie, samice rzadko wchodziły w grupy, co sugeruje, że koszt przebywania w większej podgrupie przewyższał wszelkie korzyści, takie jak unikanie drapieżników. Jest to nieoczekiwane z perspektywy, że niemowlęta tych samic byłyby klasą wieku/płci najbardziej zagrożoną przez drapieżnictwo. Jedną z możliwych do sprawdzenia hipotez wyjaśniających te obserwacje jest to, że natura koalicji u tych dwóch gatunków może wpływać na korzyści płynące z członkostwa w grupie. Dowody sugerują, że w przeciwieństwie do szympansów, samice małpy pająka tworzą koalicje, które często działają w celu umożliwienia członkom koalicji wyłącznego dostępu do żywności. Tak więc małpy pająków, kiedy dołączają do poszczególnych osobników, mogą zwiększyć dostęp do pożywienia poprzez wykluczenie innych, ale dla szympansów tak nie jest (Chapman et al. 1995).
zidentyfikowaliśmy kolejne interesujące odchylenie, potencjalnie spowodowane przez czynniki społeczne wpływające na koszty i korzyści płynące z bycia w grupie, a dotyczy to czerwonych i czarno-białych małp colobus (aka. guerezas, Colobus guereza) w Parku Narodowym Kibale w Ugandzie. Colobus czerwonolicy tworzą duże grupy liczące średnio 65 osobników (25-127 osobników, Snaith i in. 2008), podczas gdy guerezowie żyją w małych grupach ze średnią 6,5 osobników (4-11 osobników, Harris & Chapman 2007). Pomimo tej różnicy, istnieje wiele podobieństw w roślinach zjadanych przez te dwa gatunki. Gdyby warunki ekologiczne były odpowiedzialne za różnicę w wielkości grupy między dwoma gatunkami colobine, można by się spodziewać, że ich dieta będzie się różnić, a gęstość drzew pokarmowych będzie niższa w pasmach rodzimych guerez, ponieważ mają mniejszą wielkość grupy. Jednak ich dieta jest bardzo podobna;nakładanie się diety między grupą colobus i grupą guereza, która miała swój zasięg domowy w całości w zasięgu domowym grupy Colobus, wynosiło 43.2%, podczas gdy w przypadku dwóch sąsiednich grup colobus, dieta pokrywała się tylko o 37,3% (Chapman et al. 2002). Wydaje się, że sukces reprodukcyjny samicy guerezy jest maksymalizowany w małych i średnich grupach, ponieważ większe grupy doświadczają większego odsetka zabiegów i dzieciobójstwa lub większej konkurencji w zakresie karmienia (patrz dowody na konkurencję mieszańców u liściowatych Trachypithecus phayrei i Semnopithecus sp. , ale Brak dowodów na to, że guereza zubożała plastry żywnościowe). Byliśmy świadkami wielu porwań mężczyzn i zabójstw niemowląt w guerezas (Onderdonk 2000) – patrz Teichroeb & Sicotte (2008) w celu oceny teorii dotyczącej dzieciobójstwa u colobines. Nie jest jasne, w jaki sposób ryzyko dzieciobójstwa ograniczyłoby rozmiar grup guerezy, gdy mają one wyraźny dostęp do dużej gęstości pokarmu, która powinna pozwolić na tworzenie grup wieloosobowych. U kilku gatunków większe grupy żeńskie są bardziej celem migracji samców, a sytuacja ta może zwiększyć częstość dzieciobójstwa-na przykład „Semnopithecus sp”. (Borries 1997), Theropithecus gelada (Dunbar 1984), Alouatta seniculus (Crockett & Janson 2000), Presbytis thomasi (Steenbeek & van Schaik 2001). Oczekuje się jednak, że dzieciobójstwo będzie rzadsze, jeśli grupa zawiera wiele aktywnych reprodukcyjnie samców, ponieważ imigracja mężczyzn i późniejsze brutalne przejęcie oraz dzieciobójstwo są mniej prawdopodobne, gdy nowo przybyły ma do czynienia z kilkoma możliwymi reproduktorami przyszłych niemowląt (Janson & van Schaik 2000). Guerezas wydają się mieć wystarczające zasoby żywnościowe, aby tworzyć większe grupy (Tombak et al. 2012), co zmniejszyłoby ryzyko dzieciobójstwa, ale nie tworzą dużych grup. Możliwe jest, że charakter interakcji męsko-męskich w guerezach powoduje, że duże grupy są niestabilne. Wydaje się, że tak jest w przypadku kolobusa ursynskiego (Colobus vellerosus), gdzie grupy wieloosobowe przyciągają imigrantów płci męskiej i mają wyższy wskaźnik dzieciobójstwa niż grupy z jednym silnym dorosłym mężczyzną w kwiecie wieku (Teichroeb, Wikberg, Badescu, & Sicotte, niepublikowane dane; rys. 3). Thus, even when ecological conditions would permit large groups to form, social conditions preclude their formation (Chapman & Pavelka 2005).

jeśli model ograniczeń ekologicznych przedstawia presję, która na ogół wpływa na wielkość grupy naczelnych i jeśli odchylenia od tej oczekiwanej wielkości grupy wynikają z presji społecznej, będzie to ekscytujący czas w tej dziedzinie badań, ponieważ rodzi wiele interesujących pytań. Na przykład: Jaka jest natura presji społecznej na wielkość grupy? Dlaczego te ograniczenia społeczne są obecne u tych gatunków, a nie blisko spokrewnionych? A jakie siły ewolucyjne wybierają na te presje społeczne? Wielkość grupy jest kluczowym elementem wpływającym na rodzaj organizacji społecznej, dlatego badanie tych kwestii doprowadzi do ekscytującego udoskonalenia modeli socjoekologicznych.
Leave a Reply