Fosfofruktokinaza (PFK)
zawartość
- 1 Wprowadzenie
- 2 rola w glikolizie
- 3 Mechanizm i regulacja Fosfofruktokinazy
- 4 Regulacja
- 5 Zmiany konformacyjne w jednostce Dimerycznej PFK
- 6 Główne zmiany konformacyjne w jednostce DIMERYCZNEJ PFK
- podjednostka PFK.
- 7 mutageneza ukierunkowana na miejsce
- 8 choroba
- 9 struktury 3D PFK
wprowadzenie
Fosfofruktokinaza-1 (PFK-1) jest enzymem glikolitycznym, który katalizuje przeniesienie grupy fosforylowej Z do do uzyskania i . Patrz Enzymy Glikolizy. Mg2+ jest również ważne w tej reakcji (). Fosfofruktokinaza-2 (PFK-2) działa na te same substraty, dając ADP i . . Reakcja PFK jest silnie egzergoniczna (nieodwracalna) w warunkach fizjologicznych, a zatem jest jednym z etapów wyznaczających szybkość szlaku glikolitycznego. W większości organizmów/tkanek PFK jest głównym enzymem regulującym strumień glikolityczny szlaku; jego aktywność jest kontrolowana przez stężenia niezwykle dużej liczby metabolitów, w tym ATP, ADP, AMP, PEP i fruktozo-2,6-bisfosforanu.
jest tetramerem identycznych podjednostek 320-resztkowych. Jest to enzym allosteryczny, który jest opisany za pomocą modelu symetrii allosteryzmu, w którym występuje uzgodnione przejście od stanu o wysokiej aktywności R do stanu o niskiej aktywności T. Opisano struktury rentgenowskie obu stanów R I T enzymu. Wiązanie jednej cząsteczki jej substratu F6P, która wiąże się z enzymem stanu R z wysokim powinowactwem, ale z enzymem stanu T z niskim powinowactwem, powoduje, że PFK przejmuje stan R, co z kolei zwiększa powinowactwo enzymu do dodatkowego F6P (efekt homotropowy). Aktywatory, takie jak ADP i AMP, wiążą się z tak zwanymi miejscami allosterycznymi, wiążącymi miejsca odmienne od miejsca aktywnego, gdzie również ułatwiają tworzenie stanu R, a tym samym aktywują enzym (efekt heterotropowy; ADP, będący produktem reakcji PFK, wiąże się również w miejscu aktywnym enzymu). Podobnie inhibitory, takie jak PEP, wiążą się z miejscami allosterycznymi (które w przypadku PFK pokrywają się z aktywującym miejscem allosterycznym), gdzie sprzyjają tworzeniu się stanu T, hamując w ten sposób enzym.
Dwa Miejsca aktywne enzymu znajdują się na styku z miejscem aktywnym w kolorze karmazynowym z substratami w Kolorze cyjanowym. Dwa inne aktywne miejsca znajdują się na styku podjednostek B (zielony) i C (różowy). Zbliżenie podjednostki D (Żółty) pokazuje, że aminokwasy z obu podjednostek a (jasnoniebieski) i D (Żółty) przyczyniają się do wiązania F6P. dwa miejsca allosteryczne znajdują się na styku, a dwa na styku podjednostek C i D. ponownie interfejsy są magenta z ligandem allosterycznym w Kolorze cyjanowym. Zbliżenie podjednostki a pokazuje wkład obu podjednostek w Wiązanie ADP. Zmiany konformacyjne w przechodzeniu między Stanami R I T PFK zilustrowano poniżej.
współrzędne atomowe dla stanu R PFK uzyskano z 4pfk; te dla stanu T PFK uzyskano z Philip Evans, MRC Laboratory of Molecular Biology, Cambridge, U. K., ale są teraz dostępne jako 6pfk.
rola w glikolizie
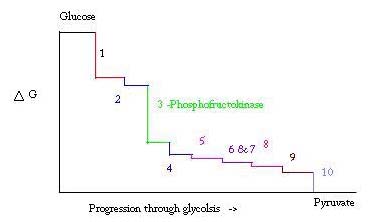
glikoliza to proces wytwarzania i rozkładania glukozy w celu wytworzenia kwasu pirogronowego, który jest stosowany w oddychaniu beztlenowym lub jako jeden z wyjściowych reagentów w cyklu kwasu cytrynowego. Trzy punkty w procesie glikolizy występują z dużą ujemną energią wolną i dlatego są nieodwracalne. Te trzy punkty to heksokinaza, fosfofruktokinaza i kinaza pirogronianowa; z tych trzech PFK jest uważany za główny punkt regulacyjny glikolizy w mięśniach o ΔG= -25,9 kJ/mol.
mechanizm i regulacja Fosfofruktokinazy
Fosfofruktokinaza wiąże zarówno Mg2+-ATP, jak i fruktozo-6-fosforan (F6P), tworząc fruktozo-1,6-bisfosforan i Mg2+-ADP. Chociaż obraz z obu tych produktów nie został określony, wiązano się z enzymem. Istnieją trzy miejsca wiązania ligandów na podjednostkę. Dwa tworzą miejsce aktywne, które wiąże F6P i ATP, podczas gdy trzeci jest allosterycznym miejscem wiązania. Niektóre proponowane pozostałości związane z aktywnym miejscem obejmują . PFK istnieją w dwóch stanach konformacyjnych, oba i które są w równowadze. ATP wiąże zarówno aktywne, jak i allosteryczne miejsca w obu konformacjach. Podczas gdy ATP wiąże aktywne miejsce równie dobrze, preferencyjnie wiąże allosteryczne miejsce stanu T, to preferencyjne Wiązanie powoduje przejście od równowagi dwóch stanów, do większej ilości stanu T, co zmniejsza powinowactwo do F6P. również wiąże się z allosterycznym miejscem, aby zwiększyć stosunek fosfofruktokinazy stanu R. Wraz z ADP, AMP I F2, 6P hamują regulacyjną rolę ATP. Km PFK dla ATP jest .020mM i
Regulacja
glikoliza jest niezbędnym procesem metabolicznym dla przeżycia. Dlatego w jego aktywacji i tłumieniu musi być wysoce regulowany. Trzy punkty w procesie glikolizy występują z dużą ujemną energią wolną i dlatego są nieodwracalne. Te trzy punkty to heksokinaza, fosfofruktokinaza i kinaza pirogronianowa. Te trzy reakcje są kandydatami do głównych punktów regulacji ze względu na ich wysokie negatywne wolne Energie. Z tych trzech PFK jest uważany za główny punkt regulacyjny glikolizy (#3 na poniższym obrazku) w mięśniach, z ΔG= -25,9 kJ / mol, ponieważ jest to krok popełniony. Gdy PFK przekształci F6P w F1,6P, reakcja nie będzie łatwa do odwrócenia ze względu na dużą ilość energii, którą należy pokonać, aby cofnąć się do tyłu. . Ta bariera energetyczna ma sens, ponieważ kinaza pirogronianowa katalizuje końcową reakcję (#10), a heksokinaza (#1) w ogóle nie uczestniczy w glikolizie, gdy proces rozpoczyna się od glikogenu.
PFK jest regulowany przez ATP, AMP i ADP. Podczas gdy ATP wiąże się w miejscu aktywnym równie dobrze w obu stanach R I T, preferencyjnie wiąże allosteryczne miejsce stanu T, to preferencyjne Wiązanie powoduje przejście od równowagi dwóch stanów, do większej ilości stanu T, co zmniejsza powinowactwo do F6P. allosteryczny aktywator ADP wiąże się również z miejscem allosterycznym, aby zwiększyć stosunek fosfofruktokinazy w stanie R. Jak widać na poniższym wykresie, wykresy aktywności PFK są sigmoidalne. Świadczy to o kooperatywnym charakterze enzymu. Początkowe Wiązanie substratu z enzymem jest trudne, ale gdy jest związany i wymusza zmianę stanu z T – > r, inne substraty wiążą się znacznie łatwiej. Wykres pokazuje również, że dodanie ATP przesuwa wykres w prawo (tj. zmniejsza powinowactwo do F6P), natomiast dodanie AMP przesuwa go w lewo.
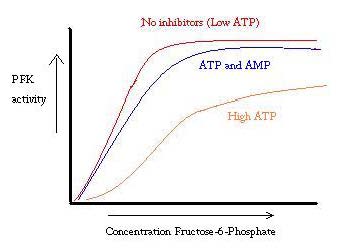
system regulacji dobrze współgra z funkcją PFK. Gdy PFK jest aktywny, ATP jest wytwarzany w dół strumienia z niego, jak dalsze produkty są rozkładane bardziej całkowicie. W związku z tym, gdy poziom ATP jest niski i konieczne jest zwiększenie aktywności PFK, ponieważ ADP będzie w wysokim stężeniu. Jest odwrotnie, ponieważ wysokie stężenie ATP hamuje aktywność białek. A jednak to wyjaśnienie nie może całkowicie wyjaśnić regulacji PFK, ponieważ poziomy ATP nie różnią się wystarczająco znacznie między aktywnymi i spoczynkowymi mięśniami. Należy znaleźć inny sposób regulacji allosterycznej.
km PFK dla ATP jest .020mM i032mM.
to ćwiczenie Kinemage składa się z dwóch scen kinemage, które ilustrują niektóre z allosterycznie indukowanych zmian konformacyjnych, które występują w PFK z Bacillus stearothermophilus.
zmiany konformacyjne w jednostce Dimerycznej PFK
Ten kinemage pokazuje dwie podjednostki tetrameru, których interfejs zawiera dwa aktywne miejsca. (KineMage currently not supported) pierwszy widok, 1: PFK dimer, pokazuje dwie podjednostki w ich konformacji stanu R reprezentowane przez ich tylne kości Ca z podjednostką 1 w różowym odcieniu i podjednostką 2 w różowym odcieniu. W każdej podjednostce przedstawiono dwa łańcuchy boczne: Glu 161 (czerwony) i Arg 162 (cyjan), które są częścią miejsca wiązania F6P w Stanach T i R (patrz niżej). F6P (hotpink) i ADP (zielony; „ADP-Aktywny”) są związane w aktywnym miejscu każdej podjednostki. Dodatkowy ADP (żółty; „ADP-allo”) jest związany w oddzielnym tak zwanym miejscu allosterycznym każdej podjednostki. Każdy ADP ma powiązany Mg2+, który jest tutaj reprezentowany przez kulkę tego samego koloru, co ADP, z którym się wiąże.
kliknij przycisk „Animuj”, aby przełączyć dimer między jego Stanami R I T. W stanie T podjednostka 1 to bluetint, a podjednostka 2 to skyblue. Łańcuchy boczne Glu 161 I Arg 162 w obu podjednostkach są czerwone i cyjanowe jak poprzednio (tylko atomy Ca i CB łańcucha bocznego Arg 162 w podjednostce 1 są obserwowane w strukturze rentgenowskiej stanu T; wszystkie są obserwowane w podjednostce 2). Enzym stanu T wiąże inhibitor 2-fosfoglikolanu (złoty; „PGC”), niefizjologiczny analog glikolitycznego pośredniego fosfoenolopirogronianu (PEP). Zauważ, że miejsce wiązania PGC w stanie T pokrywa się z allosterycznym miejscem wiązania ADP w stanie R („ADP-allo”), a zatem ich wiązanie się wzajemnie się wyklucza. Miejsca aktywne stanu T, które nie zawierają F6P, są oznaczone przez „ghost” f6ps (szary;”F6P site”), które mają takie same pozycje jak f6ps w enzymie stanu R.
drugi widok, 2: Allo/Act Sites, to zbliżenie górnej części pierwszego widoku pokazujące zarówno aktywne miejsce, jak i allosteryczne miejsce w tym regionie. Zauważ, że miejsce aktywne znajduje się na styku między dwiema podjednostkami i że miejsce allosteryczne oddziałuje bezpośrednio z miejscem aktywnym na sąsiedniej podjednostce. Porównaj konformacje stanu R i stanu T, wyświetlając oba naraz lub klikając przycisk „Animuj”. Czy można zidentyfikować jony Mg2+ związane z każdym z ADP związanych z enzymem w stanie R? Które Atomy ADP koordynują te jony Mg2+?
Grupa fosforanowa PGC wiąże się z miejscem allosterycznym w stanie T w prawie takiej samej pozycji, w jakiej Grupa fosforanowa beta „ADP-allo” wiąże się z miejscem allosterycznym w stanie R; obie grupy fosforanowe wiążą się z łańcuchami bocznymi tych samych trzech reszt (2 arg i 1 Lys; nie pokazano).
w stanie r o wysokiej aktywności dodatnio naładowany łańcuch boczny Arg 162 tworzy mostek solny związany Wodorem z ujemnie naładowaną grupą 6-fosforanową F6P (białe przerywane linie), interakcję, która prawdopodobnie stabilizuje stan R w stosunku do stanu T i dlatego jest częściowo odpowiedzialna za efekt homotropowy F6P.
Główne zmiany konformacyjne w podjednostce PFK.
ta KINEMAGE pokazuje te segmenty w pobliżu miejsca allosterycznego (pozostałości 53-60 nie są tutaj pokazane). Podobnie jak w KINEMAGE 1, polipeptyd jest reprezentowany przez łańcuch Ca z podjednostkami stanu R 1 i 2 w Czerwieni i różu oraz podjednostkami stanu T 1 i 2 w bluetint i skyblue. (KineMage obecnie nie jest obsługiwany)KINEMAGE 2 pojawia się w widoku 1: allosteryczne miejsce, w stanie R pokazując grupę fosforanową F6P (hotpink) związaną w miejscu aktywnym enzymu w mostku solnym związanym Wodorem (przerywane białe linie) z bocznym łańcuchem Arg 162 (cyjan). ADP (żółty; „ADP-allo”) zajmuje przyległe miejsce allosteryczne. Kliknij raz na „Animuj”, aby przejść do stanu T. Zastępuje to ADP w miejscu allosterycznym stanu r inhibitorem i analogiem PEP PGC (gold). F6P nie zajmuje już aktywnego miejsca, ale jego pozycja w stanie R jest wskazywana przez” ghost „F6P (szary; oglądany przez kliknięcie na”F6P site”).
co dzieje się z centralnym segmentem spiralnym polipeptydu (reszt 149-164) w przejściu R do T? Co to robi ze względnymi pozycjami ujemnie naładowanego Glu 161 i dodatnio naładowanego Arg 162? Kliknij na „F6P site”. Jaki wpływ na Wiązanie F6P miałby brak ładunku dodatniego Arg 162? Czy to wyjaśnia, przynajmniej częściowo, dlaczego stan T PFK ma niskie powinowactwo do F6P? Przejdź do widoku 2: Zbliżenie, aby zobaczyć zbliżenie interakcji F6P-sidechain. Wyśrodkuj cząsteczki, wybierając „pickcenter” z menu „Narzędzia” i klikając athe atom, który chcesz znaleźć w środku. Przesuń suwak „zoom”, aby powiększyć widok.
mutageneza ukierunkowana na miejsce
w pewnym momencie uważa się, że ujemny ładunek Glu 161 ma negatywny wpływ na Wiązanie F6P w stanie T. Pomysł ten nie został poparty eksperymentami mutagenezy ukierunkowanej na miejsce. Wykonano kilka zmutowanych PFK, w tym R162A, E161A i r162a/E161A. mutacja R162A spowodowała 30-krotne zmniejszenie wiązania F6P. Mutacja E161A miała jednak niewielki wpływ na zdolność PEP do hamowania wiązania F6P.
choroba
dziedziczny niedobór erytrocytów PFK jest związany z miopatią i hemolizą (choroba Tarui).
struktury 3D PFK
struktury 3D Fosfofruktokinazy
Leave a Reply