Frontiers in Oncology
wprowadzenie
Około 25% pacjentów z wczesnym rakiem piersi nadal doświadcza nawrotu miejscowego i rozwija przerzuty odległe po aktywnym leczeniu (1), a prawie 10% pacjentów znajduje się w stadium IV choroby w początkowej diagnozie w krajach rozwiniętych, która jest określana jako de novo metastatic breast cancer (MBC) (2). Pomimo postępów w leczeniu, MBC pozostaje nieuleczalna, a do 70-80% pacjentów z MBC umiera na raka w ciągu 5 lat (2). W wyniku niejednorodności MBC opracowuje się wiele modeli prognostycznych opartych na czynnikach prognostycznych lub wynikach w celu przewidywania wyników klinicznych i kierowania lekarzy do podejmowania odpowiednich decyzji terapeutycznych(3-5). Ponadto istnieje wiele modeli prognostycznych raka piersi z przerzutami do mózgu (bcbm), które umożliwiają lekarzom dokładne przewidywanie przeżycia u tych pacjentów (6, 7).
rak piersi może przerzuty w dowolnym miejscu ciała, ale przede wszystkim przerzuty do płuc, kości, wątroby, węzłów chłonnych bez pachowych i mózgu (8). Warto zauważyć, że przerzuty do wątroby (LM) są nie tylko częstym miejscem przerzutów, ale również wiążą się ze znacznie zwiększonym ryzykiem śmierci podobnym do przerzutów do mózgu, nieproporcjonalnie wyższą śmiertelnością w porównaniu z przerzutami do płuc lub Kości (5, 8). Ponieważ stopniowana ocena prognostyczna (GPA) jest powszechnie akceptowana u pacjentów z BCBM, wyżej wymienione modele prognostyczne stymulują nas do zaproponowania praktycznego modelu dla BCLM (3-7). Naszym celem było zbudowanie niezawodnego i przyjaznego użytkownikowi modelu prognostycznego dla BCLM oraz ocena jego zgodności i dokładności poprzez walidację zarówno wewnętrznie, jak i zewnętrznie. Model prognostyczny może pomóc lekarzom oszacować ryzyko zgonu pacjentów z BCLM i wybrać optymalne leczenie.
pacjenci i metody
selekcja pacjentów
niniejsze badanie zostało zatwierdzone przez niezależne komitety etyczne FUSCC. Zidentyfikowano kolejnych pacjentów z MBC zdiagnozowanych w FUSCC od stycznia 2007 r.do grudnia 2018 r. (n = 9 062). Kryteria kwalifikowalności były następujące: (1) histologicznie potwierdzony rak piersi, (2) Kobiety, (3) wątroba jako pierwsze miejsce choroby przerzutowej w raku piersi de novo z przerzutami lub nawracającym raku piersi oraz (4) pełna i szczegółowa dokumentacja. Wykluczono pacjentów z obustronnym rakiem piersi, innymi inwazyjnymi nowotworami lub z nieznaną obserwacją. Ostatecznie do dalszej analizy wybrano 1022 kwalifikujących się pacjentów. Pełne etapy selekcji przedstawiono na rysunku S1.
badanie zmiennych i wybór wartości odcięcia
zebrano informacje na temat następujących zmiennych kliniczno-patologicznych: wiek, podtypy molekularne, informacje o wcześniejszym leczeniu (chirurgia i chemioterapia ogólnoustrojowa), MFI, miejsca przerzutów pozawątrobowych (mózg, płuca, kości i węzły chłonne), charakterystyka przerzutów do wątroby (Dystrybucja, liczba, maksymalna średnica), hemoglobina (HB), testy czynnościowe wątroby i czas przeżycia. Podtypy molekularne obejmowały receptor hormonalny (HR) i receptor 2 ludzkiego naskórkowego czynnika wzrostu (HER2). MFI zdefiniowaliśmy jako odstęp między datą rozpoznania pierwotnego raka piersi a datą pierwszych przerzutów odległych. Punkty odcięcia MIF wykorzystane w tym badaniu wynosiły 3 i 24 miesiące zgodnie z odniesieniem (9). W związku z tym pacjentów można podzielić na trzy grupy: pacjentów z nowo rozpoznaną MBC (MFI < 3 miesiące), pacjentów z krótką MFI (≤ 24 miesiące) i pacjentów z długą MFI > 24 miesiące. Przerzuty do odległych węzłów chłonnych definiowano jako przerzuty z ipsilateralnych węzłów chłonnych pachowych, nadobojczykowych, infraklawikularnych lub wewnętrznych węzłów chłonnych sutka. Rozpoznanie LM oparto na obrazowaniu radiologicznym lub patologicznym. Charakterystyka przerzutów do wątroby oceniano za pomocą brzusznej tomografii komputerowej (CT), rezonansu magnetycznego (MRI) lub chirurgicznej resekcji próbek. W niniejszym badaniu analizowano również testy czynnościowe wątroby, w tym bilirubinę całkowitą, aminotransferazę alaninową (alat), aminotransferazę asparaginianową (AspAT), fosfatazę alkaliczną (ALP), dehydrogenazę mleczanową (LDH) i stosunek γ-glutamylotransferazy do albuminy (GAR). Próbki krwi pobrano do badań laboratoryjnych w ciągu 1 tygodnia od rozpoznania LM. Klasyfikację dystrybucji, liczby lub maksymalnej średnicy przerzutów do wątroby i LDH oparto na innych badaniach (10-13). Wartości odcięcia HB, bilirubiny całkowitej, alat, AspAT i ALP określono zgodnie z Common Terminology Criteria for Adverse Events (CTCAE), ponieważ umiarkowane lub II stopnia nieprawidłowości w stężeniu hemoglobiny lub czynności wątroby mogą wpływać na wybór leczenia (14). Wartość GAR zdefiniowano jako prosty stosunek pomiędzy stężeniem serumy-glutamylotransferazy (GGT, U / L) a stężeniem albumin w surowicy (ALB g/l). OS od czasu przerzutów mierzono od daty rozpoznania LM do śmierci z dowolnej przyczyny. Ostatnim okresem obserwacji po zakończeniu leczenia był listopad 2019 r., a mediana czasu obserwacji wynosiła 18,63 miesięcy. Jeśli pacjenci zostali utraceni do obserwacji, była cenzurowana w ostatnim dniu obserwacji.
Analiza statystyczna
pacjentów podzielono na szkolenie (2007-2016, n = 715) i walidację (2016-2018, n = 307) ustaloną w stosunku 7:3. Optymalną wartość odcięcia dla GAR wybrano na podstawie obliczeń wskaźnika Youdena i analizy krzywej charakterystyki operacyjnej odbiornika (Roc) (rysunek S2). Test Pearsona chi-squared lub dokładny test Fishera wykorzystano do porównania zmiennych kategorycznych. Modele regresji proporcjonalnych zagrożeń Coxa z metodą selekcji wstecznej wykorzystano do analizy wielowymiarowej i obliczania współczynników ryzyka. Współczynniki regresji obliczono za pomocą wielowymiarowej analizy regresji, a następnie pomnożono przez 10 i zaokrąglono, aby reprezentować końcowe wyniki prognostyczne. Bootstrapping został użyty do wewnętrznej walidacji. Następnie, zależne od czasu krzywe ROC i wykresy kalibracji zostały wykorzystane do oceny dyskryminacji i kalibracji tego modelu prognostycznego w zestawie walidacyjnym. Wartości odcięcia grup ryzyka określono na podstawie wykresów X-tile (15). Analizę przeżycia przeprowadzono przy użyciu krzywych przeżycia Kaplana-Meiera, a do porównania krzywych przeżycia wykorzystano testy logarytmiczne. Wszystkie wartości P były dwustronne, a wartości P < 0,05 uznano za istotne statystycznie. Analiza statystyczna została przeprowadzona przy użyciu oprogramowania SPSS (SPSS 20, Chicago, IL, USA) oraz oprogramowania R w wersji 4.0.1.
wyniki
charakterystyka i związek ze stratyfikacją ryzyka
łącznie 1022 pacjentów wybranych do tego badania podzielono na zestawy treningowe (n = 715) i walidacyjne (n = 307). Opis cech klinicznych przedstawiono w tabeli 1 i tabeli S1. W grupie szkoleniowej stwierdzono u 126 pacjentów (17,6%) nowo zdiagnozowaną MBC oraz u 589 pacjentów (82,4%) z nawrotową MBC, z czego u 297 pacjentów (50,4%) krótko MFI, a u 292 pacjentów (49,6%) długo MFI. Mediana wieku w momencie rozpoznania LM wynosiła 50 (zakres 21-87) lat z 617 pacjentami (86.3%) poniżej 60 lat. Spośród tych pacjentów odsetek pacjentów z HR-dodatnim i HER2-dodatnim wynosił odpowiednio 62, 2 i 38, 0%. Wśród nawracających pacjentów z MBC prawie wszyscy pacjenci przeszli operację guza pierwotnego (584, 99,2%) i otrzymali chemioterapię uzupełniającą (neo) (569, 96,6%). Wzorce przerzutów odległych wykazały, że najczęstszym miejscem przerzutów pozawątrobowych była kość (42,7%), a następnie odległe węzły chłonne (36,1%), płuca (25,6%) i mózg (2,9%). Przerzuty do wątroby charakteryzowały się rozproszonym rozmieszczeniem i małymi guzkami, z których większość była wielokrotna (≥3 przerzuty, 77,3%), ale małe guzki (≤3 cm, 59,4%) i obejmowały prawy i lewy płat (74,4%). We wczesnym stadium LM czynność wątroby była zaburzona w różnym stopniu, ale na ogół łagodna. Zwiększenie aktywności LDH (36,1%) I GAR (35,9%) wydawało się być wrażliwymi wskaźnikami zaburzeń czynności wątroby, a umiarkowane lub większe nieprawidłowości HB (2,9%), stężenia bilirubiny całkowitej (2,7%), alat (3,6%), AspAT (9,5%) i ALP (3,9%) występowały niezbyt często według CTCAE. W porównaniu z grupą niskiego ryzyka, Grupa średniego i wysokiego ryzyka wykazywała wyższy wskaźnik negatywności HR i HER2, krótki wskaźnik MFI, przerzuty pozawątrobowe, obciążenie guza przerzutami do wątroby oraz nieprawidłowości w poziomie hemoglobiny lub czynności wątroby (wszystkie Ps ≤ 0,001), co sugeruje, że czynniki te mogą wpływać na rokowanie BCLM.
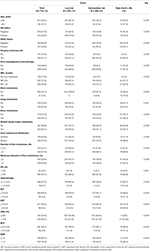
Tabela 1. Charakterystyka wyjściowa i jej związek ze stratyfikacją ryzyka zestawu treningowego.
model prognostyczny i Walidacja
w wielowymiarowym modelu regresji Coxa z OS związane były podtypy molekularne (stan HR i HER2), MFI, miejsca przerzutów pozawątrobowych (przerzuty do mózgu, płuc i kości) oraz testy czynnościowe wątroby (bilirubina całkowita, LDH i GAR) (Tabela 2). W szczególności ryzyko zgonu pacjentów z ujemnym wynikiem HR (HR 1,740, 95% CI 1,424–2,127, p < 0,001) i ujemnym wynikiem HER2 (HR 1,615, 95% CI 1,316–1,983, p < 0,001) zwiększyło się w porównaniu z HER2 dodatnie odpowiedniki. Długość MIF miała również znaczący wpływ na przeżycie pacjentów z BCLM, dlatego przeżycie pacjentów z długim MIF (HR 1, 612, 95% CI 1, 195–2, 174, P < 0, 001) zostało skrócone w porównaniu z pacjentami z nowo rozpoznanym MBC i pacjentami z krótkim MIF (HR 2, 563, 95% CI 1, 904–3, 449, p < 0, 001) wykazywały ponad dwukrotne ryzyko zgonu w stosunku do nich. Ponadto obecność przerzutów pozawątrobowych (przerzuty do mózgu, płuc i kości) i nieprawidłowej czynności wątroby (bilirubina całkowita, LDH i GAR) były skorelowane z niekorzystnym wpływem prognostycznym na OS. Ten model prognostyczny miał pole pod krzywą (AUC) zależnego od czasu ROC na 1 rok OS z 0,78 w zestawie treningowym i 0,80 w zestawie walidacyjnym, co wskazuje, że model ten miał dobrą dyskryminację (Rysunek 1). Metoda bootstrapping została wykorzystana do potwierdzenia stabilności naszego modelu prognostycznego w zestawie treningowym, a końcowe wyniki były dość solidne (tabela S2). Krzywe kalibracji modelu prognostycznego dla 1-letniego i 3-letniego OS w zestawie Szkoleniowym oraz 1-letniego OS w zestawie walidacyjnym wykazały jego dobrą zgodność (Rys. 2).

Tabela 2. Wielowymiarowy model regresji Coxa (zestaw treningowy).
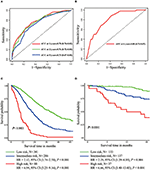
Rysunek 1. Zależne od czasu krzywe ROC modelu prognostycznego w zestawie treningowym (a) i zestawie walidacyjnym (B). Całkowite przeżycie z przerzutów trzech grup prognostycznych w zestawie treningowym (C) i walidacyjnym (D).
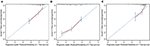
Rysunek 2. Krzywa kalibracyjna do przewidywania przeżycia pacjenta po 1 roku (A) i 3 latach (B) W Zestawie Szkoleniowym oraz po 1 roku (C) w zestawie walidacyjnym.
stratyfikacja ryzyka i przeżywalność

Tabela 3. Obliczanie wyniku i punktów odcięcia grup prognostycznych.
dyskusja
w niniejszej analizie 1022 pacjentów leczonych w naszej placówce w latach 2007-2018 wykazaliśmy, że podtypy molekularne (stan HR i HER2), MFI, miejsca przerzutów pozawątrobowych (przerzuty do mózgu, płuc i kości), testy czynnościowe wątroby (bilirubina całkowita, LDH i GAR) były niezależnymi czynnikami prognostycznymi.pacjenci z BCLM. W związku z tym skonstruowano model prognostyczny dla pacjentów z BCLM z wykorzystaniem czynników prognostycznych.
w odniesieniu do podtypów molekularnych, HR dodatni może wskazywać, że wzrost i proliferacja raka piersi są nadal regulowane przez hormony, zwane guzami zależnymi od hormonów. Jednocześnie terapia endokrynologiczna przynosi korzyści, w tym nieliczne działania niepożądane i długotrwałe efekty, które często mogą przynieść długoterminowe korzyści w zakresie przetrwania pacjentom z HR-dodatnim. W związku z tym dodatni wynik HR został uznany za istotny czynnik sugerujący korzystne rokowanie we wczesnym i przerzutowym raku piersi (1, 3-5, 8-10, 16). Chociaż amplifikacja i nadekspresja HER2 jest uważana za czynnik przewidujący ryzyko odległych przerzutów i śmierci związanej z rakiem piersi, następnie opracowane leki anty-HER2 znacząco poprawiły przeżywalność pacjentów z HER2-dodatnim rakiem piersi (2, 9, 17). W erze terapii celowanej badanie przeprowadzone w południowo-wschodniej Holandii wykazało, że ryzyko śmiertelności u pacjentów z ujemnym HER2 było zwiększone o 44% (95% CI 1,13-1,83, p = 0,003) w porównaniu z pacjentami z dodatnim HER2 (9). W naszym badaniu ryzyko zgonu pacjentów z ujemnym wynikiem HR i ujemnym wynikiem HER2 wzrosło w porównaniu do pacjentów z ujemnym wynikiem HR lub ujemnym wynikiem HER2, zgodnie z tymi obserwacjami. Pacjenci z krótką MIF, Zwykle definiowaną jako ≤24 miesiące, mieli gorsze rokowanie (3, 5, 9). Ponadto u pacjentów z MBC de novo rokowanie wydawało się znacznie lepsze niż u pacjentów z MBC, którzy nawracali, chociaż różnica ta była stopniowo zmniejszana wraz z wydłużeniem odstępu wolnego od choroby (disease-free interval-DFI) lub MFI (9, 18, 19). Lobbezoo i in. stwierdzono, że pacjenci z MIF ≤24 miesięcy mieli znacznie krótszy czas przeżycia (9,1 vs 29.4 miesięcy, P < 0,001) niż u pacjentów z IV stadium zaawansowania de novo, ale u pacjentów z dłuższym okresem MFI (>24 miesiące) rokowanie było podobne (27,9 vs 29,4 miesiąca, P = 0,73) (9). Prawdopodobną przyczyną tego zjawiska jest to, że pacjenci z nawrotem MBC wcześniej poddawani systematycznemu leczeniu mogą być bardziej oporni na chemioterapię niż pacjenci wcześniej nieleczeni, leczeni de novo MBC, ale dalsze badania są uzasadnione (9, 18, 19). Badanie to potwierdziło, że czas przeżycia pacjentów z długim MIF został skrócony w porównaniu do pacjentów z krótkim MIF, u których wynik był znacznie gorszy.
przeżywalność MBC różniła się znacząco w zależności od miejsca przerzutów, a pacjenci z przerzutami do narządów wewnętrznych byli związani ze zwiększonym ryzykiem śmiertelności w porównaniu z pacjentami z przerzutami do narządów innych niż trzewne (3-5, 9, 18). Ponadto obecność przerzutów do mózgu miała większy wpływ na przeżycie niż jakiekolwiek inne miejsca przerzutów(3, 5, 9, 18). Nic dziwnego, że wielokrotne przerzuty miały bardziej niekorzystny wpływ na rokowanie (3, 5, 9, 17, 18). W tej analizie przerzuty pozawątrobowe, z wyjątkiem przerzutów do odległych węzłów chłonnych, mogą prowadzić do skrócenia czasu przeżycia, prawdopodobnie dlatego, że przerzuty do wątroby były czynnikiem krytycznie zagrażającym życiu w porównaniu z przerzutami do węzłów chłonnych.
należy zauważyć, że pacjenci z wyższym stężeniem bilirubiny mieli znacznie mniejsze ryzyko kilku chorób, częściowo dzięki swoim właściwościom przeciwutleniającym i przeciwzapalnym (20). Niedawne badanie wykazało również, że u pacjentów z wczesnym rakiem piersi z wyższym stężeniem bilirubiny całkowitej wykazano prawie 40% zmniejszenie ryzyka zgonu(21). Jednakże hiperbilirubinemia była związana ze złym rokowaniem u pacjentów z BCLM (22). Możliwe jest, że w przeciwieństwie do stosunkowo wyższego stężenia bilirubiny całkowitej u pacjentów z rakiem piersi bez przerzutów, podwyższone stężenie bilirubiny 1,5 razy większe niż górna granica normy (GGN) u pacjentów z BCLM może przewidywać ciężkie uszkodzenie wątroby, a tym samym przyczyniać się do przerwania leczenia lub encefalopatii wątrobowej.
efekt Warburga powoduje, że komórki nowotworowe zależą od glikolizy tlenowej, nawet jeśli podaż tlenu jest wystarczająca, co jest cechą charakterystyczną metabolizmu raka w przeciwieństwie do normalnych tkanek (23). LDH odgrywa nieodzowną rolę w glikolizie ze względu na zdolność przekształcania pirogronianu w mleczan w warunkach beztlenowych (24). Deregulowane poziomy LDH mogą odzwierciedlać większe obciążenie guza, gorszą odpowiedź na leczenie i rokowanie, które wcześniej zgłaszano w przypadku wielu nowotworów (21, 24-26). Metaanaliza prognostycznego wpływu LDH u pacjentek z rakiem piersi wykazała, że wyższe poziomy LDH powodowały niezadowalający OS i czas przeżycia bez progresji choroby, co obejmowało 11 badań z udziałem 6102 pacjentek (27).
GGT, główny endogenny przeciwutleniacz, powoduje asymilację aminokwasów prekursorowych i bierze udział w syntezie glutationu (28). GGT w guzach umożliwia komórkom szybkie uzupełnienie glutationu po otrzymaniu prooksydacyjnej terapii przeciwnowotworowej, a zatem jest skorelowany z opornością na leki i słabym przeżywaniem (29). Co ciekawe, Fentiman et al. stwierdzono znamiennie pozytywny związek między zwiększonym GGT a ryzykiem raka piersi (30). ALB syntetyzowany przez wątrobę działa jako przeciwutleniacz, transporter składników odżywczych i uczestniczy w szlakach sygnałowych dzięki swoim unikalnym właściwościom strukturalnym (31). Hipoalbuminemia występuje zwykle u pacjentów z zaawansowanym rakiem i jest przypisywana różnym mechanizmom, w tym zaburzonej syntezie wątroby, zwiększonemu katabolizmowi i wyniszczeniu (21, 31). Hipoalbuminemia jest niezależnym wskaźnikiem złego rokowania różnych nowotworów (21, 22, 32, 33). W przeciwieństwie do zmniejszonego stężenia albumin w surowicy, stężenie GGT w surowicy jest zwykle podwyższone, gdy czynność wątroby jest zaburzona. Dlatego GAR na podstawie powyższych dwóch parametrów może mieć tę zaletę, aby odzwierciedlać zdolność rezerwy wątroby i przewidywać rokowanie (32, 33). W obecnym badaniu zaburzenia czynności wątroby (bilirubina całkowita, LDH i GAR) były skorelowane z niekorzystnym wpływem prognostycznym na OS.
Po przeanalizowaniu rokowania u 123 pacjentów z BCLM, Duan i wsp. okazało się, że pacjenci z trzech lub więcej przerzutów do wątroby przeprowadzone 2.26-krotnie zwiększone ryzyko zgonu w stosunku do pacjentów z<3 przerzutami do wątroby w analizie wielowymiarowej (10). Jednak charakterystyka przerzutów do wątroby w tym badaniu wydawała się nie mieć znaczenia. Istnieją dwa potencjalne powody, które mogą przyczynić się do tej rozbieżności. Po pierwsze, rozmieszczenie, liczba i maksymalna średnica przerzutów do wątroby były znacząco różne w trzech grupach ryzyka, co wskazuje, że ryzyko śmiertelności zwiększało się wraz z rozszerzeniem przerzutów do wątroby w analizie jednowymiarowej. Następnie nieprawidłowa czynność wątroby była ściśle związana z obciążeniem nowotworu przerzutów do wątroby, dostosowując rolę tych czynników w analizie wielowymiarowej.
przeprowadzono wiele badań nad czynnikami prognostycznymi w ustalaniu BCLM. Analiza 145 pacjentów z BCLM wykazała, że hipoalbuminemia, starszy wiek i negatywność ER były niezależnymi predyktorami słabego przeżycia (22). W analizie rejestru greckiego uzyskano podobne wyniki, w których dodatni wynik HR, niski stopień histologiczny, brak przerzutów pozawątrobowych i dobry stan wydajności były istotnymi czynnikami prognostycznymi dla korzystnego rokowania w analizie jednoskładnikowej (34). W niedawnym badaniu populacyjnym obejmującym ponad 4000 pacjentów z nowotworami BCLM zidentyfikowano czynniki demograficzne i społeczno-ekonomiczne, stopień patologii, całkowitą liczbę przerzutów pozawątrobowych, leczenie i podtyp molekularny jako parametry znacząco wpływające na całkowite przeżycie (17). Regierer et al. opracowano wynik prognostyczny dla MBC na podstawie statusu HR, MIF i miejsc przerzutów w celu przewidywania rokowania i indywidualizacji optymalnego leczenia, który został zatwierdzony wewnętrznie i zewnętrznie (5). Niestety, status HER2 nie został uwzględniony w skali prognostycznej i w związku z tym ograniczył jego zastosowanie. Zmodyfikowany breast-GPA dla pacjentów z BCBM integrujący cztery proste parametry kliniczne miał natychmiastową rolę w przewidywaniu ich przeżycia, ale nie miał zastosowania dla pacjentów z BCLM (7). Według naszej wiedzy, nie istnieje model prognostyczny, który integruje te czynniki prognostyczne dla pacjentów z BCLM, więc nasz model ma sens pragmatyczny.
w tych badaniach były też pewne ograniczenia. Po pierwsze, jednocentrowe i retrospektywne badanie nieuchronnie doprowadziło do błędu selekcji, chociaż nasz model prognostyczny został zatwierdzony wewnętrznie i zewnętrznie. Po drugie, pacjenci, u których rozwinęły się przerzuty do wątroby w późniejszym okresie choroby, zostali wykluczeni, dzięki czemu nie byliśmy w stanie ocenić tych pacjentów. Po trzecie, szczegółowe informacje na temat stanu sprawności i leczenia nie były dostępne w tym badaniu.
wnioski
pomimo tych ograniczeń, badania te mogą zapewnić prosty i wiarygodny model prognostyczny. Główną zaletą naszych badań jest włączenie parametrów łatwo dostępnych w praktyce klinicznej na podstawie dużej próby pacjentów z BCLM. Oprócz znakomitej klasyfikacji nowotworów według metod sekwencjonowania nowej generacji, nasz model może pomóc zidentyfikować podgrupy o różnym rokowaniu i kierować późniejszą terapią.
Oświadczenie o dostępności danych
oryginalne wkłady przedstawione w badaniu są zawarte w artykule/materiale uzupełniającym, dalsze zapytania można kierować do odpowiedniego autora/autorów.
Oświadczenie o etyce
niniejsze badanie zostało zatwierdzone przez niezależne komitety etyczne FUSCC. Pacjenci / uczestnicy przedstawili pisemną świadomą zgodę na udział w tym badaniu.
wkład autora
XZ i YG zebrały dane. LJ i LF przeanalizowali dane i napisali pierwszy szkic. ZW krytycznie zrecenzował rękopis. Wszyscy autorzy wnieśli swój wkład do artykułu i zaakceptowali nadesłaną wersję.
konflikt interesów
autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
podziękowania
potwierdzamy Lei Cheng za przeprowadzenie analizy danych.
materiał uzupełniający
skróty
BCLM, rak piersi z przerzutami do wątroby; Fuscc, Fudan University Shanghai Cancer Center; ROC, receiver operating characteristic curve; MFI, przedział wolny od przerzutów; HR, hazard ratio; CI, przedział ufności; OS, overall survival; MBC, przerzutowy rak piersi; BCBM, rak piersi z przerzutami do mózgu; LM, przerzuty do wątroby; GPA, graded prognostic assessment; HB, hemoglobina; HR, receptor hormonalny; HER2, receptor ludzkiego czynnika wzrostu naskórka 2; CT, tomografia komputerowa; MRI, rezonans magnetyczny; ALT, aminotransferaza alaninowa; AST, aminotransferaza asparaginianowa; ALP, alkaline fosfataza; LDH, dehydrogenaza mleczanowa; gar, stosunek γ-glutamylotransferazy do albuminy; GGT, γ – glutamylotransferaza; ALB, albumina; CTCAE, Common Terminology Criteria for Adverse Events; GGN, górna granica normy.
4. Puente J, Lopez-Tarruella S, Ruiz a, Lluch a, Pastor M, Alba E, et al. Praktyczny wskaźnik prognostyczny dla pacjentów z nawrotowym rakiem piersi z przerzutami: retrospektywna analiza 2322 pacjentów z hiszpańskiego rejestru El Alamo GEICAM. Rak Piersi Res Leczyć. (2010) 122:591–600. doi: 10.1007/s10549–009-0687–4
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Regierer AC, Wolters R, Ufen MP, Weigel A, Novopashenny I, Kohne CH, et al. An internally and externally validated prognostic score for metastatic breast cancer: analysis of 2269 patients. Ann Oncol. (2014) 25:633–8. doi: 10.1093/annonc/mdt539
PubMed Abstract | CrossRef Full Text
6. Marko NF, Xu Z, Gao T, Kattan MW, Weil RJ. Przewidywanie przeżycia u kobiet z rakiem piersi i przerzutami do mózgu: nomogram przewyższa obecne modele przewidywania przeżycia. Rak. (2012) 118:3749–57. doi: 10.1002 / cncr.26716
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Subbiah IM, Lei X, Weinberg JS, Sulman EP, Chavez-MacGregor M, Tripathy D, et al. Walidacja i opracowanie zmodyfikowanej oceny prognostycznej piersi jako narzędzia przeżycia u pacjentów z rakiem piersi i przerzutami do mózgu. J Clin Oncol. (2015) 33:2239–45. doi: 10.1200 / JCO.2014.58.8517
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Lobbezoo DJ, van Kampen RJ, Voogd AC, Dercksen MW, van den Berkmortel F, Smilde TJ, et al. Rokowanie raka piersi z przerzutami: czy istnieją różnice między pacjentami z rakiem piersi de novo i nawrotowym rakiem piersi z przerzutami? Br J Cancer. (2015) 112:1445–51. doi: 10.1038/bjc.2015.127
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Duan XF, Dong NN, Zhang T, Li Q. The prognostic analysis of clinical breast cancer subtypes among patients with liver metastases from breast cancer. Int J Clin Oncol. (2013) 18:26–32. doi: 10.1007/s10147–011-0336-x
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dueck AC, Mendoza TR, Mitchell SA, Reeve BB, Castro KM, Rogak LJ, et al. Ważność i wiarygodność wersji Common Terminology Criteria for Adverse Events (PRO-CTCAE) opracowanej przez amerykański Narodowy Instytut Raka (National Cancer Institute) dotyczącej wyników badań pacjentów. JAMA Oncol. (2015) 1:1051–9. doi: 10.1001 / jamaoncol.2015.2639
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Xie J, Xu Z. badanie populacyjne dotyczące przerzutów do wątroby u kobiet z nowo rozpoznanym rakiem piersi. Cancer Epidemiol Biomarkers Prev. (2019) 28:283–92. doi: 10.1158/1055–9965.EPI-18–0591
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Dawood S, Broglio K, Ensor J, Hortobagyi GN, Giordano SH. Survival differences among women with de novo stage IV and relapsed breast cancer. Ann Oncol. (2010) 21:2169–74. doi: 10.1093/annonc/mdq220
PubMed Abstract | CrossRef Full Text
19. den Brok WD, Speers CH, Gondara L, Baxter E, Tyldesley SK, Lohrisch CA. Przeżycie z przerzutowym rakiem piersi w oparciu o początkową prezentację, de novo w porównaniu z nawrotem. Rak Piersi Res Leczyć. (2017) 161:549–56. doi: 10.1007 / s10549–016-4080–9
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Fujiwara R, Haag M, Schaeffeler e, Nies AT, Zanger UM, Schwab M. Systemic regulation of bilirubin homeostasis: potential benefits of hyperbilirubinemia. Hepatologia. (2018) 67:1609–19. doi: 10.1002/hep.29599
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Liu X, Meng QH, Ye Y, Hildebrandt MAT, Gu J, Wu X. Prognostic significance of pretreatment serum levels of albumin, LDH and total bilirubin in patients with non-metastatic breast cancer. Carcinogenesis. (2015) 36:243–8. doi: 10.1093/carcin/bgu247
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Vander Heiden MG, Cantley LC, Thompson CB. Zrozumienie efektu Warburga: wymagania metaboliczne proliferacji komórek. Nauka. (2009) 324:1029–33. 10.1126 / nauka1160809
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Mishra D, Banerjee D. dehydrogenazy Mleczanowe jako związki metaboliczne między guzem a zrębem w mikrośrodowisku nowotworu. Nowotwory. (2019) 11:750. doi: 10.3390/cancers11060750
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Pelizzari G, Basile D, Zago S, Lisanti C, Bartoletti M, Bortot L, et al. Lactate dehydrogenase (ldh) response to first-line treatment predicts survival in metastatic breast cancer: first clues for a cost-effective and dynamic biomarker. Cancers. (2019) 11:1243. doi: 10.3390/cancers11091243
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Hopkins AM, Rowland A, McKinnon RA, Sorich MJ. Predictors of long-term disease control and survival for HER2-positive advanced breast cancer patients treated with pertuzumab, trastuzumab, and docetaxel. Front Oncol. (2019) 9:789. doi: 10.3389/fonc.2019.00789
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Pentheroudakis G, Fountzilas G, Bafaloukos D, Koutsoukou V, Pectasides D, Skarlos D, et al. Przerzutowy rak piersi z przerzutami do wątroby: analiza rejestru kliniczno-patologicznych cech postępowania i wyników U 500 kobiet. Rak Piersi Res Leczyć. (2006) 97:237–44. doi: 10.1007 / s10549–005-9117–4
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply