Frontiers in Pharmacology
wprowadzenie
liposomy są rodzajem nanocarrier, które zostały szeroko zbadane dla celów dostarczania leków. Składają się one z dwuwarstw fosfolipidowych, które otaczają oddzielną przestrzeń wodną, umożliwiając w ten sposób kapsułkowanie związków hydrofilowych i hydrofobowych (Metselaar and Storm, 2005). Liposomy są w stanie stabilizować związki terapeutyczne i pokonywać bariery dla wychwytu komórkowego i tkankowego (Ding et al., 2006; Hua i Wu, 2013). Pozwala to im poprawić celowanie związków w miejsca choroby, a tym samym zmniejszyć akumulację w narządach innych niż docelowe (Bakker-Woudenberg et al., 1994; Mastrobattista et al., 1999; Hua, 2013; Hua et al., 2015; Sercombe et al., 2015; Zununi Vahed et al., 2017). Istnieją cztery główne typy liposomów oparte na ich charakterystyce powierzchniowej-konwencjonalne liposomy, pegylowane liposomy, liposomy ukierunkowane na ligand i liposomy teranostyczne (Fig., 2015). Liposomy ukierunkowane na Ligand zapewniają możliwość dostarczania leków specyficznych dla danego miejsca do niektórych tkanek lub narządów, które selektywnie wyrażają docelowy ligand (Willis i Forssen, 1998; Bendas, 2001; Sawant i Torchilin, 2012), podczas gdy pegylowane liposomy powodują przeszkodę steryczną w celu zwiększenia okresu półtrwania krążenia systemu dostarczania po podaniu systemowym (Torchilin, 1994; Wang i in., 2015). Liposomy zawierające kombinację różnych platform dostarczania mogą dodatkowo poprawić dostarczanie kapsułkowanych związków, w zależności od drogi podawania i miejsca choroby.
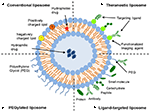
rysunek 1. Schematyczna reprezentacja różnych typów systemów dostarczania leków liposomowych – (a) konwencjonalny liposom, (B) pegylowany liposom, (C) liposom ukierunkowany na Ligand i (D) liposom Teranostic (Sercombe et al., 2015).
Po procesie produkcyjnym liposomy są scharakteryzowane w celu zapewnienia jednorodności w wielu parametrach, w tym hermetyzacji leku, koniugacji ligandu, składu lipidów, ładunku powierzchniowego i właściwości morfologicznych (np. rozmiar, kształt i liczba blaszek) (Kuntsche et al., 2011). Cechy te są ważne, ponieważ mogą mieć duży wpływ na zachowanie liposomów zarówno in vitro, jak i In vivo (Sawant and Torchilin, 2012; Sercombe et al., 2015). Rozpoznawanie i usuwanie liposomów przez mechanizmy obronne organizmu, w tym układ siateczkowo-śródbłonkowy (RES) i adsorpcja opsonin z późniejszym wychwytem przez jednojądrzasty układ fagocytarny, są głównymi przyczynami klirensu i degradacji liposomów (Senior, 1987; Cullis et al., 1998; Ishida et al., 2001). Dlatego możliwość określenia właściwości fizykochemicznych wytwarzanych liposomów jest ważna dla optymalizacji preparatu do dalszej oceny translacyjnej.
głównym aspektem w fizykochemicznej ocenie liposomów jest wizualizacja morfologii nanocząstek za pomocą mikroskopii. Istnieje wiele technik dostępnych do obrazowania liposomów i innych nanocząstek, które można szeroko podzielić na mikroskopię światła, elektronów lub sił atomowych (Bibi et al., 2011). Każda technika ma swoje zalety i ograniczenia, które należy wziąć pod uwagę przy ocenie badań nad systemami podawania leków na bazie nanocząstek (Tabela 1). Przegląd ten oceni każdą technikę obrazowania stosowaną do oceny cech morfologicznych liposomów.

tabela 1. Podsumowanie aktualnych technik obrazowania charakteryzujących morfologię liposomów.
mikroskopia świetlna
mikroskopia świetlna lub optyczna odnosi się do mikroskopów, które wykorzystują światło widzialne i układ soczewek do powiększania pola widzenia (Murphy and Davidson, 2012c). Podstawowa mikroskopia świetlna sama w sobie nie jest w stanie dostarczyć wyczerpujących informacji na temat dwuwarstwy lipidowej w porównaniu do szczegółów oferowanych przez inne techniki mikroskopii. Można go jednak wykorzystać do szybkiego uzyskania obrazu pęcherzyków przy użyciu podstawowego sprzętu laboratoryjnego (Bibi et al., 2011). Technika ta może być szczególnie przydatna podczas zbierania ogólnych informacji na temat wielkości, kształtu, jednorodności i stopnia agregacji próbki liposomu(Nallamothu et al., 2006). Mikroskopy świetlne mają ostateczną rozdzielczość ∼250 nm (regulowaną przez najmniejszy rozmiar plamki Ograniczony dyfrakcją, który może być osiągnięty przez instrument) i jako takie zazwyczaj nie są w stanie dostarczyć szczegółowych informacji dotyczących struktur małych pęcherzyków jednoamellarnych (SUV) i lamelowości pęcherzyków (Bibi et al., 2011). Ogólnie rzecz biorąc, mikroskopia świetlna może dostarczyć tylko istotnych informacji na temat gigantycznych pęcherzyków jednoamellarnych (Guv), które mogą mieć średnicę od jednego do setek mikrometrów (Bagatolli, 2009). Włączenie sond fluorescencyjnych, techniki polaryzacji i zastosowanie mikroskopii konfokalnej o wysokiej rozdzielczości może dostarczyć więcej informacji na temat struktury 3D i lamelowości pęcherzyków (Bagatolli, 2009).
mikroskopia Polaryzacyjna
ten rodzaj mikroskopii świetlnej wykorzystuje unikalną zdolność światła spolaryzowanego do interakcji z polaryzowalnymi wiązaniami uporządkowanych cząsteczek (Murphy and Davidson, 2012d). Zwiększona absorpcja światła występuje, gdy dipole molekularne w próbce są wyrównane z wektorem polaryzacji padającej fali świetlnej; w wyniku różnic fazowych między próbkującymi promieniami światła, które z kolei powodują zależne od interferencji zmiany amplitudy w płaszczyźnie obrazu (Murphy and Davidson, 2012d). Kontrast obrazu powstaje wtedy nie tylko z efektów interferencji i dyfrakcji, ale także z powodu obecności uporządkowanych układów molekularnych (Murphy and Davidson, 2012d). Może być stosowany do badania formy i dynamiki wielu uporządkowanych struktur komórkowych, w tym dwuwarstw lipidowych błon plazmatycznych (Bibi et al., 2011; Murphy and Davidson, 2012d). Obrazy można uzyskać w kolorze lub monochromatycznym. Technika ta zapewnia alternatywną metodę wizualizacji liposomów, szczególnie w celu potwierdzenia powstawania pęcherzyków. Nie dostarcza rozstrzygających obserwacji dotyczących właściwości dwuwarstwowych lub lamelowości pęcherzyków (Bibi et al., 2011). Ponadto mikroskopia polaryzacyjna jest również ograniczona przez rozmiar pęcherzyków, które mogą być wizualizowane, z dużymi pęcherzykami w zakresie mikrometrów o optymalnej klarowności. Technika ta nie zapewnia wyraźnych obrazów cząstek w zakresie nanometrów.
mikroskopia Fluorescencyjna
mikroskopia fluorescencyjna lub „epifluorescencyjna” jest specjalną formą mikroskopii świetlnej, która wykorzystuje zdolność fluorochromów do emitowania światła po wzbudzeniu światłem o określonej długości fali (Murphy and Davidson, 2012b). Technika ta jest szeroko stosowana w biofizyce, aby dostarczyć istotnych informacji na temat struktury i dynamiki komponentów membranowych (Bouvrais et al., 2010). W tych badaniach sondy fluorescencyjne są specjalnie włączone do badanej membrany, umożliwiając wizualizację struktury. Szeroka gama barwników fluorescencyjnych o różnych właściwościach chemicznych i fotonicznych jest dostępna w handlu, odpowiadając na różne pytania badawcze. Na przykład niektóre barwniki fluorescencyjne mogą preferować specyficzne środowiska membranowe wykazujące różne układy i boczne opakowanie (Bouvrais et al., 2010). Mikroskopia fluorescencyjna pozwala na jednoczesne stosowanie wielu sond w próbce w celu dostarczenia informacji o samej strukturze membrany. Sondy fluorescencyjne można umieścić w komorze wodnej, a także w dwuwarstwie lipidowej liposomów (Bibi i wsp ., 2011). Układ ten może być szczególnie przydatny podczas oglądania Guv, gdzie można uzyskać informacje dotyczące kształtu, wielkości i płynności pęcherzyków lipidowych (Klymchenko et al., 2009; Bouvrais et al., 2010). Włączenie sond, takich jak lipidy znakowane rodaminą, bezpośrednio do dwuwarstwy lipidowej może również umożliwić wizualizację lamelowości liposomów (Bibi et al., 2011).
wadą mikroskopii fluorescencyjnej jest to, że dodanie sond i barwników do systemu membranowego może potencjalnie zakłócać właściwości liposomalnego systemu dostarczania (Bouvrais et al., 2010; Bibi et al., 2011; Murphy and Davidson, 2012b). Wykazano jednak, że stosowanie niskich stężeń barwnika (≤1 mol%) ma minimalny wpływ na właściwości fizyczne błony (Bouvrais et al., 2010). Ważne jest również, aby pamiętać, że wybór barwnika fluorescencyjnego jest krytycznym krokiem, ponieważ niektóre barwniki mogą wywoływać duże zmiany w błonie gospodarza i / lub powodować eksperymentalne artefakty, powodując niedokładną interpretację danych (Bouvrais et al., 2010). Ponadto fotoindukowana peroksydacja lipidów może również prowadzić do tworzenia domen nawet w prostych układach barwnikowych. Proces ten może prowadzić do powstawania dużych tratw i spontanicznego tworzenia się faset (Bouvrais et al., 2010). Długotrwałe narażenie na światło fluorescencyjne może również prowadzić do wybielania i utraty intensywności fluorescencji. Dlatego wybór barwnika fluorescencyjnego i rozwój nowych sond membranowych są ważnymi względami przy użyciu mikroskopii fluorescencyjnej(Klymchenko et al., 2009).
Confocal Microscopy
Confocal scanning microscopy has been a advancement in the area of fluorescence microscopy. Zamiast oświetlać całą próbkę, obraz jest budowany przez skanowanie jednej (lub więcej) skupionych wiązek światła w całej próbce. Światło powracające z oświetlonej próbki przechodzi przez otwór, który odrzuca światło nieostre z góry i poniżej płaszczyzny zainteresowania; zapewnienie, że uzyskuje się tylko obrazy z małej głębi ostrości, znacznie poprawiając rozdzielczość poza płaszczyzną(Bibi et al., 2011; Murphy and Davidson, 2012a). Stosując tę technikę,” z-stos ” obrazów jest zbierany, począwszy od górnej części pęcherzyka, a następnie obrazy wykonane w określonych przyrostach z do dolnej części próbki, co daje złożony obraz 3D próbki (Bibi et al., 2011; Murphy and Davidson, 2012a). Konfokalna mikroskopia skaningowa stała się bardziej atrakcyjną techniką niż mikroskopy epifluorescencyjne ze względu na doskonałą klarowność obrazu. W przypadku GUVs technika ta jest w stanie wizualizować wewnętrzną strukturę systemów lipidowych, co często nie jest możliwe w przypadku innych metod mikroskopii (Ruozi et al., 2011; Mertins i Dimova, 2013). Na przykład, oddzielenie wodnej i lipidowej fazy dwuwarstwowej może być wyraźnie wizualizowane w większych pęcherzykach (Mertins and Dimova, 2013). Jednak mikroskopia konfokalna jest nadal ograniczona dyfrakcją i dlatego nie jest w stanie wytwarzać obrazów o wysokiej rozdzielczości SUV lub liposomów oligolamellarnych (Ruozi et al., 2011).
techniki Mikroskopii Elektronowej
mikroskopia elektronowa jest metodą wizualizacji pęcherzyków przy bardzo dużym powiększeniu (Henry, 2005). Jest szeroko stosowany w charakteryzacji pęcherzyków lipidowych jako długość fali elektronów (a zatem rozdzielczość ograniczona dyfrakcją), jest o wiele rzędów wielkości niższa niż w mikroskopii optycznej, a zatem zapewnia superrozdzielczość dla jasnej wizualizacji małych liposomów (Bibi et al., 2011; Ruozi et al., 2011). Technika ta wykorzystuje wiązkę elektronów skupionych na powierzchni próbki przez różne soczewki elektromagnetyczne. Elektrony są następnie rozpraszane przez próbkę, a następnie ponownie skupiane i powiększane przez kolejną serię soczewek elektromagnetycznych w kolumnie obrazowania, aby uzyskać rzutowany obraz (Henry, 2005). Istnieje wiele różnych typów mikroskopów elektronowych, z których każdy wymaga innej metody przygotowania próbki.
skaningowa mikroskopia elektronowa (sem)
skaningowa mikroskopia elektronowa (SEMs) wykorzystuje wiązkę elektronów, która jest skanowana w poprzek lub nad próbką (zamiast przez próbkę) w celu uzyskania powiększonego obrazu obiektu (Adler and Schiemann, 1985). Alder et al. pierwsza próba użycia SEM do scharakteryzowania liposomów w 1984 roku (Adler i Schiemann, 1985). Wykazali oni, że zastosowanie metody liofilizacji do przygotowania próbek liposomów do sem spowodowało dużą część widocznych grudek i skorupy materiału (Adler i Schiemann, 1985). Nowsze badania wykazały, że sama struktura liposomu może cierpieć na zaburzenia ze względu na warunki wysokiej próżni i procesy barwienia wymagane dla tej techniki przygotowania (Ruozi et al., 2011). SEM nie jest obecnie powszechnie stosowany do analizy liposomów, ponieważ wymaga wysuszenia lub zamocowania próbki przed obrazowaniem (Ruozi et al., 2011). Jednak SEM może dostarczyć ogólnych informacji na temat koncentrycznej struktury różnych warstw lipidowych, a także podać szczegóły dotyczące wielkości i sferycznej morfologii preparatu (Nirale et al., 2009).
transmisyjna mikroskopia elektronowa (tem)
transmisyjna mikroskopia elektronowa (TEM) jest najczęściej stosowaną metodą obrazowania do oceny struktury nanocząstek (Henry, 2005; Kuntsche et al., 2011). Polega na przygotowaniu cienkiej próbki (<o grubości 100 nm) umieszczonej w komorze próżniowej. Wiązka elektronów przecina próbkę, gdzie jest następnie skupiona przez soczewkę obiektywną, tworząc obraz. TEM może łatwo obrazować próbki miękkiej materii o rozdzielczości przestrzennej do znacznie poniżej 1 nm (Henry, 2005;Kuntsche et al., 2011; Ruozi et al., 2011). Technikę tę można dodatkowo sklasyfikować na podstawie zastosowanej metody przygotowania próbki – w szczególności negatywnego barwienia, zamrożenia i kriogenicznego TEM. Może dostarczyć informacji na temat modyfikacji powierzchni nanocząstek, ponieważ zapewnia lepszy kontrast i kontur obrazów niż inne techniki mikroskopowe. Na przykład, koniugacja transferryny na powierzchnię liposomów dspc / cholesterolu wykazała cząsteczkową powłokę powierzchniową z ujemną plamą TEM, której nie było w niezwiązanych preparatach liposomów (Anabousi i in., 2005). W oddzielnym doświadczeniu dodano specyficzne przeciwciała przeciwko ludzkiej transferrynie przed procedurą negatywnego zabarwienia w celu potwierdzenia tożsamości powłoki powierzchniowej cząstek stałych (Anabousi et al., 2005). Dlatego tem zapewnia możliwość osiągnięcia znacznie lepszej rozdzielczości podczas oceny sprzężenia ligandów z powierzchnią liposomów.
technika barwienia ujemnego
W tem-barwie ujemnej przygotowanie próbki polega na umieszczeniu niewielkiej ilości uwodnionej próbki na siatce. Ponieważ pęcherzyki są w bezpośrednim kontakcie z siatką, ich orientacja i morfologia może mieć wpływ, a zatem należy to wziąć pod uwagę (Bibi et al., 2011). Konieczne jest również osadzenie liposomów w odpowiednim materiale o gęstości elektronów (np., sole metali ciężkich, takie jak octan uranylu lub kwas fosfotungstowy), który zapewnia wysoki kontrast, dzięki czemu pęcherzyki można oglądać na ciemnym zabarwionym tle (Ruozi et al., 2011). Technika barwienia negatywowego jest stosunkowo szybka i prosta; wykazano jednak, że powoduje zmiany w pierwotnej strukturze liposomu i może prowadzić do tworzenia jasnych i ciemnych frędzli, które mogą być mylone z strukturami płytkowymi (Bibi et al., 2011; Ruozi et al., 2011). Ponadto umieszczenie próbki pod próżnią może spowodować dalsze odwodnienie próbki, co może ponownie spowodować zmiany w strukturze pęcherzyków (Bibi et al., 2011). Podczas gdy technika negative-stain TEM może zapewnić znacznie większe powiększenie dla obrazowania nanocząstek, uszkodzenie struktury liposomu utrudnia dokładną ocenę cech morfologicznych próbki. W związku z tym inne techniki obrazowania są na ogół wymagane w celu potwierdzenia wyników.
Technika liofilizacji
technika liofilizacji nie wymaga żadnego procesu suszenia i może dostarczyć dodatkowych informacji na temat wewnętrznej struktury nanocząstek (Kuntsche et al., 2011). Metoda ta polega na umieszczeniu próbki na siatce TEM, która jest umieszczona między dwoma miedzianymi lub złotymi uchwytami (Severs, 2007). Próbka jest witryfikowana poprzez szybkie zamrażanie, Zwykle ciekłym propanem lub ciekłym azotem, przed pęknięciem wzdłuż obszarów próbki o słabych oddziaływaniach molekularnych. Ta powierzchnia złamania może być dodatkowo wytrawiona i zacieniona cienką warstwą platyny lub węgla, aby zapewnić „negatywną” replikę płaszczyzny próbki złamania (Severs, 2007; Kuntsche et al., 2011). Replika jest następnie czyszczona rozpuszczalnikiem organicznym w celu usunięcia wszystkich pozostałości przed wizualizacją pod mikroskopem TEM. Ponieważ te repliki są tak stabilne, mogą być przechowywane i oglądane później(kuntsche et al., 2011). Główną zaletą tej techniki jest to, że repliki ściśle odzwierciedlają natywny stan próbki i mogą dostarczyć szczegółowych informacji na temat struktury 3D pęcherzyków i organizacji dwuwarstwowej(Bibi et al., 2011; Kuntsche et al., 2011). Informacje te obejmują wielowarstwową budowę i dwuwarstwowe pakowanie wielowarstwowych pęcherzyków. Technika ta może również oceniać wielkość agregatu i może być szczególnie przydatna do badania interakcji kationowych liposomów z DNA (Bibi et al., 2011). Jednak artefakty mogą nadal występować w próbce podczas przygotowywania z powodu niewystarczającej szybkości zamrażania, ponownego osadzania cząsteczek rozpuszczalnika i / lub naprężeń mechanicznych (Severs, 2007; Kuntsche et al., 2011). Na przykład, „efekt falowania” może wystąpić na SUV w próbce (Bibi et al., 2011). Jest to powszechna deformacja dwuwarstwowa, która jest spowodowana zaburzeniem przejścia łańcuchów acylowych przed zamrożeniem. Inkubowanie pęcherzyków między temperaturą przed przejściem a rzeczywistą temperaturą przejścia może również powodować zmarszczki (Bibi et al., 2011). Co ciekawe, może to być wykorzystane do dostarczenia informacji o przejściach fazy lipidowej, które występują przy różnym charakterze lipidów stosowanych w preparatach liposomalnych (Bibi et al., 2011).
tem kriogeniczny
tem kriogeniczny (cryo-TEM) jest odmianą tem, w której przed obrazowaniem stosuje się cienkie uwodnione filmy, które są zeszklone w ciekłym etanie. Technika ta pozwala na analizę liposomów w ich najbardziej natywnym stanie i jest cennym narzędziem do określenia wielkości, kształtu, struktury wewnętrznej i blaszkowości liposomów(Weisman et al., 2004; Bibi et al., 2011; Kuntsche et al., 2011). Główną zaletą szybkiego zamrażania próbek liposomów jest zminimalizowanie tworzenia się kryształków lodu i zachowanie białek lub innych materiałów (Bibi et al., 2011; Kuntsche et al., 2011). Jest to korzystne, gdy białka lub DNA zostały zamknięte w nanocząstkach (Weisman et al., 2004; Kuntsche et al., 2011). Cryo-TEM jest najbardziej użyteczną formą mikroskopii dostępną obecnie do badania liposomów, ponieważ pozwala uniknąć problemów z utrwalaniem chemicznym, odwodnieniem, cięciem i barwieniem – z których wszystkie mogą wpływać na morfologię pęcherzyków (Bibi et al., 2011). Zakres rozdzielczości wynosi ∼5 do 500 nm, zgodnie z grubością folii (Almgren et al., 2000). Należy jednak zauważyć kilka ograniczeń związanych z tą techniką, w tym fakt, że tylko obraz 2D jest uzyskiwany z obiektów 3D (co ogólnie odnosi się również do większości innych technik mikroskopowych). Aby przezwyciężyć to ograniczenie, możliwa jest rekonstrukcja kształtów 3D z wystarczająco dużej liczby obrazów 2D losowo zorientowanych cząstek nie sferycznych(Orlova et al., 1999), a także oglądanie próbki pod różnymi kątami nachylenia w celu uzyskania informacji o kształcie 3D (Van Antwerpen i Gilkey, 1994). Kriogeniczna tomografia elektronowa (cryo-ET) może być również stosowana do uzyskania obrazów 3D (Le Bihan et al., 2009). Cryo-TEM wykorzystuje również niższe dawki elektronów, co oznacza, że często ma niższą rozdzielczość w porównaniu do innych metod (Bibi et al., 2011; Kuntsche et al., 2011). Artefakty są nadal możliwe ze względu na tworzenie się cienkiej warstwy amorficznego lodu i zastosowanie blotting na próbce stosując siły ścinające podczas tworzenia filmu(Almgren et al., 2000; Bibi et al., 2011).
Environmental Scanning Electron Microscopy (ESEM)
Environmental scanning electron microscopy (ESEM) to system obrazowania, który nie wymaga stosowania mocowania, barwienia lub zamrażania pęcherzyków i może umożliwić obrazowanie dynamicznych zmian mokrych systemów bez wcześniejszego przygotowania próbki (Muscariello et al., 2005; Ruozi et al., 2011). Główną cechą ESEM jest obecność pary wodnej w komorze mikroskopowej. Zdolność do utrzymania atmosfery zawierającej wodę wokół próbki, która może być częściowo lub nawet całkowicie uwodniona, jest możliwa dzięki zastosowaniu systemu próżniowego z podziałką z wieloma otworami, który umożliwia utrzymywanie Komory obrazowania przy ciśnieniach do 55 hPa(Bibi et al., 2011; Ruozi et al., 2011). Pierwotna wiązka elektronów może generować elektrony wtórne, które następnie napotykają cząsteczki pary, prowadząc do kaskadowego wzmocnienia sygnału przed dotarciem do detektora. Z tego powodu ESEM nie wymaga przygotowania próbki (Muscariello et al., 2005). Technika ta pozwala na zmianę środowiska próbki poprzez szereg kompozycji ciśnienia, temperatury i gazu (Mohammed et al., 2004), co jest przydatne przy określaniu, w jaki sposób zmiany środowiskowe wpływają na pęcherzyki. Ma to zastosowanie do nanofarmaceutycznych preparatów i badań stabilności (Bibi et al., 2011). ESEM został również użyty do analizy załadunku leku do dwuwarstwy liposomów (Mohammed et al., 2004), a także określenie wielkości i kształtu pęcherzyków. Ograniczenie ESEM jest to, że nie może dostarczyć szczegółowych informacji dotyczących lamelowości i wewnętrznej architektury struktur nanoskali (Ruozi et al., 2011).
mikroskopia sił atomowych (AFM)
mikroskopia sił atomowych (AFM), znana również jako mikroskopia sił skaningowych (SFM), jest rodzajem techniki mikroskopii sondy skaningowej. Działa poprzez prowadzenie ostrej końcówki przymocowanej do wspornika i czujnika nad powierzchnią próbki i pomiar sił powierzchniowych między sondą a próbką (Sitterberg et al., 2010). Ponieważ wspornik biegnie wzdłuż powierzchni próbki, porusza się w górę iw dół ze względu na cechy powierzchni, a wspornik odpowiednio się odchyla. To ugięcie jest zwykle określane ilościowo za pomocą czujnika optycznego, przy czym wiązka laserowa jest odbijana z tyłu wspornika na detektorze światła (Sitterberg et al., 2010). AFM nie musi działać w próżni i może działać w otaczającym powietrzu lub pod cieczą; dlatego jest coraz częściej używany do obrazowania próbek biologicznych, a także nanocząstek (Liang et al., 2004a, B; Ruozi et al., 2005, 2009). AFM ma wyjątkową rozdzielczość w kolejności ułamków nanometru i może zapewnić trójwymiarowy obraz liposomów wraz ze szczegółami dotyczącymi morfologii, rozkładu wielkości, jednorodności i stabilności (Liang et al., 2004a, B; Ruozi et al., 2005, 2007, 2009). Co ważne, AFM może być stosowany do scharakteryzowania modyfikacji powierzchni liposomów i wykrywania ligandów (np. przeciwciał i polimerów) sprzężonych na powierzchni błony liposomalnej (Bendas et al., 1999; Moutardier et al., 2003; Anabousi et al., 2005; Liang et al., 2005). Na przykład, Bendas et al. wykorzystali AFM do powiększenia granicy błony liposomalnej i byli w stanie zobrazować struktury trimeryczne o średnicy około 8-10 nm, które reprezentowały sprzężenie przeciwciał IgG z powierzchnią liposomu (Bendas et al., 1999). Wyniki wykazały, że skuteczność tej techniki była w dużym stopniu zależna od zastosowanej metody koniugacji, przy czym przeciwciała sprzężone bezpośrednio z powierzchnią liposomalną były widoczne przy AFM (ograniczona mobilność białek), w porównaniu z przeciwciałami przyłączonymi do łańcuchów PEG. Sugerowano, że łańcuchy PEG powodowały wysoką mobilność białek i dlatego nie można ich było skanować (Bendas et al., 1999). Odwrotnie, Anabousi i wsp. wykazali, że włączenie Pegylowanych lipidów do liposomów wywołało steryczną stabilizację z liposomami utrzymującymi kulisty kształt (Anabousi i wsp., 2005). Obrazy AFM powierzchni niezwiązanych liposomów były gładkie i nie można było zaobserwować żadnych struktur, podczas gdy koniugację transferryny na powierzchnię Pegylowanych liposomów wizualizowano jako małe struktury kuliste (Anabousi i in., 2005). Podobnie Moutardier i wsp. wytwarzali liposomy z rdzeniami polimerowymi (LSP), które składały się z leków załadowanych do cząstek polimerowych, które tworzyły rdzeń pęcherzyków lipidowych (Moutardier i wsp., 2003). Zdjęcia wykonane przy użyciu AFM wykazały obecność sieci polimerowej na zewnętrznej powierzchni, co sugerowało, że rdzeń polimerowy kolagenu wypromieniował się i utworzył warstwę powierzchniową na LSP (Moutardier et al., 2003). Oprócz szczegółów konstrukcyjnych powierzchni, AFM może dostarczyć informacji o właściwościach mechanicznych i chemicznych powierzchni próbki poprzez pomiary siły (Ruozi et al., 2007). Na przykład, Mao et al. zastosował tę technikę do oceny elastyczności i właściwości klejących liposomów (Mao et al., 2004). Jednym z ograniczeń AFM jest konieczność adsorbowania nanocząstek na powierzchniach nośnych, takich jak Mika lub płytki krzemowe. Adsorpcja liposomów na stałym podłożu może zmieniać rozmiar i kształt pęcherzyków oraz powodować ich spłaszczenie. (Ruozi et al., 2007). Ponadto okresowy kontakt końcówki sondy może przeciągać liposomy, gdy porusza się po pęcherzykach w próbce(Jass et al., 2000). Mimo to AFM jest nadal użytecznym narzędziem w ocenie liposomów.
wniosek
istnieje szeroki zakres technik obrazowania dostępnych do oceny morfologii liposomów, z których każdy ma swoje zalety i wady. Mikroskopia świetlna może dostarczyć ogólnych szczegółów dotyczących wielkości i kształtu większych pęcherzyków oraz jednorodności próbki w stosunkowo szybki sposób. Odwrotnie, TEM jest najczęściej stosowaną techniką do znacznie bardziej szczegółowego badania morfologii liposomów; przy interpretacji wyników należy jednak wziąć pod uwagę możliwość zmian strukturalnych w każdym podtypie TEM spowodowanych barwieniem i/lub narażeniem na warunki próżniowe. ESEM jest najbardziej przydatny przy określaniu liposomalnych zmian w odpowiedzi na środowisko, podczas gdy AFM pojawia się jako użyteczna metoda w analizie morfologicznej nanocząstek i zapewnia maksymalną rozdzielczość powierzchni liposomalnej. Zarówno AFM, jak i TEM są zdolne do obrazowania ligandów sprzężonych z powierzchnią liposomów i dostarczają uzupełniających informacji na temat modyfikacji powierzchni. Ogólnie rzecz biorąc, wybór techniki zależy od tego, jakie cechy morfologiczne i stopień szczegółowości są wymagane. Ponadto, zrozumienie potencjalnych efektów metody przygotowania próbki każdej techniki obrazowania jest ważne w procesie selekcji.
wkład autora
opracowanie rękopisu: A-LR i SH. Recenzja artykułu pod kątem ważnych treści intelektualnych: SH, PD, JF, WP, AM, DS i AW.
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badanie zostało przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
podziękowania
autorzy pragną podziękować Pharmacy Research Trust of New South Wales, Rebecca L. Cooper Medical Research Foundation, Gladys M. Brawn Fellowship, ausEE Research Foundation i University of Newcastle za zapewnienie wsparcia finansowego dla naszych badań.
Adler, K., and Schiemann, J. (1985). Charakterystyka liposomów za pomocą skaningowej mikroskopii elektronowej i techniki zamrażania. Micron Microsc. Acta 16, 109-113. doi: 10.1016/0739-6260(85)90039-5
CrossRef Full Text/Google Scholar
Almgren, M., Edwards, K., and Karlsson, G. (2000). Krio transmisyjna mikroskopia elektronowa liposomów i struktur pokrewnych. Koloidy Surfują. Fizykochem. Inż. Asp. 174, 3–21. doi: 10.1016/S0927-7757(00)00516-1
CrossRef Pełny tekst/Google Scholar
Anabousi, S., Laue, M., Lehr, C. M., Bakowsky, U., and Ehrhardt, C. (2005). Ocena modyfikacji transferryny liposomów za pomocą mikroskopii sił atomowych i transmisyjnej mikroskopii elektronowej. Eur. J. Pharm. Biofarm. 60, 295–303. doi: 10.1016 / j.ejpb.2004.12.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Membrany i mikroskopia Fluorescencyjna. Recenzje w Fluorescence 2007.
CrossRef Full Text/Google Scholar
Bakker-Woudenberg, I. A., Storm, G., oraz Woodle, M. C. (1994). Liposomy w leczeniu zakażeń. J. Cel Narkotykowy. 2, 363–371. doi: 10.3109/10611869408996811
PubMed Abstract | CrossRef Full Text/Google Scholar
Bendas, G. (2001). Immunoliposomy: obiecujące podejście do ukierunkowania terapii nowotworowej. Biodrugi 15, 215-224. doi: 10.2165/00063030-200115040-00002
CrossRef Pełny tekst/Google Scholar
Bendas, G., Krause, A., Bakowsky, U., Vogel, J., and Rothe, U. (1999). Celowalność nowych immunoliposomów przygotowanych nową techniką koniugacji przeciwciała. Int. J. Pharm. 181, 79–93. doi: 10.1016/s0378-5173(99)00002-2
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Bibi, S., Kaur, R., Henriksen-Lacey, M., McNeil, S. E., Wilkhu, J., Lattmann, E., et al. (2011). Mikroskopowe zobrazowanie liposomów: od pokrywek do sem środowiska. Int. J. Pharm. 417, 138–150. doi: 10.1016 / j.ijpharm.2010.12.021
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Bouvrais, H., Pott, T., Bagatolli, L. A., Ipsen, J. H., and Meleard, P. (2010). Wpływ sond fluorescencyjnych zakotwiczonych membranowo na właściwości mechaniczne dwuwarstw lipidowych. Biochim. Biophys. Acta 1798, 1333-1337. doi: 10.1016 / j.bbamem.2010.03.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Interakcje liposomów i nośników opartych na lipidach z białkami krwi: związek z zachowaniem klirensu in vivo. ADV.Lek Deliv. Obj.32, 3-17. doi: 10.1016/S0169-409x(97)00128-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Ding, B. S., Dziubla, T., Shuvaev, V. V., Muro, S., and Muzykantov, V. R. (2006). Zaawansowane systemy dostarczania leków, które kierują się na śródbłonek naczyniowy. Mol. Interv. 6, 98–112. 10.1124 / mi.6.2.7
PubMed Abstract | CrossRef Full Text | Google Scholar
Morfologia podtrzymywanych nanocząstek. Prog. Surfuj. Sci. 80, 92–116. doi: 10.1016 / j.progsurf.2005.09.004
CrossRef Full Text | Google Scholar
Celowanie w miejsca zapalenia: międzykomórkowa cząsteczka adhezji – 1 jako cel nowych terapii zapalnych. Przód. Pharmacol. 4:127. doi: 10.3389 / fphar.2013.00127
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Hua, S., Marks, E., Schneider, JJ, and Keely, S. (2015). Postępy w doustnych systemach nano-dostarczania leków ukierunkowanych na jelita grubego w zapalnej chorobie jelit: selektywne ukierunkowanie na chorą a zdrową tkankę. 1117-1132 doi: 10.1016 / j.nano.2015.02.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Zastosowanie nanocarriers na bazie lipidów do ukierunkowanych terapii bólu. Przód. Pharmacol. 4:143. doi: 10.3389 / fphar.2013.00143
PubMed Abstract | CrossRef Full Text | Google Scholar
Ishida, T., Harashima, H., and Kiwada, H. (2001). Interakcje liposomów z komórkami in vitro i In vivo: opsonins and receptors. Curr. Drug Metab. 2, 397–409. doi: 10.2174/1389200013338306
PubMed Abstract | CrossRef Full Text | Google Scholar
Jass, J., Tjarnhage, T., and Puu, G. (2000). From liposomes to supported, planar bilayer structures on hydrophilic and hydrophobic surfaces: an atomic force microscopy study. Biophys. J. 79, 3153–3163. doi: 10.1016/S0006-3495(00)76549-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Klymchenko, A. S., Oncul, S., Didier, P., Schaub, E., Bagatolli, L., Duportail, G., et al. (2009). Wizualizacja domen lipidowych w gigantycznych pęcherzykach jednowarstwowych za pomocą wrażliwej dla środowiska sondy membranowej opartej na 3-hydroksyflawonie. Biochim. Biophys. Acta 1788, 495-499. doi: 10.1016 / j.bbamem.2008.10.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuntsche, J., Horst, J. C., and Bunjes, H. (2011). Kriogeniczna transmisyjna mikroskopia elektronowa (cryo-TEM) do badania morfologii koloidalnych systemów dostarczania leków. Int. J. Pharm. 417, 120–137. doi: 10.1016 / j.ijpharm.2011.02.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Le Bihan, O., Bonnafous, P., Marak, L., Bickel, T., Trepout, S., Mornet, S., et al. (2009). Krio-elektronowa tomografia nanocząstek transmigracji do liposomu. J. Struct. Biol. 168, 419–425. doi: 10.1016 / j.jsb.2009.07.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Właściwości mechaniczne i stabilność pomiar liposomu zawierającego cholesterol Na mice za pomocą mikroskopii sił atomowych. J. Colloid Interface Sci. 278, 53–62.
PubMed Abstrakt/Google Scholar
Wpływ długości łańcuchów PEO-PPO-PEO na morfologię i stabilność liposomów małych jednoamellarnych: badanie AFM. J. Colloid Interface Sci. 285, 360–372. doi: 10.1016 / j.jcis.2004.11.042
PubMed Abstract | CrossRef Full Text | Google Scholar
Liang, X., Mao, G., and Simon Ng, K. Y. (2004b). Badanie małych jednoamellarnych pęcherzyków EggPC na powierzchni Miki za pomocą mikroskopii sił atomowych. Koloidy Surfują. B Biointerfaces 34, 41-51.
PubMed Abstrakt/Google Scholar
Encyklopedia nanonauki i Nanotechnologii. Nowy Jork, NY: Marcel Dekker.
Google Scholar
Mastrobattista, E., Koning, G. A., and Storm, G. (1999). Immunoliposomy do ukierunkowanego dostarczania leków przeciwnowotworowych. ADV.Lek Deliv. Rev. 40, 103-127. doi: 10.1016/S0169-409X(99)00043-5
CrossRef Full Text/Google Scholar
Mertins, O., and Dimova, R. (2013). Spostrzeżenia na temat interakcji chitozanu z pęcherzykami fosfolipidowymi. Część II: usztywnienie membrany i tworzenie porów. Langmuir 29, 14552-14559. doi: 10.1021/la4032199
PubMed Abstract | CrossRef Full Text/Google Scholar
Metselaar, J. M., and Storm, G. (2005). Liposomy w leczeniu zaburzeń zapalnych. Ekspert Opin. Lek Deliv. 2, 465–476. doi: 10.1517/17425247.2.3.465
PubMed Abstract | CrossRef Full Text/Google Scholar
, Coombes, A. G., Fitzgerald, M., and Perrie, Y. (2004). Preparat liposomowy słabo rozpuszczalnych w wodzie leków: optymalizacja obciążenia lekiem i analiza stabilności ESEM. Int. J. Pharm. 285, 23–34. doi: 10.1016 / j.ijpharm.2004.07.010
PubMed Abstract | CrossRef Full Text/Google Scholar
Moutardier, V., Tosini, F., Vlieghe, P., Cara, L., Delpero, J. R., and Clerc, T. (2003). Biodostępność koloidalnych leków przeciwnowotworowych w modelach podawania doustnego. Int. J. Pharm. 260, 23–38. doi: 10.1016/S0378-5173(03)00231-X
PubMed Streszczenie | CrossRef Pełny tekst/Google Scholar
Murphy, D. B., and Davidson, M. W. (2012a). Konfokalna Laserowa Mikroskopia Skaningowa. Fundamentals of Light Microscopy and Electronic Imaging, 2nd Edn. Hoboken, NJ: John Wiley & Sons, 265-305. doi: 10.1002/9781118382905.ch13
CrossRef Full Text/Google Scholar
Mikroskopia Fluorescencyjna. Podstawy mikroskopii świetlnej i obrazowania elektronicznego. Weinheim: John Wiley & doi: 10.1002/9781118382905.ch11
CrossRef Full Text/Google Scholar
Podstawy mikroskopii świetlnej i obrazowania elektronicznego. Hoboken, NJ: John Wiley & doi: 10.1002 / 9781118382905
CrossRef Full Text/Google Scholar
Mikroskopia Polaryzacyjna. Podstawy mikroskopii świetlnej i obrazowania elektronicznego. Hoboken, NJ: John Wiley & doi: 10.1002/9781118382905.ch9
CrossRef Pełny tekst/Google Scholar
Muscariello, L., Rosso, F., Marino, G., Giordano, A., Barbarisi, M., Cafiero, G., et al. (2005). Krytyczny przegląd zastosowań ESEM w dziedzinie biologicznej. J. Cell. Physiol. 205, 328–334. doi: 10.1002 / jcp.20444
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Nallamothu, R., Wood, G. C., Pattillo, C. B., Scott, R. C., Kiani, M. F., Moore, B. M., et al. (2006). A tumor vasculature targeted liposome delivery system for combretastatin A4: design, characterization, and in vitro evaluation. AAPS PharmSciTech 7: E32. doi: 10.1208 / pt070232
PubMed Abstract | CrossRef Full Text | Google Scholar
Nirale, N. M., Vidhate, R. D., and Nagarsenker, M. S. (2009). Liposomy propionianu flutykazonu do podawania płucnego. Indian J. Pharm. Sci. 71, 709–711.
Google Scholar
Orlova, E. V., Sherman, M. B., Chiu, W., Mowri, H., Smith, L. C., and Gotto, A. M. Jr. (1999). Three-dimensional structure of low density lipoproteins by electron cryomicroscopy. Proc. Natl. Acad. Sci. U.S.A. 96, 8420–8425. doi: 10.1073/pnas.96.15.8420
CrossRef Full Text | Google Scholar
Ruozi, B., Belletti, D., Tombesi, A., Tosi, G., Bondioli, L., Forni, F., et al. (2011). AFM, ESEM, TEM, and CLSM in liposomal characterization: a comparative study. Int. J. Nanomedicine 6, 557–563. doi: 10.2147/IJN.S14615
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruozi, B., Tosi, G., Forni, F., Fresta, M., and Vandelli, M. A. (2005). Atomic force microscopy and photon correlation spectroscopy: two techniques for rapid characterization of liposomes. Eur. J. Pharm. Sci. 25, 81–89. doi: 10.1016 / j.ejps.2005.01.020
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruozi, B., Tosi, G., Leo, E., and Vandelli, M. A. (2007). Zastosowanie mikroskopii sił atomowych do scharakteryzowania liposomów jako nośników leków i genów. Talanta 73, 12-22 doi: 10.1016 / j.talanta.2007.03.031
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruozi, B., Tosi, G., Tonelli, M., Bondioli, L., Mucci, A., Forni, F., et al. (2009). AFM phase imaging of soft-hydrated samples: wszechstronne narzędzie do zakończenia chemiczno-fizycznego badania liposomów. J. Liposome Res. 19, 59-67. doi: 10.1080/08982100802584071
PubMed Abstract | CrossRef Full Text/Google Scholar
Sawant, R. R., and Torchilin, V. P. (2012). Wyzwania w rozwoju ukierunkowanych terapii liposomalnych. AAPS J. 14, 303-315. doi: 10.1208 / s12248-012-9330-0
PubMed Abstract | CrossRef Full Text/Google Scholar
Los i zachowanie liposomów in vivo: przegląd czynników kontrolujących. Hematokryt. Rev.Ther. System Nośników Narkotyków. 3, 123–193.
PubMed Abstrakt/Google Scholar
Sercombe, L., Veerati, T., Moheimani, F., Wu, S. Y., Sood, A. K., and Hua, S. (2015). Postępy i wyzwania dostarczania leków wspomaganych liposomami. Przód. Pharmacol. 6:286. doi: 10.3389 / fphar.2015.00286
CrossRef Full Text | Google Scholar
Severs, N. J. (2007). Freeze-fracture electron microscopy. Nat. Protoc. 2, 547–576. doi: 10.1038/nprot.2007.55
PubMed Abstract | CrossRef Full Text | Google Scholar
Sitterberg, J., Ozcetin, A., Ehrhardt, C., and Bakowsky, U. (2010). Utilising atomic force microscopy for the characterisation of nanoscale drug delivery systems. Eur. J. Pharm. Biopharm. 74, 2–13. doi: 10.1016/j.ejpb.2009.09.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Immunoliposomy i pegylowane immunoliposomy: możliwe zastosowanie do ukierunkowanego dostarczania środków obrazujących. Immunomethods 4, 244-258. doi: 10.1006 / immu.1994.1027
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Antwerpen, R., and Gilkey, J. C. (1994). Mikroskopia krioelektronowa ujawnia podrostrukturę ludzkiej lipoproteiny o niskiej gęstości. J. Lipiński Res. 35, 2223-2231.
PubMed Abstract | Google Scholar
Wang, X., Song, Y., Su, Y., Tian, Q., Li, B., Quan, J., et al. (2015). Are PEGylated liposomes better than conventional liposomes? A special case for vincristine. Drug Deliv. 29, 1–9. doi: 10.3109/10717544.2015.1027015
PubMed Abstract | CrossRef Full Text | Google Scholar
Weisman, S., Hirsch-Lerner, D., Barenholz, Y., and Talmon, Y. (2004). Nanostructure of cationic lipid-oligonucleotide complexes. Biophys. J. 87, 609–614. doi: 10.1529/biophysj.103.033480
PubMed Abstract | CrossRef Full Text | Google Scholar
Liposomy ukierunkowane na Ligand. ADV.Lek Deliv. Rev. 29, 249-271. doi: 10.1016/S0169-409x(97)00083-5
CrossRef Pełny tekst/Google Scholar
Zununi Vahed, S., Salehi, R., Davaran, S., and Sharifi, S. (2017). Oparte na liposomach systemy współdzielenia leków w komórkach nowotworowych. Złomku. Sci. Inż. C Złomek. Biol. Appl. 71, 1327–1341. doi: 10.1016 / j.msec.2016.11.073
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply