Halobetasol Propionian maść
postać dawkowania: maść
Drugs.com. Ostatnia aktualizacja: 1 marca 2020 r.
- przegląd
- skutki uboczne
- dawkowanie
- profesjonalne
- interakcje
- Więcej
Halobetasol Propionate maść opis
Halobetasol Propionate maść, 0,05% zawiera halobetasol propionate, syntetyczny kortykosteroid do miejscowego stosowania dermatologicznego. Kortykosteroidy stanowią klasę głównie syntetycznych steroidów stosowanych miejscowo jako środek przeciwzapalny i przeciwświądowy.
chemicznie propionian halobetasolu to 21-chloro-6α, 9-difluoro-11β, 17-dihydroksy-16β-metylopregna-1, 4-dien-3-20-Dion, 17-propionian, C25H31ClF2O5. Ma następujący wzór strukturalny:
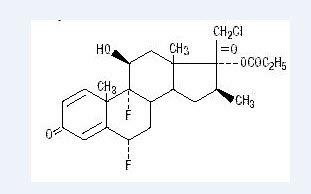
propionian Halobetasolu ma masę cząsteczkową 485. Jest to biały krystaliczny proszek nierozpuszczalny w wodzie.
każdy gram maści Propionianowej Halobetasolu zawiera 0.5 mg/g propionianu halobetasolu na bazie stearynianu glinu, wosku pszczelego, kokosanu pentaerytrytolu, wazeliny, glikolu propylenowego, seskwioleinianu sorbitanu i cytrynianu stearylu.
Halobetasol Propionate maść – Farmakologia kliniczna
podobnie jak inne miejscowe kortykosteroidy, halobetasol Propionate ma działanie przeciwzapalne, przeciwświądowe i zwężające naczynia krwionośne. Mechanizm działania przeciwzapalnego miejscowych kortykosteroidów jest ogólnie niejasny. Uważa się jednak, że kortykosteroidy działają poprzez indukcję białek hamujących fosfolipazę A2, zwanych łącznie lipokortynami. Postuluje się, że białka te kontrolują biosyntezę silnych mediatorów stanu zapalnego, takich jak prostaglandyny i leukotrieny poprzez hamowanie uwalniania ich wspólnego prekursora kwasu arachidonowego. Kwas arachidonowy jest uwalniany z fosfolipidów błonowych przez fosfolipazę A2.
farmakokinetyka
stopień przezskórnego wchłaniania kortykosteroidów stosowanych miejscowo zależy od wielu czynników, w tym nośnika i integralności bariery naskórkowej. Nie wykazano, aby opatrunki okluzyjne z hydrokortyzonem przez okres do 24 godzin zwiększały penetrację; jednakże okluzja hydrokortyzonu przez okres 96 godzin znacznie zwiększa penetrację. Miejscowe kortykosteroidy mogą być wchłaniane z normalnej nienaruszonej skóry. Zapalenie i / lub inne procesy chorobowe w skórze mogą zwiększać wchłanianie przez skórę.
badania na ludziach i zwierzętach wykazały, że mniej niż 6% zastosowanej dawki propionianu halobetasolu wchodzi do krążenia w ciągu 96 godzin po miejscowym podaniu maści Propionianowej Halobetasolu.
badania przeprowadzone z maścią Propionianową Halobetasol wskazują, że jest ona w bardzo wysokim zakresie działania w porównaniu z innymi miejscowo stosowanymi kortykosteroidami.
wskazania i zastosowanie maści Propionianowej Halobetasol
maść Propionianowa Halobetasol jest kortykosteroidem o bardzo dużej mocy wskazanym do łagodzenia objawów zapalnych i świądowych dermatoz reagujących na kortykosteroidy. Leczenie trwające dłużej niż dwa kolejne tygodnie nie jest zalecane, a całkowita dawka nie powinna przekraczać 50 g/tydzień ze względu na możliwość zahamowania osi podwzgórze-przysadka-nadnercza (HPA). Nie zaleca się stosowania u dzieci w wieku poniżej 12 lat.
podobnie jak w przypadku innych silnie aktywnych kortykosteroidów, leczenie należy przerwać po uzyskaniu kontroli. Jeśli w ciągu 2 tygodni nie zauważono poprawy, może być konieczna ponowna ocena diagnozy.
przeciwwskazania
maść Propionianowa Halobetasol jest przeciwwskazana u pacjentów z nadwrażliwością na którykolwiek ze składników preparatu w wywiadzie.
środki ostrożności
ogólne
ogólnoustrojowe wchłanianie kortykosteroidów do stosowania miejscowego może powodować odwracalną supresję osi podwzgórze – przysadka-nadnercza (HPA) z możliwością wystąpienia niewydolności glikokortykosteroidów po zakończeniu leczenia. Objawy zespołu Cushinga, hiperglikemia i glukozuria mogą być również wytwarzane u niektórych pacjentów przez ogólnoustrojowe wchłanianie miejscowych kortykosteroidów podczas leczenia.
pacjenci stosujący miejscowo Steroid na dużej powierzchni lub w miejscach niedrożności powinni być okresowo oceniani pod kątem objawów supresji osi HPA. Można to zrobić za pomocą stymulacji ACTH, A. M. kortyzolu w osoczu i moczu wolnego kortyzolu testy. Pacjenci otrzymujący bardzo silne kortykosteroidy nie powinni być leczeni dłużej niż przez 2 tygodnie i tylko małe obszary powinny być leczone jednocześnie ze względu na zwiększone ryzyko supresji HPA.
maść Propionianowa Halobetasolu powodowała zahamowanie osi HPA, gdy była stosowana w dawkach podzielonych po 7 gramów na dobę przez tydzień u pacjentów z łuszczycą. Działania te ustępowały po przerwaniu leczenia.
W przypadku zauważenia supresji osi HPA należy podjąć próbę wycofania leku, zmniejszenia częstości stosowania lub zastąpienia mniej silnego kortykosteroidu. Przywrócenie funkcji osi HPA jest na ogół szybkie po odstawieniu kortykosteroidów stosowanych miejscowo. Rzadko mogą wystąpić objawy podmiotowe i przedmiotowe niewydolności glikokortykosteroidów, wymagające uzupełnienia kortykosteroidów ogólnoustrojowych. Informacje na temat suplementacji ogólnoustrojowej, Patrz informacje dotyczące przepisywania tych produktów.
pacjenci pediatryczni mogą być bardziej podatni na toksyczność ogólnoustrojową po zastosowaniu równoważnych dawek ze względu na większy stosunek powierzchni skóry do masy ciała (patrz środki ostrożności: stosowanie u dzieci).
W przypadku wystąpienia podrażnienia należy przerwać stosowanie maści Propionianowej Halobetasolu i wdrożyć odpowiednie leczenie. Alergiczne kontaktowe zapalenie skóry z kortykosteroidami jest zwykle diagnozowane przez obserwację braku wyleczenia, a nie zauważając zaostrzenia klinicznego, jak w przypadku większości miejscowych produktów nie zawierających kortykosteroidów. Taka obserwacja powinna być potwierdzona odpowiednimi testami diagnostycznymi.
W przypadku współistniejących zakażeń skóry należy zastosować odpowiedni środek przeciwgrzybiczy lub Przeciwbakteryjny. Jeśli korzystna odpowiedź nie wystąpi szybko, należy przerwać stosowanie maści Propionianowej Halobetasolu do czasu uzyskania odpowiedniej kontroli zakażenia.
maści Propionianowej Halobetasol nie należy stosować w leczeniu trądziku różowatego lub okołoustnego zapalenia skóry i nie należy jej stosować Na twarz, pachwinę ani w pachwinach.
informacje dla pacjentów
pacjenci stosujący miejscowo kortykosteroidy powinni otrzymać następujące informacje i instrukcje:
- lek należy stosować zgodnie z zaleceniami lekarza. Jest przeznaczony wyłącznie do użytku zewnętrznego. Unikać kontaktu z oczami.
- lek nie powinien być stosowany w przypadku innych zaburzeń niż te, na które został przepisany.
- leczony obszar skóry nie powinien być zabandażowany, w inny sposób zakryty lub owinięty, tak aby był okluzyjny, chyba że zaleci go lekarz.
- pacjenci powinni zgłaszać lekarzowi wszelkie objawy miejscowych działań niepożądanych.\
badania laboratoryjne
następujące testy mogą być pomocne w ocenie pacjentów pod kątem supresji osi HPA: test stymulacji ACTH; test kortyzolu w osoczu A. M.; Test wolnego kortyzolu w moczu.
Rakotwórczość, mutageneza, zaburzenia płodności
nie przeprowadzono długoterminowych badań na zwierzętach w celu oceny potencjalnego działania rakotwórczego propionianu halobetasolu. W dwóch badaniach genotoksyczności zaobserwowano pozytywne działanie mutagenne. Propionian halobetasolu był pozytywny w teście mikrojąderkowym chomika chińskiego oraz w teście mutacji genu chłoniaka myszy in vitro.
badania na szczurach po podaniu doustnym dawek do 50 µg/kg mc./dobę nie wykazały zaburzeń płodności ani ogólnej zdolności reprodukcyjnej.
w innych badaniach genotoksyczności nie stwierdzono genotoksyczności propionianu halobetasolu w teście Amesa/Salmonella, w teście wymiany chromatydów siostrzanych w komórkach somatycznych chomika chińskiego, w badaniach aberracji chromosomowej komórek germinalnych i somatycznych gryzoni oraz w teście punktowym ssaków w celu określenia mutacji punktowych.
ciąża
działanie teratogenne: ciąża kategorii C
wykazano, że kortykosteroidy mają działanie teratogenne u zwierząt laboratoryjnych, gdy są podawane układowo przy stosunkowo małych dawkach. Wykazano, że niektóre kortykosteroidy mają działanie teratogenne po podaniu przez skórę u zwierząt laboratoryjnych.
wykazano, że propionian Halobetasolu działa teratogennie u szczurów z SPF i królików typu szynszyli, gdy jest podawany układowo w okresie ciąży w dawkach od 0, 04 do 0, 1 mg/kg mc.u szczurów i 0, 01 mg/kg mc. u królików. Dawki te są odpowiednio około 13, 33 i 3 razy większe od dawki propionianu Halobetasolu stosowanej u ludzi. Propionian halobetasolu wykazywał działanie embriotoksyczne u królików, ale nie u szczurów.
rozszczep podniebienia obserwowano zarówno u szczurów, jak i u królików. Omphalocele obserwowano u szczurów, ale nie u królików.
nie przeprowadzono odpowiednich i dobrze kontrolowanych badań dotyczących działania teratogennego propionianu halobetasolu u kobiet w ciąży. Maść propionianowa halobetasolu powinna być stosowana w okresie ciąży tylko wtedy, gdy potencjalne korzyści przeważają nad potencjalnym ryzykiem dla płodu.
matki karmiące
kortykosteroidy podawane układowo pojawiają się w mleku matki i mogą hamować wzrost, zakłócać wytwarzanie endogennych kortykosteroidów lub powodować inne niepożądane działania. Nie wiadomo, czy miejscowe podawanie kortykosteroidów może spowodować wchłanianie ogólnoustrojowe wystarczające do wytworzenia wykrywalnych ilości w mleku ludzkim. Ponieważ wiele leków przenika do mleka kobiecego, należy zachować ostrożność podczas podawania maści Propionianowej Halobetasolu kobietom karmiącym piersią.
stosowanie u dzieci
Bezpieczeństwo i skuteczność maści Propionianowej Halobetasol u dzieci nie zostały ustalone i nie zaleca się stosowania u dzieci w wieku poniżej 12 lat. Ze względu na większy stosunek powierzchni skóry do masy ciała, pacjenci pediatryczni są narażeni na większe niż dorośli ryzyko supresji osi HPA i zespołu Cushinga, gdy są leczeni miejscowo kortykosteroidami. W związku z tym są one również narażone na większe ryzyko niewydolności nadnerczy w trakcie lub po zakończeniu leczenia. U niemowląt i dzieci zgłaszano działania niepożądane, w tym rozstępy w przypadku niewłaściwego stosowania kortykosteroidów do stosowania miejscowego.
u dzieci otrzymujących miejscowo kortykosteroidy obserwowano zahamowanie osi HPA, zespół Cushinga, liniowe opóźnienie wzrostu, opóźniony przyrost masy ciała i nadciśnienie wewnątrzczaszkowe. Objawy supresji nadnerczy u dzieci obejmują niski poziom kortyzolu w osoczu i brak odpowiedzi na stymulację ACTH. Objawy nadciśnienia śródczaszkowego obejmują wybrzuszenie ciemiączek, bóle głowy i obustronne brodawczaka.
stosowanie w podeszłym wieku
spośród 850 pacjentów leczonych propionianem Halobetasolu w badaniach klinicznych, 21% miało 61 lat i więcej, a 6% miało 71 lat i więcej. Nie obserwowano ogólnych różnic w bezpieczeństwie lub skuteczności pomiędzy tymi pacjentami a młodszymi pacjentami; inne doniesienia kliniczne nie wykazały różnic w odpowiedziach pomiędzy pacjentami w podeszłym wieku a młodszymi pacjentami, ale nie można wykluczyć większej wrażliwości u niektórych osób starszych.
działania niepożądane
w kontrolowanych badaniach klinicznych najczęstszymi działaniami niepożądanymi zgłaszanymi w przypadku maści Propionianowej Halobetasolu było pieczenie lub pieczenie u 1, 6% pacjentów. Rzadziej zgłaszanymi działaniami niepożądanymi były krostkowanie, rumień, zanik skóry, leukoderma, trądzik, świąd, wtórne zakażenie, teleangiektazja, pokrzywka, suchość skóry, miliaria, parestezje i wysypka.
następujące dodatkowe miejscowe działania niepożądane są zgłaszane rzadko w przypadku kortykosteroidów stosowanych miejscowo i mogą występować częściej w przypadku kortykosteroidów o dużej sile działania, takich jak maść Propionianowa Halobetasolu. Reakcje te są wymienione w przybliżonej, malejącej kolejności występowania: zapalenie mieszków włosowych, hipertrichoza, wykwity trądzikowe, hipopigmentacja, okołoustne zapalenie skóry, alergiczne kontaktowe zapalenie skóry, wtórne zakażenie, rozstępy i miliaria.
aby zgłosić podejrzewane działania niepożądane, skontaktuj się z Teligent Pharma, Inc. w 1-856-697-1441 lub FDA w 1-800-FDA-1088 lub www.fda.gov / medwatch.
przedawkowanie
miejscowo stosowana maść z propionianem Halobetasolu może być wchłaniana w wystarczających ilościach, aby wywołać działanie ogólnoustrojowe (patrz środki ostrożności)h
maść z propionianem Halobetasolu Dawkowanie i sposób podawania
cienką warstwę maści z propionianem Halobetasolu nanieść na dotkniętą skórę raz lub dwa razy na dobę, zgodnie z zaleceniami lekarza, i wcierać delikatnie i całkowicie.
maść Propionianowa Halobetasol jest miejscowym kortykosteroidem o bardzo dużej mocy; dlatego leczenie należy ograniczyć do dwóch tygodni i nie należy stosować dawek większych niż 50 g/m2. Podobnie jak w przypadku innych kortykosteroidów, leczenie należy przerwać po osiągnięciu kontroli. Jeśli w ciągu 2 tygodni nie zauważono poprawy, może być konieczna ponowna ocena diagnozy.
maści Propionianowej Halobetasolu nie należy stosować z opatrunkami okluzyjnymi.
W Jaki Sposób dostarczana jest maść Propionianowa Halobetasol
maść Propionianowa Halobetasol, 0,05% jest dostarczana w następujących rozmiarach rurek:
50 g (NDC 63739-998-67)
przechowywanie
przechowywać maść Propionianową Halobetasolu w temperaturze od 15°C do 30°C (59°F i 86°F).
Producent:
Teligent Pharma, Inc.
Buena, NJ 08310
Dystrybucja:
McKesson Corporation
dba Sky Packaging
4971 Southridge Blvd., Suite 101
Memphis, TN 38141
PI-073-00
C101430 Rev 02/2020
Etykieta opakowania.Główny panel wyświetlacza 50 gram karton
NDC 63739-998-67
Halobetasol Propionian
maść, 0,05%
tylko do stosowania miejscowego.
nie do stosowania w oczach.
Net Wt. 50 grams
Rx Only

| HALOBETASOL PROPIONATE Halobetasol Propionate Ointment |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – McKesson Corporation (140529962)
Registrant – Teligent Pharma, Inc. (011036910)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Teligent Pharma, Inc. | 011036910 | manufacture(63739-998) | |
Frequently asked questions
- Halobetasol vs. clobetasol – how do they compare?
- czy można to wykorzystać na trujący bluszcz?
- czy można go stosować na skórę głowy?
więcej o halobetasol miejscowe
- skutki uboczne
- podczas ciąży lub karmienia piersią
- Informacje o dawkowaniu
- interakcje leków
- Porównaj alternatywy
- Cennik& kupony
- 25 opinii
- Klasa narkotykowa: topical steroids
Consumer resources
- Patient Information
- Halobetasol Topical application (Advanced Reading)
Professional resources
- Prescribing Information
- Halobetasol (FDA)
- Halobetasol Cream (FDA)
- Halobetasol Foam (FDA)
Other brands Ultravate, Lexette, Bryhali, Halonate
Related treatment guides
- Plaque Psoriasis
- Eczema
- Psoriasis
- Atopic Dermatitis
- Granuloma Annulare
- Dermatitis
Medical Disclaimer
Leave a Reply